2. 杭州市职业病防治院;
3. 杭州师范大学医学院
噪声性听力损失(noise-induced hearing loss,NIHL)是一种由于劳动者长期暴露于噪声环境所引起的渐进性感音性听觉损害,约占全球范围内成人听力损失的16%,仅次于老年性耳聋,其中发展中国家明显高于发达国家[1]。中国约有1 000万工人在噪声超标环境下工作,其中约有100多万人患有不同程度的职业性耳聋[2]。NIHL是遗传和环境因素共同作用而导致的一类复杂性综合征[3]。研究表明,无论是动物实验还是人群研究,在相同暴露条件下,动物或人的听阈上移幅度不同,且相差较大,提示NIHL存在明显的个体易感性差异[4-5]。目前人群研究中已发现的NIHL可能易感基因有钾离子通道相关基因[6-7]、内耳结构相关基因[8-9]及氧化应激基因[10-13]等。近年来,虽然国内外学者对NIHL进行了大量研究,但其遗传机制尚不明了,需进一步阐明[14]。NIHL的发生是以耳蜗毛细胞损伤和死亡为基础的, 凋亡是噪声引起毛细胞死亡方式之一[15],半胱氨酸天冬氨酸蛋白酶(caspase)家族的活化是导致细胞凋亡的中心环节,其中CASP3和CASP7是主要执行者。国外文献报道,caspase-3(CASP3) 和caspase-7(CASP7) 基因多态与川崎病、肿瘤等发病密切相关[16-18],但与NIHL易感性的相关研究国内外报道较少。为此,本研究采用基于人群的病例对照研究,从2014年3—12月浙江省杭州市职业性噪声暴露工人的横断面调查中筛选出NIHL接噪工人和听力正常的接噪工人各272人,旨在了解汉族人群中CASP3和CASP7基因多态性与NIHL易感性的关联性,为NIHL危险人群的筛检及早期预警提供人群研究资料和理论依据。
1 对象与方法 1.1 对象纳入标准:(1) 噪声暴露≥1年的汉族工人;(2) 接触噪声前听力正常;(3) 无高血压、高血脂等现患疾病,无中耳炎、颅脑损伤等既往病史,无耳毒性药物服用史、无家族性遗传耳聋史及爆震性耳聋史;(4) 在听力检查前1个月内无发热史及其他常见病,如流感、腹泻、肺炎、肝炎等。于2014年3—12月,以统一的纳入标准选择浙江省杭州市机械加工、包装印刷、钢构生产等16家企业的噪声暴露工人共1 549人,其中男性1 341人,占86.6%;女性208人,占13.4%。采用1:1配对病例对照研究设计,根据上述纳入标准,结合听力检查资料和现场噪声暴露资料,以双耳高频平均听阈>25 dB(A)且不接触其他职业性危害因素的研究对象为病例人群,共272名工人;对照组选择与病例组工人同企业、同作业岗位,且双耳所有频段(包括500、1 000、2 000、3 000、4 000、6 000 Hz)听阈均≤25 dB(A)的工人,按同性别、同年龄(±5岁),同接噪工龄(±1年)的要求1:1配对。
1.2 方法根据课题要求,自行设计噪声接触工人个体情况调查表,主要内容包括:一般人口学资料,生活行为习惯(吸烟、睡眠、耳机使用等,其中吸烟分为从不吸烟,每周吸卷烟超过4次为偶尔吸烟,但平均每天不足1支,每天吸卷烟1支以上,连续或累计6个月为经常吸烟),噪声接触情况(噪声接触史、接噪工龄)和个体防护情况(其中耳塞佩戴<1 d/周为不佩戴,1~2 d/周为有时佩戴,≥3 d/周为经常佩戴),职业性有害因素接触情况,现患疾病情况、中耳炎等既往史、爆震性耳聋和家族性遗传史等。所有调查表均由经过培训的本课题组成员在征得研究对象知情同意并签字后采用面对面方式询问后填写。
1.3 听力检查和现场噪声测量由杭州市职业病防治院耳鼻喉科医师参照《职业性噪声聋诊断标准》(GBZ49—2007)[19]的要求,在本底值噪声<25 dB(A)的隔音室内,对所有对象进行左、右耳500、1 000、2 000、3 000、4 000、6 000 Hz 6个频率的纯音气导听阈测试,所有对象检查前均要求脱离噪声环境至少16 h,纯音测听结果按《声学一听阈与年龄关系的统计分布》(GB/T7582—2004) 进行年龄和性别修正[20],计算双耳高频(3 000、4 000、6 000 Hz)平均听阈,参照《GBZ49—2007》[19],双耳高频平均听阈>25 dB(A)者为双耳高频听力损失,反之则为非双耳高频听力损失。现场噪声测量依据《工作场所物理因素测量第8部分:噪声》(GBZ/T189.8—2007)[21],使用国产AWA6218型噪声统计分析仪(北京中西远大科技有限公司)进行分时段定点检测,生成8 h等效连续A声级(LAeq.8h)。根据环境噪声值及接噪工龄计算累积噪声暴露量(CNE)[22],以量化每个研究对象的噪声暴露,其公式为CNE=LAeq.8 h+10 logT(LAeq.8 h为8 h等效连续A声级,T为接噪工龄)。同时按国家有关标准规范对其他职业性危害因素进行现场识别、调查和检测,识别的职业病危害因素包括高温、粉尘、振动、有机溶剂(苯及同系物、苯乙烯、丙烯腈等)、重金属(铅、锰、镍等)等。
1.4 SNP位点的选择和基因分型基于dbSNP数据库(http://www.ncbi.nlm.nih.gov/snp/)、千人基因组计划(http://www.1 000genomes.org/)、SNP功能分析软件Variant Effect Predictor(http://asia.ensembl.org/info/docs/tools/vep/index.html)及SNP Function Prediction(http://snpinfo.niehs.nih.gov/snpinfo/snpfunc.htm),选取CASP3和CASP7基因上潜在的功能性SNP位点。入选标准:(1) 位于功能区:启动子区、编码区、5′UTR区、以及3′UTR区等;(2) 中国汉族人群最小等位基因频率(MAF)≥0.1;(3) 文献报道CASP3和CASP7与疾病关联的SNP位点。根据以上选择标准,选择rs1049216和rs10787498两位点进行分析。采集噪声接触工人静脉血5 mL,加入乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)钠盐抗凝,应用天根血液基因组DNA提取试剂盒提取DNA,基因分型授权上海捷瑞公司完成,捷瑞公司采用聚合酶链反应(polymerase chain reaction,PCR)-连接酶检测反应(ligase detection reaction,LDR)方法检测CASP3和CASP7基因多态性。随机抽取10%的样本进行重复检测,实验结果一致率为100%。
1.5 统计分析利用Epi Data 3.1建立数据库,使用SPSS 20.0软件进行统计分析。连续性变量的分析采用t检验,分类变量的分析采用χ2或Wilcoxon秩检验,Hardy-Weinberg平衡采用χ2拟合优度检验;采用单因素、多因素条件logistic回归分析并计算比值比(OR)和95%CI;以叉生分析计算基因-环境交互作用。P<0.05为差异有统计学意义。
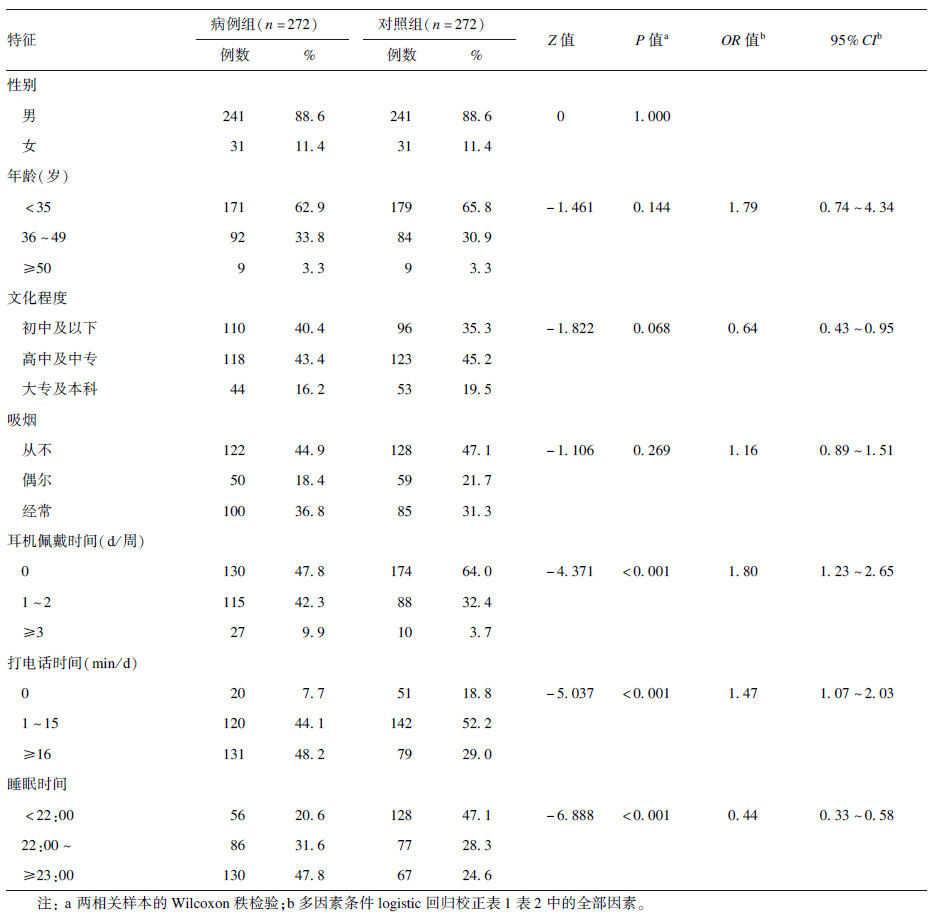
2 结果 2.1 研究对象的一般情况和噪声暴露情况 2.1.1 研究对象的一般情况(表 1)| 表 1 病例组与对照组一般情况比较 |
病例组和对照组人群的性别、年龄、文化程度、吸烟差异均无统计学意义(P>0.05),而耳机佩戴时间、打电话时间、睡眠时间差异有统计学意义(P<0.001)。2组人群性别完全匹配,年龄分别为(32.48±7.58) 和(31.70±7.67) 岁。以高频听力损失为因变量,年龄、文化程度、吸烟、耳机佩戴时间等因素为自变量,进行多因素条件logistic回归分析,结果表明,文化程度、耳机佩戴时间、打电话时间和睡眠时间与NIHL存在统计学关联,OR及其95% CI分别为0.64(0.43~0.95)、1.80(1.23~2.65)、1.47(1.07~2.03)、0.44(0.33~0.58)。
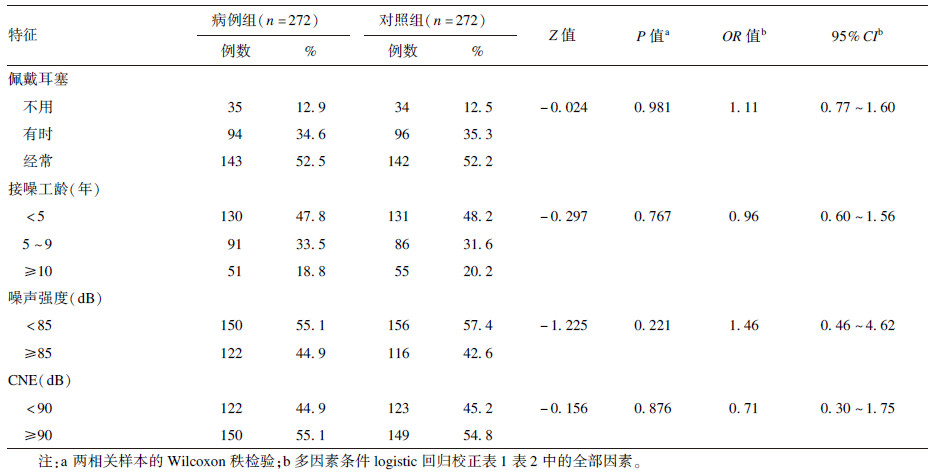
2.1.2 研究对象的噪声暴露情况(表 2)| 表 2 病例组与对照组噪声暴露情况比较 |
本研究人群主要接触稳态噪声,噪声暴露强度(LAeq.8 h)为64.6~97.8 dB(A),工人1个工作日内接触噪声时间从1到8 h不等。2组人群接噪工龄分别为(6.82±5.73) 和(6.88±5.82) 年,噪声暴露强度分别为(83.77±5.86) 和(83.53±5.81) dB(A),CNE两组分别为(90.76±6.95) 和(90.52±6.83) dB(A),以上因素2组间比较差异无统计学意义(均P>0.05)。多因素条件logistic回归分析也尚未发现与NIHL的统计学关联(P>0.05)。双高听阈病例组为(34.53±10.74) dB(A),对照组为(15.8±6.2) dB(A),差异有统计学意义(t=15.099,P<0.001)。
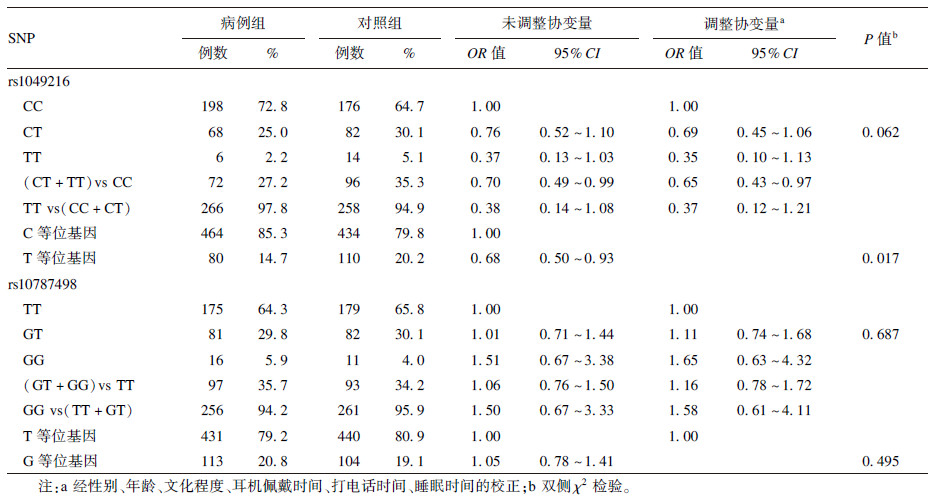
2.2 各基因型组间分布及与NIHL易感性关系(表 3)| 表 3 CASP3与CASP7基因型组间分布及与NIHL易感性关系 |
采用拟合优度χ2检验分析发现,2位点对照组的基因型频率分布均符合Hardy-Weinberg遗传平衡定律(P值分别为0.279、0.678)。单因素分析显示,rs1049216和rs10787498的3种基因型在病例组和对照组中分布差异均无统计学意义(P>0.05),但rs1049216位点的T等位基因是NIHL的保护因素,携带T等位基因的工人患NIHL的风险是携带C等位基因的0.68倍(P=0.017,95%CI=0.50~0.93),提示rs1049216位点可能与NIHL易感性有关。进一步经多因素条件logistic回归分析,校正性别、年龄、文化程度、耳机佩戴时间、打电话时间、睡眠时间等混杂因素影响后,rs1049216位点的显性模型[(CT+TT)vs CC)]中,CT+TT基因型是发生噪声性听力损失的保护因素,与CC基因型相比,调整OR(95%CI)为0.65(0.43~0.97)。rs10787498位点的共显性模型、显性模型和隐性模型均无统计学意义(P>0.05)。
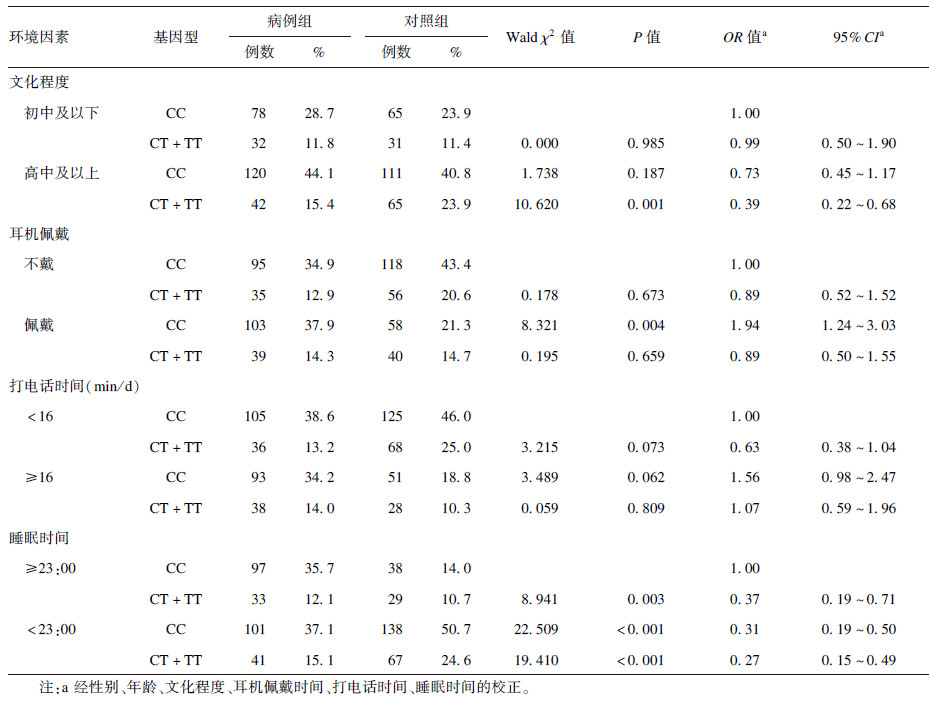
2.3 rs1049216位点与环境因素的交互作用(表 4)| 表 4 rs1049216与环境因素的交互作用分析 |
采用叉生分析方法对基因多态和环境因素各自的主效应和联合效应分别进行评估。由于rs1049216的突变纯合子数量偏少, 无法对交互效应准确分析, 故采用显性模型进行分析。由表 4可见,与rs1049216 CC基因型且文化程度在初中及以下的个体相比,rs1049216(CT+TT)基因型且文化程度在高中及以上的个体患NIHL的风险明显降低,校正相关混杂因素后,OR值为0.39,交互作用具有统计学意义(P=0.001)。同样,可以得出rs1049216与睡眠时间存在交互作用(P<0.001),但与耳机佩戴与否、打电话时间并不存在统计学意义上的交互作用(P>0.05)。
3 讨论多项研究已证明生理应激、炎症反应及氧化应激等刺激因素会激活caspase级联反应,导致内耳毛细胞及螺旋神经节细胞的凋亡[15, 23-24]。Caspases是细胞凋亡的核心,关于内耳细胞凋亡的研究表明,CASP3可能是细胞凋亡途径下游的关键执行者[25-26],直接参与DNA断裂、染色质凝聚和凋亡小体的形成,而CASP7与CASP3具有高度的同源性、相似的功能和相似的底物特异性。大鼠实验表明,缺乏CASP7会导致凋亡减弱[27]。人CASP3和CASP7基因分别定位于4q32~4q35.1及10q25.1~10q25.2处。
目前关于CASP3和CASP7基因人群多态性研究主要集中于川崎病、肿瘤等疾病[16-18],与NIHL易感性的相关研究国内外报道较少,但有动物研究表明,CASP3基因突变可导致老鼠感音神经性耳聋[28],进而引发我们的研究推测,CASP3和CASP7基因多态性是否与NIHL易感性相关。为此我们选择了2个功能性位点(rs1049216和rs10787498) 进行验证,它们均在基因的3′非翻译区。研究表明,单个位点的碱基变化很有可能引起mRNA结构的改变从而影响其功能,一个可能的解释是这2个位点影响了mRNA的结构进而影响其稳定性,但是由于关于上述位点的功能研究有限,此研究假设需进一步的研究证实。
在本研究的样本人群中,我们观察到2位点的最小等位基因频率(minor allele frequency, MAF)分别为20.2%和19.1%,与千人基因组计划报道的北京地区汉族人群(CHB)的MAF值(22%和19%)一致[29-30]。采用Hardy-Weinberg平衡检验分析进一步显示,其等位基因实际检出率与计算理论值十分接近,进一步表明本研究所选的观察样本符合Hardy-Weinberg平衡,其SNP分析数据可靠。
本研究尚未发现CASP7 rs10787498位点与NIHL存在统计学意义的关联(P>0.05),出现这种情况的原因可能是NIHL是一种复杂疾病,是遗传因素和环境因素共同参与和相互作用的结果,rs10787498可能与其他的SNP或者环境因素存在交互作用,导致其效应被掩盖。但我们发现CASP3 rs1049216位点携带突变基因型(CT+TT)的个体患NIHL的风险是携带野生基因型CC的0.65倍,调整的95%CI为0.43~0.97,说明相对于野生型C等位基因来说,突变型T等位基因为NIHL的保护因素。
本研究进一步结合环境因素探讨了基因与环境的联合作用,当rs1049216位点(CT+TT)基因型与文化程度、睡眠时间结合并校正性别、年龄、耳机佩戴时间等混杂因素后,发现文化程度越高、睡眠时间越早,(CT+TT)基因型的保护作用越明显(OR值变小且差异有统计学意义),这与以往的横断面研究结果[31-33]相佐证,同时也说明基因-环境交互作用在NIHL的发生中发挥了不可忽视的作用。
综上所述,本研究发现CASP3基因rs1049216位点与汉族人群NIHL遗传易感性存在显著关联,且与文化程度、睡眠时间存在交互作用,因此可以初步推断CASP3是NIHL可能的易感基因。本研究也存在不足之处,如诊断为职业性噪声聋低频听力损失的职工已全部被调离噪声岗位,本次研究未能纳入,可能带来选择性偏倚等。在后继研究中,我们将进一步完善实验设计,在更大样本量的人群中或者开展前瞻性的队列研究,以进一步验证CASP3与NIHL之间的关系。
| [1] | Nelson DI, Nelson RY, Concha-Barrientos M, et al. The global burden of occupational noise-induced hearing loss[J]. American Journal of Industrial Medicine, 2005, 48(6): 446–458. DOI:10.1002/(ISSN)1097-0274 |
| [2] | 檀忠勤. 噪声对听力和心血管系统影响的研究现状(综述)[J]. 中国城乡企业卫生, 2006(1): 18–19. |
| [3] | Konings A, Van Laer L, Van Camp G. Genetic studies on noise-induced hearing loss:a review[J]. Ear and Hearing, 2009, 30(2): 151–159. DOI:10.1097/AUD.0b013e3181987080 |
| [4] | Davis RR, Newlander JK, Ling XB, et al. Genetic basis for susceptibility to noise-induced hearing loss in mice[J]. Hearing Research, 2001, 155(1): 82–90. |
| [5] | Taylor W, Pearson J, Mair A, et al. Study of noise and hearing in jute weaving[J]. The Journal of the Acoustical Society of America, 1965, 38(1): 113–120. DOI:10.1121/1.1909580 |
| [6] | Van Laer L, Carlsson PI, Ottschytsch N, et al. The contribution of genes involved in potassium-recycling in the inner ear to noise-induced hearing loss[J]. Human Mutation, 2006, 27(8): 786–795. DOI:10.1002/humu.v27:8 |
| [7] | Pawelczyk M, Van Laer L, Fransen E, et al. Analysis of gene polymorphisms associated with K+ ion circulation in the inner ear of patients susceptible and resistant to noise-induced hearing loss[J]. Annals of Human Genetics, 2009, 73(4): 411–421. DOI:10.1111/ahg.2009.73.issue-4 |
| [8] | Konings A, Van Laer L, Wiktorek-Smagur A, et al. Candidate gene association study for noise-induced hearing loss in two independent noise-exposed populations[J]. Annals of Human Genetics, 2009, 73(2): 215–224. DOI:10.1111/ahg.2009.73.issue-2 |
| [9] | Kowalski TJ, Pawelczyk M, Rajkowska E, et al. Genetic variants of CDH23 associated with noise-induced hearing loss[J]. Otology and Neurotology, 2014, 35(2): 358–365. DOI:10.1097/MAO.0b013e3182a00332 |
| [10] | Konings A, Van Laer L, Pawelczyk M, et al. Association between variations in CAT and noise-induced hearing loss in two independent noise-exposed populations[J]. Human Molecular Genetics, 2007, 16(15): 1872–1883. DOI:10.1093/hmg/ddm135 |
| [11] | Shen H, Huo X, Liu K, et al. Genetic variation in GSTM1 is associated with susceptibility to noise-induced hearing loss in a Chinese population[J]. Journal of Occupational and Environmental Medicine, 2012, 54(9): 1157–1162. DOI:10.1097/JOM.0b013e31825902ce |
| [12] | Li XT, Li X, Hu FF, et al. Association between paraoxonase 2 gene polymorphisms and noise-induced hearing loss in the Chinese population[J]. Journal of Occupational Health, 2012, 55(2): 56–65. DOI:10.1539/joh.12-0242-OA |
| [13] | Shen H, Cao J, Hong Z, et al. A functional Ser326Cys polymorphism in hOGG1 is associated with noise-induced hearing loss in a Chinese population[J]. PLoS One, 2014, 9(3): e89662. DOI:10.1371/journal.pone.0089662 |
| [14] | Sliwinska-Kowalska M, Pawelczyk M. Contribution of genetic factors to noise-induced hearing loss:a human studies review[J]. Mutation Research/Reviews in Mutation Research, 2013, 752(1): 61–65. DOI:10.1016/j.mrrev.2012.11.001 |
| [15] | de Beeck KO, Schacht J, Van Camp G. Apoptosis in acquired and genetic hearing impairment:the programmed death of the hair cell[J]. Hearing Research, 2011, 281(1): 18–27. |
| [16] | Xing Y, Wang H, Liu X, et al. Meta-analysis of the relationship between single nucleotide polymorphism rs72689236 of caspase-3 and Kawasaki disease[J]. Molecular Biology Reports, 2014, 41(10): 6377–6381. DOI:10.1007/s11033-014-3517-7 |
| [17] | Wang MY, Zhu ML, He J, et al. Potentially functional polymorphisms in the CASP7 gene contribute to gastric adenocarcinoma susceptibility in an eastern Chinese population[J]. PLoS One, 2013, 8(9): e74041. DOI:10.1371/journal.pone.0074041 |
| [18] | Yan S, Li YZ, Zhu XW, et al. HuGE systematic review and meta-analysis demonstrate association of CASP-3 and CASP-7 genetic poly-morphisms with cancer risk[J]. Genet Mol Res, 2013, 12(2): 1561–1573. DOI:10.4238/2013.May.13.10 |
| [19] | 中华人民共和国卫生部. GBZ49—2007职业性噪声聋诊断标准[S]. 北京: 人民卫生出版社, 2007. |
| [20] | 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 7582—2004声学听阈与年龄关系的统计分布[S]. 北京: 中国标准出版社, 2004. |
| [21] | 中华人民共和国卫生部. GBZ/T189. 8—2007工作场所物理因素测量第8部分: 噪声[S]. 北京: 人民卫生出版社, 2007: 1-4. |
| [22] | 赵一鸣, 程明昆. 噪声累积暴露研究的进展[J]. 中华劳动卫生职业病杂志, 1998, 16(2): 123–124. |
| [23] | Moser T, Predoehl F, Starr A. Review of hair cell synapse defects in sensorineural hearing impairment[J]. Otology and Neurotology, 2013, 34(6): 995–1004. DOI:10.1097/MAO.0b013e3182814d4a |
| [24] | Henderson D, Bielefeld EC, Harris KC, et al. The role of oxidative stress in noise-induced hearing loss[J]. Ear and Hearing, 2006, 27(1): 1–19. DOI:10.1097/01.aud.0000191942.36672.f3 |
| [25] | Mazumder S, Plesca D, Almasan A.Caspase-3 activation is a critical determinant of genotoxic stress-induced apoptosis[M]//Apoptosis and Cancer, Humana Press, 2008:13-21. |
| [26] | Walters J, Pop C, Scott F, et al. A constitutively active and uninhibitable caspase-3 zymogen efficiently induces apoptosis[J]. Biochem J, 2009, 424: 335–345. DOI:10.1042/BJ20090825 |
| [27] | Lakhani SA, Masud A, Kuida K, et al. Caspases 3 and 7:key mediators of mitochondrial events of apoptosis[J]. Science, 2006, 311(5762): 847–851. DOI:10.1126/science.1115035 |
| [28] | Parker A, Hardisty-Hughes RE, Wisby L, et al. Melody, an ENU mutation in Caspase 3, alters the catalytic cysteine residue and causes sensorineural hearing loss in mice[J]. Mammalian Genome, 2010, 21(11-12): 565–576. DOI:10.1007/s00335-010-9306-2 |
| [29] | The International HapMap Consortium.the variation of rs1049216[EB/OL].http://asia.ensembl.org/Homo_sapiens/Variation/Population?db=core; r=4:184628435-184629435;v=rs1049216;vdb=variation; vf=753023#622_tablePanel, 2016-03-16/2016-03-16. |
| [30] | The International HapMap Consortium.the variation of rs10787498[EB/OL].http://asia.ensembl.org/Homo_sapiens/Variation/Population?db=core; r=10:113729391-113730391;v=rs10787498;vdb=variation; vf=6010841, 2016-03-16/2016-03-16. |
| [31] | Lee JS, Choi HG, Jang JH, et al. Analysis of predisposing factors for hearing loss in adults[J]. Journal of Korean Medical Science, 2015, 30(8): 1175. DOI:10.3346/jkms.2015.30.8.1175 |
| [32] | Feder K, Michaud D, Ramage-Morin P, et al. Prevalence of hearing loss among Canadians aged 20 to 79:audiometric results from the 2012/2013 Canadian Health Measures Survey[J]. Health Reports, 2015, 26(7): 18–25. |
| [33] | Nakamura M, Aoki N, Nakashima T, et al. Smoking, alcohol, sleep and risk of idiopathic sudden deafness:a case-control study using pooled controls[J]. Journal of Epidemiology, 2001, 11(2): 81–86. DOI:10.2188/jea.11.81 |
 2017, Vol. 33
2017, Vol. 33