2. 北京奥博星生物技术有限责任公司
大肠菌群是反映食品卫生状况的重要指示菌,同时也包括了致病性较强的大肠杆菌如O157、O26、O45、O103、O111、O121和O145等[1],由于大肠菌群覆盖的属、种较多[2],其生长需求也必然存在差异,因此,使该类菌均得到快速、均衡生长,才能保证检测结果的准确性[3]。生长曲线测定方法是较为理想的方法[4],本研究用全自动生长曲线测定仪测定了8种不同类型的蛋白胨对4种大肠菌群代表性菌株的生长曲线,并通过月桂基硫酸盐胰蛋白胨肉汤(lauryl sulfate tryptone broth,LST)观察了产气情况,评价不同类型蛋白胨支持大肠菌群生长效果,验证全自动生长曲线方法筛选原材料的可靠性。
1 材料与方法 1.1 实验菌株大肠埃希菌IQCC10126,阴沟肠杆菌IQCC10461,弗氏柠檬酸杆菌IQCC10203,肺炎克雷伯菌IQCC10302(中国检验检疫微生物菌种保藏管理中心)。
1.2 主要试剂与仪器明胶蛋白胨(gelysate peptone货号:211870);细菌胨(bacto pepton货号:211677);多价胨(polypeptone货号:211910);细菌眎胨(bacto proteose peptone货号:211684);胰眎胨(bacto tryptose货号:211713);胰酪胨(trypticase peptone货号:211921);胰酪胨(bacto tryptone货号:21705),M9 minimal salts,胰酪胨大豆肉汤(tryptic soytone broth,TSB)、胰酪胨大豆琼脂(tryptic soytone agar,TSA)(以上均为美国BD公司产品)。大豆胨(批号:20121228,北京奥博星生物技术有限公司)。全自动生长曲线分析仪(芬兰Bioscreen公司)。
1.3 方法 1.3.1 菌株制备将实验菌株接种于TSB,36 ℃培养18 h后,再接种在TSA平板,36 ℃培养18 h后,挑取菌落用试验培养基,制成均匀混悬液,配制成0.5麦氏浊度备用。
1.3.2 测试培养基配制测试原材料的培养基[5]:试验蛋白胨1%;M9培养基(Na2HPO4, 33.9 g; KH2 PO4, 15.0 g; NaCl, 2.5 g; NH4Cl, 5.0 g)1.13%;葡萄糖0.4%,按上述比例称量后,溶于1 L去离子水中,121 ℃高压15 min。实际应用效果测试培养基:作为原材料制成大肠菌群测定培养基LST,按照GB/T 4789.3-2010附录A.1[5]配制。
1.3.3 测试方法将0.5麦氏浊度菌悬液与测试培养基以1:200进行稀释(A值 < 0.02),培养温度为36 ℃,测定间隔时间为10 min,测定波长600 nm,连续测定24 h。产气实验:将8种不同类型蛋白胨按照文献[5]分别配制成LST肉汤培养基,成分:胰蛋白胨或胰酪胨20.0 g,氯化钠5.0 g,乳糖5.0 g,K2HPO42.75 g,KH2PO42.75 g,月桂基硫酸钠0.1 g,蒸馏水1 000 mL,pH 6.8±0.2。
1.4 统计分析4株代表性实验菌株在原材料测试培养基(M9培养基)、实际应用效果测试培养基(LST)A≥0.3所需要的生长时间以及培养24 h的最终A值。应用SPSS 19.0软件,采用多组样本间差异显著性分析(Duncan test)方法对8种蛋白胨支持大肠菌群代表性实验菌株生长的A值达到0.3所需时间及最大A值进行单因素分析,P < 0.05有统计学意义。
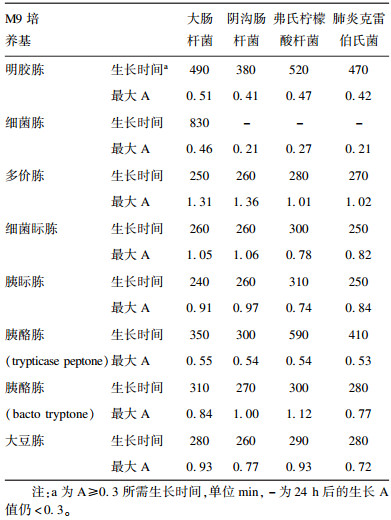
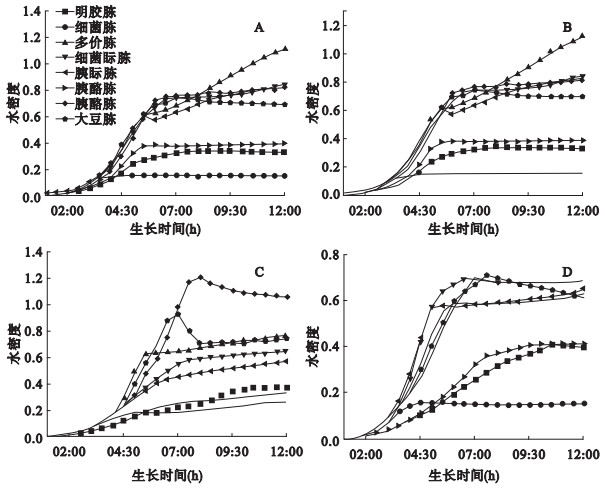
2 结果 2.1 实验菌株在不同蛋白胨配制M9培养基中的生长曲线测定(图 1)
|
注:A为大肠埃希菌IQCC10126,B为阴沟肠杆菌IQCC10461,C为弗氏柠檬酸杆菌IQCC10203,D为肺炎克雷伯菌IQCC10302。 图 1 大肠菌群4个代表性菌株在M9培养基中36 ℃培养12 h的生长曲线 |
大肠杆菌和阴沟肠杆菌生长情况非常相似;柠檬酸杆菌和克雷伯氏菌之间以及与大肠杆菌、阴沟肠杆菌相比生长情况不同。8种蛋白胨支持大肠菌群的生长能力大致可划分为2组,多价胨、细菌眎胨、胰眎胨(bacto tryptose)、胰酪胨(bacto tryptong)和大豆胨培养24 h后的A > 0.6,支持大肠菌群生长较好能力,而明胶蛋白胨、细菌胨;胰酪胨(trypticase peptone)培养24 h后的A < 0.4,支持大肠菌群的生长能力相对较差。
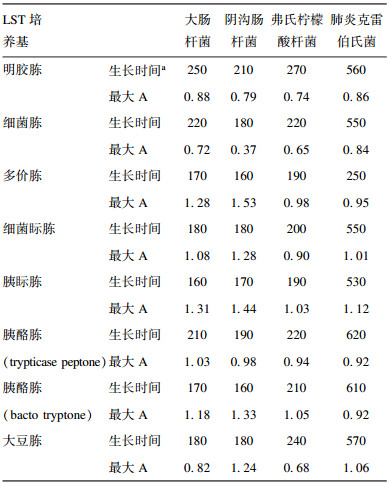
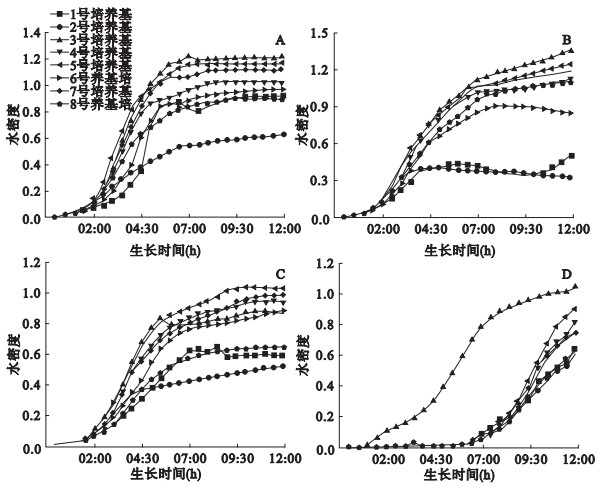
2.2 实验菌株在不同蛋白胨配制的LST培养基中的生长曲线测定(图 2)
|
注:E为大肠埃希菌IQCC10126,F为阴沟肠杆菌IQCC10461,G为弗氏柠檬酸杆菌IQCC10203,H为肺炎克雷伯菌IQCC10302。 图 2 大肠菌群4个代表性菌株在LST培养基中36 ℃培养12 h的生长曲线 |
与M9培养基中的生长情况相比,大肠菌群4种代表性菌株在LST培养基中生长情况总体好于M9培养基,表现在培养24h后的A均超过0.4,但总体趋势与M9培养基中生长情况一致,即多价胨、细菌眎胨、胰眎胨(bacto tryptose)、胰酪胨(bacto tryptong)和大豆胨培养好于明胶蛋白胨、细菌胨;胰酪胨(trypticase peptone)。
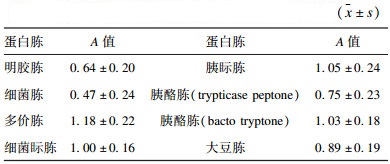
2.3 蛋白胨支持大肠菌群菌株生长单因素分析(表 1、2、3)| 表 1 大肠菌群代表性菌株在M9培养基中生长曲线测定A值 |
| 表 2 大肠菌群代表性菌株在LST培养基中生长曲线测定A值 |
| 表 3 不同类型蛋白胨支持大肠菌群生长能力比较 |
大肠杆菌、阴沟肠杆菌、弗氏柠檬酸杆菌和肺炎克雷伯氏菌在8种不同类型蛋白胨配制的M9培养基、LST培养基中测定A值达到0.3时的生长时间和生长24 h时的测定A值。应用SPSS 19.0软件分析,对大肠菌群在M9培养基和LST培养基中的生长情况进行合并分析,采用多组样本间差异性分析(Duncan test)方法,测定A值达到0.3时的生长时间无明显差异,然而在生长24 h时的测定A值方面存在差异明显,说明蛋白胨的种类对于肠菌群的生长有很大影响,可优先选择3号蛋白胨即多价蛋白胨。
2.4 产气实验观察产气量是测定大肠菌群的特征性指标,按照文献[5]用不同蛋白胨配制的LST培养基中进行了产气观察,结果产气量大小趋势与生长曲线状况基本一致,即多价胨、细菌眎胨、胰眎胨(bacto tryptose)、胰酪胨(bacto tryptone)和大豆胨培养好于明胶蛋白胨、细菌胨;胰酪胨(trypticase peptone)。
3 讨论蛋白胨是培养基制作最重要的基础材料,实验结果发现,不同来源原料和相同原料采用不同制作工艺生产出的产品对不同大肠菌群的生长支持能力存在差异,国标《食品微生物学检验粪大肠菌群计数》(GB 4789.39-2013)[6]指定LST培养基使用的蛋白胨为胰蛋白胨或胰酪胨,但是胰蛋白胨或胰酪胨在促大肠菌群生长效果并不完全相同,胰酪胨优于胰蛋白胨,然而同样都是胰酪胨,bacto tryptone要好于trypticase peptone,这提醒技术人员在日常工作中,要了解蛋白胨的特性和适用范围,合理选择原材料。大肠菌群4种代表性菌株在8种不同类型蛋白胨配制的LST培养基和M9培养基中生长情况及产气量大小趋势一致,但在LST培养基中生长总体情况好于M9培养基,这可能与LST中营养成分浓度大幅度提高有关。本次实验的测试培养基使用的M9培养基,由磷酸盐、NaCl、葡萄糖和蛋白胨组成,磷酸盐为缓冲系统,氯化钠维持渗透压,微量葡萄糖为细菌生长提供碳源,满足了细菌生长的基础条件,而且与LST培养基相比,通过生长曲线测定,M9培养基更能灵敏反应蛋白胨支持目标菌的生长能力,因此,用M9培养基筛选原材料较为适宜。微生物生长曲线由实验数据绘制[7],可以采用测定A值的浊度法或直接计数法[8],但是要精确得到对数生长期的数据则需要根据微生物曲线方程,然而要得出曲线方程无论采取哪种方法都比较繁琐[9-10],本研究按照测定A值递增进行区段分析,方法简单,但是非常实用,能够达到分析的目的。
微生物检验新方法的研究或制定新标准,必然离不开培养基,尤其是开发新配方时必须仔细选择适宜的蛋白胨,我国培养基原材料生产厂家由于缺乏准确的质控方法[11-12],不仅不能保证不同批次产品质量一致,还无法对产品分类,另外,在疯牛病出现之后,国外不断开发以植物蛋白质为来源的新型蛋白胨替代动物源性产品,而我国原材料及培养基生产厂家缺乏准确、高通量的检测手段,使我们在原材料的开发方面与国外差距加大。相信自动化生物曲线测定方法将在培养基原材料选择、质量控制及新产品开发中发挥作用。
| [1] | Kalchayanand N, Arthur TM, Bosilevac JM, et al. Chromogenic agar medium for detection and isolation of Escherichia coli serogroups O26, O45, O103, O111, O121, and O145 from fresh beef and cattle feces[J]. Journal of Food Protection, 2013, 76(2): 192–199. DOI:10.4315/0362-028X.JFP-12-182 |
| [2] | Fiello M, Mikell AT, Moore MT, et al. Variability in the characterization of total coliforms, fecal coliforms and Escherichia coli in recreational water supplies of North Mississippi, USA[J]. Environmental Contamination and Toxicology, 2014, 93(2): 133–137. DOI:10.1007/s00128-014-1299-1 |
| [3] | Maheux AF, Boudreau DK, Bisson MA, et al. Molecular method for detection of total coliforms in drinking water samples[J]. Appl Environ Microbiol, 2014, 80(14): 4074–4084. DOI:10.1128/AEM.00546-14 |
| [4] | Zlosnik JE, Gunaratnam LC, Speert DP. Serum susceptibility in clinical isolates of Burkholderia cepacia complex bacteria:development of a growth-based assay for high throughput determination[J]. Front Cell Infect Microbiol, 2012, 2(67): 1–10. |
| [5] | 中华人民共和国卫生部. GB 4789. 3-2010食品安全国家标准食品微生物学检验大肠菌群计数[S]. 北京, 标准出版社, 2010年. http://www.oalib.com/paper/4202643 |
| [6] | 中华人民共和国国家卫生和计划生育委员会. GB 4789. 39-2013食品安全国家标准食品微生物学检验粪大肠菌群计数[S]. 北京, 标准出版社, 2014年. |
| [7] | 郑冰婷, 董泓宏, 张树辉, 等. 嗜热链球菌生长曲线的绘制[J]. 大家健康, 2013, 7(8): 197–197. |
| [8] | 李晶晶, 刘瑛, 成家杨, 等. 深圳海域6株破囊壶菌的生长特性及油脂成分分析[J]. 微生物学通报, 2015, 42(1): 17–23. |
| [9] | 杨改强, 霍丽娟, 丁庆伟, 等. 时域有限差分法模拟微生物生长曲线[J]. 太原科技大学学报, 2009, 30(4): 355–358. |
| [10] | 张振男, 郁二蒙, 谢骏, 等. 不同脆化阶段草鱼肠道菌群动态变化、血清酶指标及生长性能[J]. 农业生物技术学报, 2015, 23(2): 151–160. |
| [11] | 李卫华, 赵贵明, 张建军, 等. SN/T 1538. 1-2005培养基制备指南第1部分: 实验室培养基制备质量保证通则[S]. 北京, 标准出版社, 2005. |
| [12] | 中华人民共和国卫生部. WS/T 232-2002商业性微生物培养基质量检验规程[S]. 北京, 标准出版社, 2002. http://www.docin.com/p-598170202.html |
 2017, Vol. 33
2017, Vol. 33