肺泡巨噬细胞是矽尘作用的主要靶细胞,细胞吞噬矽尘颗粒后,可引起细胞膜发生脂质过氧化及损伤,从而产生大量氧自由基,游离SiO2粉尘使以肺泡巨噬细胞膜为主的生物膜损伤是矽肺发病的主要原因[1-2]。N-乙酰半胱氨酸(N-acetyl-L-cysteine,NAC)是被广泛使用的抗氧化剂,能干扰活性氧,清除已经生成的自由基[3]。本研究采用游离SiO2粉尘离体刺激大鼠肺泡巨噬细胞珠NR8383细胞,NAC干预染尘NR8383细胞,通过观察细胞自噬蛋白表达,探讨NAC在染尘大鼠肺泡巨噬细胞NR8383自噬中的作用,旨在为矽肺纤维化的机制研究提供参考依据。结果报告如下。
1 材料与方法 1.1 主要试剂与仪器大鼠肺泡巨噬细胞(NR8383) 购于美国ATCC细胞库;大鼠肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、转化生长因子-βⅠ(transforming growth factor-βⅠ,TGF-βⅠ)试剂盒(杭州联科生物技术有限公司),F-12K培养基(美国GIBCO公司),胎牛血清、青链霉素双抗(美国MP公司),Alexa Fluor® 488标记羊抗兔IgG抗体(美国Life Technologies公司),微管相关蛋白1轻链3(light chain 3, LC3) 多克隆抗体(美国Sigma公司),山羊抗兔辣根过氧化物酶IgG抗体(美国Cell Signaling Technology公司),甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(美国Affinity生物技术有限公司),磷酸氯喹(chloroquine diphosphate,CDP)(日本TCI公司);游离silicon dioxide (SiO2)粉尘(美国Sigma公司)粒径范围在0.50~10 μm,80%粒子直径在1~5 μm之间,用生理盐水配制成0.5 g/L混悬液,高压蒸汽灭菌,使用前充分混匀;N-乙酰半胱氨酸(美国Sigma公司)用二甲基亚砜(dimethyl sulfoxide,DMSO)配制成100 mmol/L母液,4 ℃冷藏备用。FV1000激光扫描共聚焦显微镜(日本Olympus公司),SpectraMax(r) M5多功能酶标仪(美国Molecular Devices公司),FluorChemTM HD2高灵敏化学发光凝胶成像系统(美国Protein Simple公司),Eppendorf 5424离心机(德国Eppendorf公司)。
1.2 指标与方法 1.2.1 染尘不同时间点细胞上清液中TNF-α和TGF-βⅠ检测将NR8383细胞置于含有15%胎牛血清、1%青链霉素的F-12K培养液中培养。以1×106个/mL浓度将细胞接种到6孔板中,实验设对照组和矽尘组(50 mg/L),每组4个平行样,分别孵育3、6、12、20、24 h收集细胞上清液,1 500 r/min,离心10 min,-20 ℃保存备用。实验步骤严格按照试剂盒要求进行,30 min内用酶标仪测定450 nm波长吸光度(A)值,参考波长设定为630 nm。根据细胞因子表达,选择最佳时间点,给予NAC进行干预,NAC剂量为10 mmol/L,检测NR8383细胞上清液中TNF-α和TGF-βⅠ含量。
1.2.2 NR8383细胞中LC3蛋白表达检测(激光共聚焦显微镜观察)将细胞分为3组,即对照组、矽尘组(50 mg/L)和NAC(10 mmol/L)+矽尘(50 mg/L)组,共聚焦小皿培养20 h后,磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤,4%多聚甲醛固定细胞,PBS清洗,0.2% Trion X-100处理细胞15 min后加入5%羊血清封闭,加入LC3抗体(1:200)4 ℃孵育过夜,PBS洗涤3次,滴加荧光二抗(1:400) 室温孵育1 h,PBS洗涤3次,于激光扫描共聚焦显微镜(激发波长:495 nm,发射波长:519 nm)下观察。
1.2.3 NR8383细胞中LC3蛋白表达检测(Western blot法)将细胞分为3组,即对照组、矽尘组、NAC+矽尘组,每组3个平行样,收集各组细胞,加入radioimmunoprecipitation assay (RIPA)细胞裂解液,冰浴放置30 min,4 ℃,12 000 g,离心10 min,收集上清,采用BCA法蛋白定量试剂盒按照说明书步骤进行蛋白定量。12%聚丙烯酰胺凝胶电泳(sodium dodecyl-polyacryl gradient gel electrophoresis, SDS-PAGE),转膜,5%脱脂牛奶封闭1 h,一抗4 ℃孵育过夜,二抗室温孵育2 h,Tris-buffered saline/Triton-X100 (TBST)洗膜3次,5 min/次,electrogenerated chemiluminescence (ECL)化学发光,采用高灵敏化学发光凝胶成像系统分析蛋白表达量。
1.3 统计分析计量资料用x±s表示,采用SPSS 16.0软件进行统计分析,样本均数2组比较采用t检验,多组间均数比较采用单因素方差分析,当差异有统计学意义时,用最小显著差法进行两两比较,P<0.05为差异有统计学意义。
2 结果 2.1 矽尘对NR8383细胞上清液中TNF-α和TGF-βⅠ表达影响(表 1)| 表 1 染尘对NR8383细胞上清液中TNF-α及TGF-βⅠ含量影响(x±s,pg/mL,n=4) |
与对照组比较,染尘12、20、24 h时,矽尘组NR8383细胞上清液中TNF-α表达量明显升高,差异有统计学意义(P<0.05);呈时间效应关系。与对照组比较,在染尘20、24 h时,矽尘组NR8383细胞上清液中TGF-βⅠ表达升高,差异有统计学意义(P<0.05),染尘6 h后,随着时间延长,细胞上清液中TGF-βⅠ表达量逐渐升高。
2.2 NAC干预对NR8383细胞上清液中TNF-α和TGF-βⅠ表达影响结果显示,对照组、矽尘组、NAC+矽尘组NR8383细胞上清中TNF-α含量分别为(152.79±47.53)、(1 823.58±764.85)、(116.82±8.98) pg/mL;与对照组比较,矽尘组NR8383细胞上清中TNF-α含量明显升高(P<0.01);与矽尘组比较,NAC+矽尘组NR8383细胞上清中TNF-α含量下降,差异有统计学意义(P<0.05)。对照组、矽尘组、NAC+矽尘组NR8383细胞上清中TGF-βⅠ含量分别为(6.28±2.37)、(14.28±5.71)、(8.27±3.62) pg/mL;与对照组比较,矽尘组NR8383细胞上清中TGF-βⅠ含量升高,差异有统计学意义(P<0.05)。
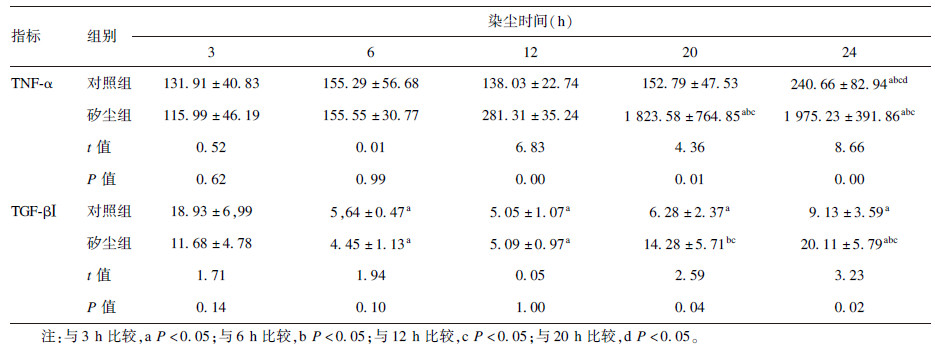
2.3 NAC干预对NR8383细胞LC3蛋白表达影响(图 1)
|
注:A:对照组;B:矽尘组;C:NAC+矽尘组。绿色代表LC3的表达。 图 1 NAC干预对巨噬细胞LC3表达影响(染尘20 h,免疫荧光,×400) |
结果显示,与对照组比较,矽尘组NR8383细胞LC3蛋白荧光信号增强;与矽尘组比较,NAC+矽尘组胞内荧光信号无明显变化;加入溶酶体抑制剂CDP阻断自噬降解后,各组NR8383细胞LC3蛋白表达均增强。
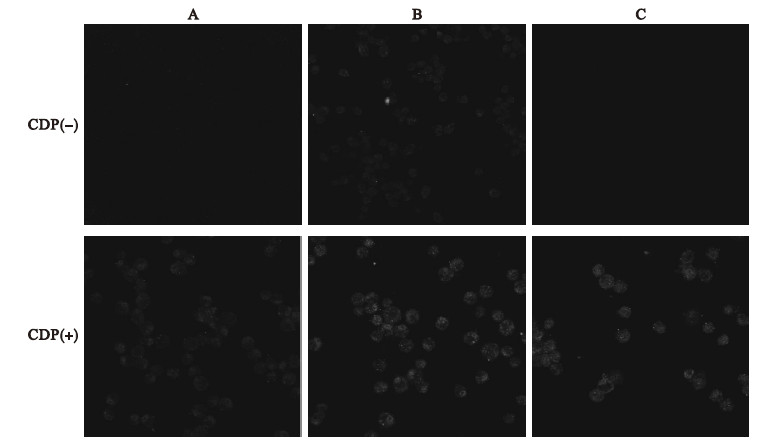
2.4 NAC干预对NR8383细胞LC3蛋白表达影响(图 2)
|
图 2 NAC干预对NR8383细胞LC3蛋白表达影响(CDP+) |
结果显示,在染尘20 h时各组均未检测到LC3蛋白,表明在染尘20 h时,NR8383细胞LC3蛋白已经降解;加入溶酶体抑制剂CDP后,对照组、矽尘组、NAC+矽尘组NR8383细胞LC3蛋白表达量分别为(2.24±0.56)、(3.84±0.53)、(3.52±0.57) pg/mL:与对照组比较,矽尘组NR8383细胞LC3蛋白表达升高,差异有统计学意义(P<0.05);与矽尘组比较,NAC+矽尘组NR8383细胞LC3表达呈降低趋势,但差异无统计学意义(P>0.05)。
3 讨论游离二氧化硅粉尘引起肺泡巨噬细胞损伤是矽肺发生的初始环节,粉尘进入机体后,肺泡巨噬细胞将其吞噬,活化后的巨噬细胞可以合成和分泌大量细胞因子,这些细胞因子是调控肺部炎症和矽肺进展的重要活性物质[4],其中TNF-α和TGF-βⅠ是最关键细胞因子[5-7]。TNF-α和TGF-βⅠ在肺泡巨噬细胞致炎和致纤维化中起着核心作用,TGF-βⅠ被认为是迄今最强的细胞外基质沉淀剂[8-9],在博来霉素诱导的大鼠肺纤维化模型中,肺部纤维化的炎症反应、胶原含量及前炎症因子TNF-α、IL1β表达显著升高[10]。本研究结果显示,染尘肺泡巨噬细胞中,TNF-α和TGF-βⅠ表达在染尘20和24 h时表达量无明显差异,且20 h细胞状态较好,因此,本研究选择染尘20 h为细胞模型的染尘时间。给予抗氧化剂NAC干预后,结果显示,NAC+矽尘组NR8383细胞上清中TNF-α表达低于矽尘组,而TGF-βⅠ表达量在NAC+矽尘组与矽尘组NR8383细胞上清中无明显差异,提示NAC可能在20 h对染尘肺泡巨噬细胞中TNF-α的表达影响更大。
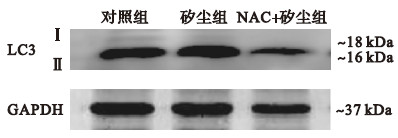
自噬具有保护细胞和引起细胞损伤的双重作用,是真核细胞降解胞内多余或损伤的细胞器和蛋白质的已知唯一途径[11],活性氧(reactive oxygen species,ROS)是调控自噬的重要信号分子之一。ROS在细胞内正常代谢过程中产生,包括羟自由基、超氧阴离子、过氧化氢等,过多ROS可损害细胞内蛋白质、脂肪、核酸及细胞器。矽肺发生过程中产生大量自由基[12]。自噬被诱导之后在激光共聚焦显微镜下可清晰的观测到LC3染色信号呈点状聚集增多[13],微管相关蛋白LC3是自噬的一个标志蛋白[14]。本研究结果显示,矽尘组NR8383细胞自噬的荧光信号强于对照组,NAC+矽尘组与矽尘组比较荧光信号无明显差异,提示在20 h SiO2诱导肺泡巨噬细胞自噬增强,而抗氧化剂NAC的抗氧化、清除自由基作用可能在染尘20 h时与自噬的发生机制关联较弱,或虽可能参与矽尘诱导的自噬过程,但在染尘20 h时作用不明显。LC3有2种形式即Ⅰ型和Ⅱ型,LC3-Ⅰ散在分布于胞浆中,自噬被诱导之后,胞浆中均匀分布的LC3-Ⅰ与PE结合形成脂质化形式的LC3-Ⅱ,LC3-Ⅱ定位于自噬体膜上[15],LC3-Ⅱ/LC3-Ⅰ比值在某种程度上反映了细胞的自噬强弱[16]。Western blot结果显示,与对照组比较,NAC+矽尘组NR8383细胞中LC3蛋白表达升高,与矽尘组比较无明显差异,这与激光共聚焦观察结果相吻合。
通常评估自噬活动水平是观察自噬体的数量或者检测LC3-Ⅱ含量,然而自噬体的累积也有可能由其他原因引起如自噬体成熟、降解途径受阻。因此,区别自噬的增加是由于诱导增强还是自噬过程受阻所致十分必要,自噬通量分析便是基于自噬动态检测的方法,通过比较溶酶体抑制剂存在与否情况下自噬的表达便是一种自噬通量分析方法[17]。自噬发生过程中首先形成双层膜自噬体,自噬体中包含有细胞溶质和受损细胞器自噬体,随后自噬体和溶酶体融合形成自噬溶酶体,包裹物经溶酶体中多种蛋白酶消化和降解[18],实现细胞物质代谢和细胞器更新[19]。本研究结果表明加入溶酶体抑制剂后,各组NR8383细胞中LC3-Ⅱ蛋白表达均增强,提示自噬增强的现象是自噬本身被激活所致,并非是自噬降解途径受阻的假象。
| [1] | Park EJ, Park K. Oxidative stress and pro-flammatory responses induced by silica nanoparticles in vivo and in vitro[J]. Toxicol Lett, 2009, 184(1): 18–25. DOI:10.1016/j.toxlet.2008.10.012 |
| [2] | 吴秋云, 唐萌, 谢彦昕, 等. 不同粒径纳米二氧化硅的体外细胞膜毒性作用[J]. 中国生物医学工程学报, 2010(3): 437–445. |
| [3] | 刘婷, 孙莹, 柳明坤, 等. N-乙酰半胱氨酸对大鼠肺纤维化模型中TGF-β1表达影响的研究[J]. 中国实验诊断学, 2009, 13(11): 1508–1511. DOI:10.3969/j.issn.1007-4287.2009.11.008 |
| [4] | 周效宝, 王瑞. 细胞因子在矽肺发生发展中作用研究进展[J]. 中国公共卫生, 2011, 27(12): 1630–1632. DOI:10.11847/zgggws2011-27-12-61 |
| [5] | 王欣. CD36短发夹RNA干扰重组慢病毒抑制大鼠肺泡巨噬细胞L-TGF-β1活化及其阻抑矽肺纤维化的研究[D]. 沈阳: 中国医科大学博士学位论文, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10159-2009134932.htm |
| [6] | 张立英, 刘绍霞, 赵国强, 等. TNF-α基因siRNA真核表达载体的构建及其对A549细胞TNF-α和TGF-β1表达的影响[J]. 郑州大学学报:医学版, 2012, 47(5): 629–632. |
| [7] | 李颖. 转化生长因子-β1和肿瘤坏死因子-α在尘肺病中的表达及其意义[D]. 长沙: 中南大学硕士学位论文, 2011. http://cdmd.cnki.com.cn/article/cdmd-10533-1011180929.htm |
| [8] | Scarfì M, Magnone M, Ferraris C, et al. Ascorbic acid pre-treated quartz stimulates TNF-α release in RAW264.7 murine macrophages through ROS production andmembrane lipid peroxidation[J]. Respiratory Research, 2009, 10(25): 1–16. |
| [9] | 乔俊华. 大鼠煤工尘肺动物模型的研究[D]. 吉林: 吉林大学博士学位论文, 2006. http://cdmd.cnki.com.cn/Article/CDMD-10183-2009093502.htm |
| [10] | Nikbakht J, Hemmati AA, Arzi A, et al. Protective effect of gallic acid against bleomycin-induced pulmonary fibrosis in rats[J]. Pharmacol Rep, 2015, 67(6): 1061–1067. DOI:10.1016/j.pharep.2015.03.012 |
| [11] | 王宇琦, 蒋卓勤, 邓颖勋, 等. 自噬与非酒精性脂肪肝关系研究进展[J]. 中国公共卫生, 2015, 31(9): 1230–1233. DOI:10.11847/zgggws2015-31-09-37 |
| [12] | 顾春晖, 刘移民. 粉尘致肺纤维化机制研究现状[J]. 热带医学杂志, 2009, 9(5): 582–589. |
| [13] | 李红园, 魏丽娟, 魏占勇, 等. 细胞自噬的研究进展[J]. 畜牧与兽医, 2015(05): 143–146. |
| [14] | Teng YC, Tai YI, Huang HJ, et al. Melatonin ameliorates arsenite-induced neurotoxicity:involvement of autophagy and mitochondria[J]. Mol Neurobiol, 2015, 52(2): 1015–1022. DOI:10.1007/s12035-015-9250-y |
| [15] | Jia G, Sowers JR. Autophagy:a housekeeper in cardiorenal metabolic health and disease[J]. Biochim Biophys Acta, 2015, 1852(2): 219–224. DOI:10.1016/j.bbadis.2014.06.025 |
| [16] | Karim MR, Kanazawa T, Daigaku Y, et al. Cytosolic LC3 ratio as a sensitive index of macroautophagy in isolated rat hepatocytes and H4-Ⅱ-E cells[J]. Autophagy, 2007, 3(6): 553–560. DOI:10.4161/auto.4615 |
| [17] | Mizushima N, Yoshimori T, Levine B. Methods in mammalian autophagy research[J]. Cell, 2010, 140(3): 313–326. DOI:10.1016/j.cell.2010.01.028 |
| [18] | 马泰, 孙国平, 李家斌. 细胞自噬的研究方法[J]. 生物化学与生物物理进展, 2012, 39(03): 204–209. |
| [19] | 秦永刚, 李晨旭, 李雷, 等. 自噬在镉致大鼠肾脏损伤中的作用[J]. 吉林大学学报:医学版, 2015, 41(2): 213–217. |
 2017, Vol. 33
2017, Vol. 33