胃癌致死率居癌症相关死亡率的第三位[1]。大多数胃癌患者在确诊时已属晚期,3年生存率低于40%[2]。信号转导通路的异常改变与肿瘤的发生、发展密切相关,基于信号通路的临床抗癌抑制剂的研究一直是热点。磷酯酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)是由调节亚基p85和催化亚基p110组成的异二聚体,广泛存在于细胞中,在细胞增殖、分化、凋亡、药物抵抗和葡萄糖转运等方面发挥重要作用[3]。Akt是PI3K下游的主要效应分子之一。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)是一种相对保守的丝氨酸-苏氨酸蛋白激酶,控制细胞的生长代谢、蛋白质合成以及血管生成等[4]。PI3K/AKT/mTOR信号通路在肺癌[5]、血液系统肿瘤[6]等肿瘤中存在异常表达,同时该信号通路关键基因表达水平可以作为某些肿瘤如肌肉瘤和胶质瘤恶性程度评判标准[7]。为进一步了解PI3K/AKT/mTOR信号通路在胃癌中的表达与调节机制,本研究应用rapamycin作用于胃癌细胞株MGC-803,观察抑制剂对细胞的影响,探讨PI3K/AKT/mTOR信号通路调控胃癌细胞生长的可能分子机制,为该通路抑制剂应用于临床提供更多的实验依据。
1 材料与方法 1.1 主要材料与仪器人低分化胃癌细胞株MGC-803(南京凯基生物公司),Rapamycin(美国Selleck公司),逆转录试剂盒(日本Takara公司),引物(中国南京金斯瑞公司),蛋白印迹(Western blot,WB)试剂盒(中国南京生兴公司),抗体(美国CST公司),FITC/PI细胞凋亡检测试剂盒、细胞周期检测试剂盒(中国南京凯基生物公司)。QuantStudio 7实时荧光定量PCR仪器(美国ABI公司),SDS-PAGE电泳仪器及湿转仪器(美国Bio-Rad公司),流式细胞仪(美国BD公司),Multiskan MK3型酶标仪(美国Thermo公司)。
1.2 方法 1.2.1 细胞培养胃癌细胞株MGC-803贴壁培养于RPMI 1640全培养液(10%胎牛血清,青霉素100 U/mL,链霉素100 μg/mL)中,置于5%CO2、37 ℃恒温培养箱内培养,当细胞生长至近融合状态时,用含0.25%乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)的胰酶消化传代,取对数生长期的细胞进行后续实验。
1.2.2 MTT检测MGC-803细胞长至对数生长期时,使用0.25%胰酶将细胞消化后制成单细胞悬液,并调整细胞密度至5 000个/孔,以100 μL/孔的悬液量接种于96孔板,实验孔周围每孔加入100 μL磷酸盐缓冲液(phosphatic buffer saline,PBS),将96孔板置于5% CO2、37 ℃条件的恒温培养箱内培养。待细胞贴壁后,实验组分别加入不同浓度rapamycin抑制剂(浓度为12.5、25、50、100、150和200 nmol/L),同时设对照组(只加细胞和培养基,不加药物)和空白组(只加培养基不加细胞),每组设置6个副孔。培养24 h后吸去培养基,每孔加入10 μL浓度为5 mg/mL的MTT,继续培养4 h。弃上清后,每孔再加入150 μL二甲基亚砜(dimethyl sulfoxide,DMSO)振荡混匀,使用酶标仪测定波长490 nm处吸光度值,计算细胞增殖率。细胞增殖率(%)=[实验组A值-空白组A值]/[对照组A值-空白组A值]×100%
1.2.3 分组处理根据MTT结果筛选出雷帕霉素的处理剂量,分别为12.5、25和50 nmol/L。取对数生长期的细胞种于6孔板中,每孔种细胞数约1×105个。细胞贴壁后用PBS洗3次,加入无血清培养基饥饿处理24 h。用培养基配制rapamycin至终浓度为0、12.5、25和50 nmol/L。待饥饿处理结束后开始加药。
1.2.4 实时荧光定量PCR(表 1)| 表 1 实时荧光定量PCR引物序列 |
实验组和对照组细胞加药培养24 h后,用细胞刮刮下贴壁的细胞,移至1.5 mL EP管中,1 000 r/min离心5 min,去上清留沉淀,加入550 μL Trizol,冰上裂解5 min,加入120 μL氯仿颠倒混匀后冰上静置5 min,4 ℃ 12 000 r/min离心10 min,取上清至EP管中,加入与上清等量的异丙醇,颠倒混匀后于室温下静置10 min,4 ℃ 12 000 r/min离心10 min,去上清,加入75%乙醇400 μL洗涤,4 ℃ 12 000 r/min离心10 min,去上清留沉淀,在通风橱中静置20 min后,用20~30 μL无RNA酶水溶解混匀,利用ND-1000分光光度计检测RNA浓度和A260/A280比值,范围在1.8~2.0之间为高纯度RNA。使用Takara试剂盒对提取的mRNA进行逆转录。登录NCBI网站查找人类基因序列,登录IDT引物设计网站设计引物,设计人类PI3K、AKT、mTOR、p70S6K、4EBP、ACTIN基因引物各两对,对设计的正反向引物分别进行blast判断互补性,所有引物均使用PAGE纯化方式。将逆转录好的cDNA加30 μL用焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)处理的纯水稀释混匀,每个样品做3个副孔,95 ℃ 60 s预变性,40个循环(95 ℃ 30 s,60 ℃ 30 s),进行PCR扩增。采用QuantStudioTM Real-Time PCR软件进行数据采集分析,确认样品扩增曲线和溶解曲线完整性和特异性,基因的相对表达量采用2-ΔΔCt方法来分析,(ΔCt=Ct目的基因-CtActin;ΔΔCt=ΔCt实验组-ΔCt对照组),ΔCt值比较采用单因素方差分析,α=0.05。
1.2.5 WB检测实验组和对照组细胞加药培养24 h后,用细胞刮刮下贴壁的细胞,连同培养基移至2 mL离心管中,1 000 r/min离心5 min,去上清留沉淀,加入预冷的PBS,吹打混匀,1 000 r/min离心5 min,反复2次,去上清留沉淀,加入含蛋白酶抑制剂和磷酸酶抑制剂的裂解液120 μL,冰上裂解20 min后,4 ℃下12 000 r/min离心10 min,取上清至1.5 mL EP管。使用碧云天BCA试剂盒测定蛋白浓度。制备SDS-PAGE胶,蛋白样品变性、电泳、转膜至聚偏二氟乙烯(polyvinylidene fluoride, PVDF)膜上,5%脱脂牛奶封闭2 h,加入1:1 000稀释的一抗在4 ℃下孵育过夜,1:5 000稀释的二抗室温下孵育1 h,ECL显影,化学发光成像系统捕捉并保存。
1.2.6 细胞周期测定使用细胞周期检测试剂盒在流式细胞仪上进行细胞周期检测:实验组和对照组细胞加药培养24 h后吸去培养基,PBS洗涤1次,培养基和PBS中的悬浮细胞均离心收集。2 000 r/min离心5 min,弃上清,在细胞中加入体积分数为70%冷乙醇500 μL固定,4 ℃过夜。离心弃上清,PBS洗去固定液后,加入100 μL RNAse溶液吹打混匀,37 ℃水浴30 min,加入400 μL PI染色,混匀,避光反应30 min,200目筛网过滤,上流式细胞仪检测。
1.2.7 细胞凋亡测定使用annexin V-FITC/PI细胞凋亡检测试剂盒在流式细胞仪上进行细胞凋亡检测:实验组和对照组细胞加药培养24 h后吸去培养基,PBS洗涤2次,培养基和PBS中的悬浮细胞均离心收集。2 000 r/min离心5 min,弃上清,加入300 μL binding buffer溶液重悬细胞。加入5 μL annexin V-FITC混匀后加入5 μL PI,混匀后室温避光反应10 min。加入200 μL binding buffer溶液,轻轻吹打混匀,1 h内进行流式细胞仪检测。
1.3 统计分析采用SPSS 17.0和Excel 2007进行数据统计分析,不同剂量组间采用单因素方差分析,α=0.05。
2 结果 2.1 细胞增殖(图 1、表 2)
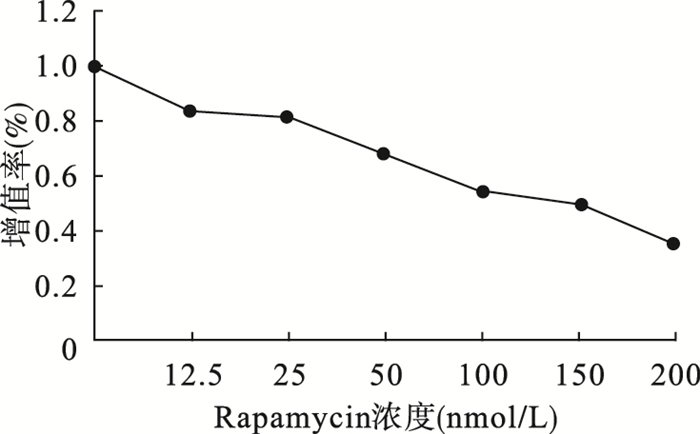
|
图 1 Rapamycin对胃癌MGC-803 |
| 表 2 Rapamycin处理后胃癌MGC-803细胞的增殖率变化 |
MTT测定结果显示,与对照组相比,不同浓度rapamycin对MGC-803细胞均有抑制作用,且随着rapamycin浓度的增加,MGC-803细胞增殖能力逐渐下降,抑制作用呈现剂量依赖性(F=13.54,P < 0.05)。
2.2 mRNA水平的表达(表 3)| 表 3 题Rapamycin处理后胃癌MGC-803细胞的mRNA表达 |
Rapamycin作用24 h后,实验组的PI3K、AKT、mTOR、4EBP、P70S6K基因的mRNA表达与对照组相比,随着rapamycin浓度升高,其表达量均逐渐降低,差异有统计学意义(P < 0.05)。
2.3 蛋白水平表达(图 2)
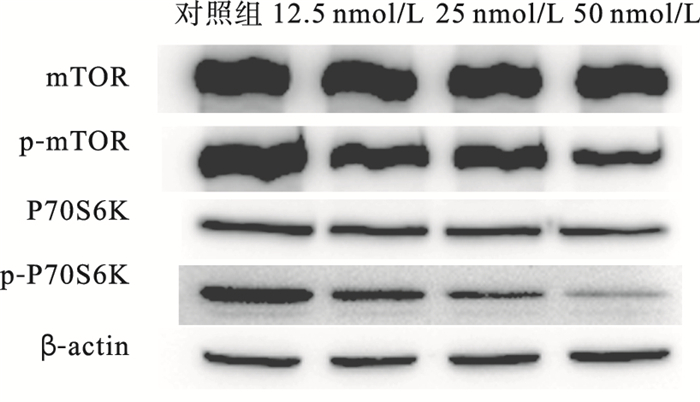
|
图 2 Rapamycin对胃癌MGC-803细胞蛋白表达的影响 |
与对照组相比,rapamycin作用24 h后各组总蛋白mTOR(Ser2448)、P70S6K表达无明显差异,磷酸化蛋白p-P70S6K(Thr389)、p-mTOR(Ser2448) 随着抑制剂浓度的增加蛋白表达量逐渐降低。
2.4 细胞周期(表 4)| 表 4 Rapamycin处理后胃癌MGC-803细胞的周期变化 |
流式细胞术检测实验组和对照组细胞周期分布结果显示,与对照组0 nmol/L相比,12.5、25和50 nmol/L浓度rapamycin作用24 h后,G0/G1期细胞比例逐渐上升,分别占52.19%、55.42%和57.82%,高于对照组的44.46%,差异有统计学意义(P < 0.05);S期细胞比例分别为14.35%、14.43%和12.83%,均低于对照组的17.57%;G2/M期细胞比例逐渐下降,分别占33.46%、30.15%和29.35%,均低于对照组的37.97%。提示rapamycin使胃癌MGC-803细胞周期发生G0/G1期阻滞,且处于DNA合成期及合成后期的细胞减少。
2.5 细胞凋亡(表 5)| 表 5 Rapamycin处理后胃癌MGC-803细胞的凋亡率变化 |
流式细胞术检测实验组和对照组细胞凋亡率变化,12.5、25和50 nmol/L浓度组凋亡率分别为(10.43±0.25)%、(13.77±0.38)%和(20.73±0.92)%,与对照组(9.37±0.59)%相比,凋亡率随着浓度的增加而增加,呈现剂量依赖性。
3 讨论PI3K/Akt/mTOR信号通路是细胞内重要的信号转导通路之一,已在多种癌症中证明有促癌作用,主要表现在调控通路基因的转录水平[8]、细胞增殖[9]、细胞凋亡[10]、糖原和蛋白质代谢[11]、脱氧核糖核酸修复[12]、细胞生存能力[13]、以及参与肿瘤的侵袭和转移[14]。PI3K可分为Ⅰ、Ⅱ、Ⅲ型,Ⅰ型PI3K又可进一步分为2个亚型:ⅠA(PI3Kα、β、γ)和ⅠB(PI3Kδ),ⅠA可被酪氨酸蛋白激酶受体激活,ⅠB可被G蛋白偶联受体激活[15-16],活化后的PI3K可以使细胞膜上的磷脂酰肌醇二磷酸PI(4, 5) P2磷酸化为磷脂酰肌醇三磷酸PI(3, 4, 5) P3[17]。PI(3, 4, 5) P3与Akt的PH结构域结合,在PDK1和PDK2的参与下使Ser473和Thr308位点磷酸化而完全激活Akt。mTOR以mTOR复合物1(mTORC1) 和mTOR复合物2(mTORC2) 形式存在[18]。目前已有研究表明,mTORC1是一种生长因子调节剂,可调控细胞内蛋白质的合成及细胞周期进程[19],而mTORC2则可能和细胞骨架构建有关[20]。mTOR调控其下游的2个基因真核细胞始动因子4E结合蛋白1(4EBP)和核糖体激酶p70S6K[21-22]。4EBP和P70S6K控制着编码细胞周期G1期和S期必需蛋白的mRNA翻译。Rapamycin是一种大环类脂类药物,于20世纪70年代中期被发现,是最早被发现的mTOR抑制剂。在二十世纪初雷帕霉素已被美国和欧盟批准作为免疫抑制剂应用于临床[23]。雷帕霉素及其类似物进入细胞后能和胞内受体FK506结合蛋白12形成复合物,该复合物可与mTOR的FRB结构域结合,能特异性抑制mTOR活性[24]。
本研究采用体外给予rapamycin干预胃癌MGC-803细胞的方法。MTT结果显示,与对照组相比,不同浓度rapamycin对MGC-803细胞均有抑制作用,且随着rapamycin浓度的增加,MGC-803细胞增殖能力逐渐下降,抑制作用呈现剂量依赖性。为了进一步阐明rapamycin抑制胃癌细胞增殖的分子机制,采用流式细胞术分析了rapamycin对细胞周期的影响,发现胃癌细胞经rapamycin处理后,细胞阻滞于G0/G1期阻滞,且处于DNA合成期及合成后期的细胞减少。提示rapamycin在MGC-803细胞分化周期中,抑制该信号通路使细胞停止于G0/G1期,阻滞胃癌细胞进程从而发挥其抑制胃癌细胞生长的作用。同时凋亡检测表明rapamycin对MGC-803细胞有促凋亡作用,呈现剂量依赖性。实时荧光定量PCR结果显示,rapamycin作用24 h后,实验组的PI3K、AKT、mTOR、4EBP、P70S6K基因的mRNA表达与对照组相比,随着rapamycin浓度升高,其表达量均逐渐降低,差异有统计学意义(P < 0.05)。同时WB结果显示,与对照组相比,总蛋白mTOR(Ser2448)、P70S6K表达无显著性差异的情况下,磷酸化蛋白p-P70S6K(Thr389)、p-mTOR(Ser2448) 随着抑制剂浓度的增加蛋白表达量逐渐降低。以上结果表明,mTOR抑制剂rapamycin对信号通路关键基因的转录和翻译过程有抑制作用,从而抑制了胃癌MGC-803细胞的生长,且抑制作用具有剂量依赖性,与相关研究报道一致[25-26]。Cao等[27]研究表明,单独使用rapamycin处理MGC-803、SGC-7901细胞株8 h内p-AKT存在表达升高的现象,而在24 h后p-AKT、p-mTOR表达量逐渐下降,而对p-P70S6K蛋白表达一直存在抑制作用。Noh等[28]发现rapamycin对12株乳腺癌细胞有抑制作用,p-P70S6K显著下调与本研究结果一致。Hiroaki等[29]发现p-AKT和p-P70S6K可以作为一种生物标志物,其高表达可使用rapamycin处理大肠癌细胞,可抑制细胞增殖。
综上所述,PI3K/AKT/mTOR作为细胞生存的重要信号通路,在胃癌细胞的生长过程中发挥重要作用。本研究应用rapamycin作用于低分化胃癌细胞株MGC-803,通过检测分子指标和功能学指标,观察抑制剂对胃癌细胞增殖活性、转录过程、翻译水平、周期分布、凋亡率等多个方面的影响,结果初步揭示了PI3K/AKT/mTOR信号通路与胃癌化疗效果的相关性,为基于PI3K/AKT/mTOR信号通路作用机制的抗胃癌新药物的开发提供理论依据。本研究获得的所有实验数据均在离体情况下以细胞培养方式获得,由于人体内环境中多种因素的影响,rapamycin对肿瘤细胞的抑制作用机制还值得进一步研究。
| [1] | Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide:sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359–E386. DOI:10.1002/ijc.29210 |
| [2] | Mullen JT, Ryan DP. Neoadjuvant chemotherapy for gastric cancer:what are we trying to accomplish?[J]. Ann Surg Oncol, 2014, 21(1): 13–15. DOI:10.1245/s10434-013-3250-9 |
| [3] | Sui T, Ma L, Bai X, et al. Resveratrol inhibits the phosphatidylinositol 3-kinase/protein kinase B/mammalian target of rapamycin signaling pathway in the human chronic myeloid leukemia K562 cell line[J]. Oncol Lett, 2014, 7(3): 2093–2098. |
| [4] | Sun DF, Zhang YJ, Tian XQ, et al. Inhibition of mTOR signalling potentiates the effects of trichostatin A in human gastric cancer cell lines by promoting histone acetylation[J]. Cell Biol Int, 2014, 38(1): 50–63. DOI:10.1002/cbin.10179 |
| [5] | Beck JT, Ismail A, Tolomeo C. Targeting the phosphatidylinositol 3-kinase(PI3K)/AKT/mammalian target of rapamycin(mTOR)pathway:an emerging treatment strategy for squamous cell lung carcinoma[J]. Cancer Treatment Reviews, 2014, 40(8): 980–989. DOI:10.1016/j.ctrv.2014.06.006 |
| [6] | Jabbour E, Ottmann OG, Deininger M, et al. Targeting the phosphoinositide 3-kinase pathway in hematologic malignancies[J]. Haematologica, 2014, 99(1): 7–18. DOI:10.3324/haematol.2013.087171 |
| [7] | Atif F, Yousuf S, Stein DG. Anti-tumor effects of progesterone in human glioblastoma multiforme:role of PI3K/Akt/mTOR signaling[J]. The Journal of Steroid Biochemistry and Molecular Biology, 2015, 146: 62–73. DOI:10.1016/j.jsbmb.2014.04.007 |
| [8] | Samarin J, Laketa V, Malz M, et al. PI3K/AKT/mTOR-dependent stabilization of oncogenic far-upstream element binding proteins in hepatocellular carcinoma cells[J]. Hepatology, 2016, 63(3): 813–826. DOI:10.1002/hep.28357 |
| [9] | Wang J, Luo H, Xiao Y, et al. miR-125b inhibits keratinocyte proliferation and promotes keratinocyte apoptosis in oral lichen planus by targeting MMP-2 expression through PI3K/Akt/mTOR pathway[J]. Biomed Pharmacother, 2016, 80: 373–380. DOI:10.1016/j.biopha.2016.02.043 |
| [10] | Liu Y, Bi T, Dai W, et al. Lupeol induces apoptosis and cell cycle arrest of human osteosarcoma cells through PI3K/AKT/mTOR pathway[J]. Technol Cancer Res Treat, 2015, 15(6): NP16–NP24. |
| [11] | Khan KH, Wong M, Rihawi K, et al. Hyperglycemia and phosphatidylinositol 3-kinase/protein kinase B/mammalian target of rapamycin(PI3K/AKT/mTOR)inhibitors in phase I trials:incidence, predictive factors and management[J]. Oncologist, 2016, 21(7): 855–860. DOI:10.1634/theoncologist.2015-0248 |
| [12] | Zhang J, Jiang W, Liu W, et al. Effective targeting of colorectal cancer cells using TORC1/2 kinase inhibitors in vitro and in vivo[J]. Future Oncol, 2016, 12(4): 515–524. DOI:10.2217/fon.15.248 |
| [13] | Wang X, Han L, Zhang J, et al. Down-regulated NRSN2 promotes cell proliferation and survival through PI3K/Akt/mTOR pathway in hepatocellular carcinoma[J]. Dig Dis Sci, 2015, 60(10): 3011–3018. DOI:10.1007/s10620-015-3736-3 |
| [14] | Wu S, Sun C, Tian D, et al. Expression and clinical significances of Beclin1, LC3 and m TOR in colorectal cancer[J]. Int J Clin Exp Pathol, 2015, 8(4): 3882–3891. |
| [15] | Porta C, Paglino C, Mosca A, et al. Targeting PI3K/AKT/mTOR signaling in cancer[J]. Front Oncol, 2014, 4: 64. |
| [16] | Vadas O, Dbouk HA, Shymanets A, et al. Molecular determinants of PI3K γ-mediated activation downstream of G-protein-coupled receptors(GPCRs)[J]. Proc Natl Acad Sci USA, 2013, 110(47): 18862–18867. DOI:10.1073/pnas.1304801110 |
| [17] | Carvallho S, Schmitt F. Potential role of PI3K inhibitors in the treatment of breast cancer[J]. Future Oncol, 2010, 6(8): 1251–1263. DOI:10.2217/fon.10.97 |
| [18] | Yang Q, Inoki K, Kim E, et al. TSC1/TSC2 and Rheb have different effects on TORC1 and TORC2 activity[J]. Proc Natl Acad Sci USA, 2006, 103(18): 6811–6816. DOI:10.1073/pnas.0602282103 |
| [19] | Sancak Y, Bar-Peled L, Zoncu R, et al. Ragulator-Rag complex targets mTORC1 to the lysosomal surface and is necessary for its activation by amino acids[J]. Cell, 2010, 141(2): 290–303. DOI:10.1016/j.cell.2010.02.024 |
| [20] | Zinzalla V, Stracka D, Oppliger W, et al. Activation of mTORC2 by association with the ribosome[J]. Cell, 2011, 144(5): 757–768. DOI:10.1016/j.cell.2011.02.014 |
| [21] | Lee JE, Lim MS, Park JH, et al. S6K promotes dopaminergic neuronal differentiation through PI3K/Akt/mTOR-dependent signaling pathways in human neural stem cells[J]. Mol Neurobiol, 2016, 56(3): 3771–3782. |
| [22] | Martin D, Nguyen Q, Molinolo A, et al. Accumulation of dephosphorylated 4EBP after mTOR inhibition with rapamycin is sufficient to disrupt paracrine transformation by the KSHV vGPCR oncogene[J]. Oncogene, 2014, 33(18): 2405–2412. DOI:10.1038/onc.2013.193 |
| [23] | Segarra I, Brazelton TR, Guterman N, et al. Development of a high-performance liquid chromatographic-electrospray mass spectrometric assay for the specific and sensitive quantification of the novel immunosuppressive macrolide 40-O-(2-hydroxyethyl)rapamycin[J]. J Chromatogr B Biomed Sci Appl, 1998, 720(1-2): 179–187. DOI:10.1016/S0378-4347(98)00426-5 |
| [24] | Yang H, Rudge DG, Koos JD, et al. mTOR kinase structure, mechanism and regulation[J]. Nature, 2013, 497(7448): 217–223. DOI:10.1038/nature12122 |
| [25] | Lee JH, Kang KW, Lee HW. Expression of phosphorylated mTOR and its clinical significances in small cell lung cancer[J]. Int J Clin Exp Pathol, 2015, 8(3): 2987–2993. |
| [26] | Malaguti P, Vari S, Cognetti F, et al. The Mammalian target of rapamycin inhibitors in breast cancer:current evidence and future directions[J]. Anticancer Res, 2013, 33(1): 21–28. |
| [27] | Cao Y, Qu J, Li C, et al. Celecoxib sensitizes gastric cancer to rapamycin via inhibition of the Cbl-b-regulated PI3K/Akt pathway[J]. Tumour Biol, 2015, 36(7): 5607–5615. DOI:10.1007/s13277-015-3232-6 |
| [28] | Noh WC, Mondesire WH, Peng J, et al. Determinants of rapamycin sensitivity in breast cancer cells[J]. Clin Cancer Res, 2004, 10(3): 1013–1023. DOI:10.1158/1078-0432.CCR-03-0043 |
| [29] | Nozawa H, Watanabe T, Nagawa H. Phosphorylation of ribosomal p70S6 kinase and rapamycin sensitivity in human colorectal cancer[J]. Cancer Lett, 2007, 251(1): 105–113. DOI:10.1016/j.canlet.2006.11.008 |
 2017, Vol. 33
2017, Vol. 33


