镉是一种存在于自然环境中的重金属元素。工业上镉主要用于电镀,生产镍镉电池,颜料塑料稳定剂,以及作为铜锌冶炼的副产物[1]。镉在环境中不能被降解,易在土壤中蓄积,进而通过食物链的富集作用加重镉污染[2]。镉是国际肿瘤研究机构(The International Agency for Research on Cancer,IARC)确定的人类致癌物,可引发肺癌,膀胱癌等[3]。急性镉暴露可引起呼吸道刺激症状及肺水肿[4],慢性镉暴露可导致肝、肾、骨等器官损伤,高血压,心血管等疾病[5-7]。目前,镉对人体细胞及组织造成急慢性损伤的机制尚不明确,其中氧化应激被认为是镉毒性作用的主要机制之一[4, 8]。体内外实验均表明镉会引起活性氧自由基(reactive oxygen species,ROS)水平升高。尤其在急性实验中,镉暴露后ROS如超氧阴离子、过氧化氢等产生增多,从而导致细胞内DNA损伤,脂质过氧化等一系列反应[9]。为应对细胞内ROS产生增多造成的氧化损伤,机体会启动适应性防御机制,其中一些对氧化还原稳态敏感的转录因子起到了关键调控作用[4, 10-11]。核转录因子E2-相关因子2(nuclear factor E2-related factor,NRF2) 是一种广泛存在的具有碱性亮氨酸拉链(basic leucine zipper,bZIP)结构的转录因子,是CNC家族的一员,通过调控激活下游抗氧化酶和二相解毒酶等,从而维持细胞氧化-还原稳态和抑制氧化损伤,近年来引起研究者广泛关注[12]。虽然提高NRF2-抗氧化反应元件(antioxiant response element, ARE)活性具有抗氧化并增强细胞解毒能力作用,但越来越多的研究表明NRF2的持续和过度活化与多种癌症的发生、发展和耐药密切相关[13-17]。因此,NRF2负面作用也逐渐引起大家的关注。有研究证实,NRF2在镉慢性致癌机制中可能起到重要作用[18]。本研究采用人肝癌HepG2细胞,给予不同时间不同剂量的镉处理,观察NRF2通路的变化,旨在为镉致癌作用机制探讨提供依据。
1 材料与方法 1.1 主要仪器与试剂Tanon 5500 Multi全自动化学发光图像分析仪(上海天能科技有限公司),FlexStation 3酶标仪(美国MolcularDevices公司),Nanodrop 2000(美国Thermo公司),ABI Q6 Sequence Detector(美国Applied Biosystem公司)。人肝癌HepG2细胞系[美国典型菌种保藏中心(American Type Culture Collection,ATCC),编号:HB-8065],CdCl2(分析纯)、最小必需培养基(minimum essential media, MEM)培养液、非必需氨基酸、丙酮酸钠、胎牛血清、胰蛋白酶、青链霉素、Trizol(美国Invitrogen公司),NRF2、β-actin抗体(美国Santa Cruz公司),山羊抗兔IgG-HRP(美国Cell Signaling Technology公司),high capacity cDNA reverse transcription试剂盒(美国Applied Biosystem公司),SYBR Green PCR试剂盒(美国Promega公司),非放射性细胞增殖检测试剂盒(美国Promega公司)。CdCl2染毒溶液配制:精密称取适量CdCl2溶于磷酸缓冲盐溶液(phosphate buffer saline,PBS)中,过0.22 μm微孔滤膜除菌后配制成10 mmol/L的储备液,染毒时,分别稀释为所需浓度应用液。
1.2 细胞培养与处理人肝癌HepG2细胞在含有10%胎牛血清、1%非必需氨基酸、1%丙酮酸钠、100 U/mL青霉素和100 μg/mL链霉素的MEM培养液中培养,在37 ℃ 5% CO2条件下进行;待细胞长到80%~90%融合时,按照1:6比例传代;染毒时,细胞以2.5×105个/mL密度接种至培养板或培养皿,待细胞生长至80%融合后,进行细胞染毒和相关实验。
1.3 细胞活力测定每孔1×105个细胞在96孔板中贴壁培养过夜,同时设无细胞空白对照组;随后弃培养基,加入含有不同浓度镉(0、1、2.5、5、10、25、50、100、200 μmol/L)的培养液处理24 h后,用非放射性细胞增殖试剂盒检测;应用Flexstation 3酶标仪在490 nm处测各孔吸光度(A)值,即检测烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)依赖的四氮唑盐反应产生的甲臜量;细胞活力用其还原率表示。
1.4 NRF2通路因子mRNA表达检测细胞接种于3.5 cm培养皿,不同剂量镉(0、1、2、5、10、20 μmol/L)处理6 h及10 μmol/L镉处理不同时间(2、4、6、12、24 h)后,采用实时定量RT-PCR法检测GCLC、GCLM、HO1和AKR1C1 mRNA水平变化,应用Trizol法提取总RNA,经无RNA酶水稀释后用Nanodrop在260 nm测浓度,至检测前样品储存在-80 ℃;按照逆转录试剂盒说明书合成cDNA,进行实时荧光定量反应。引物设计应用Primer Express 4(Life Tchnologies)软件完成,引物由Bioneer公司合成。GAPDH引物上游:5′-CCT CCC GCT TCG CTC TCT-3′,下游5′-CTG GCG ACG CAA AAG AAG AGC LC-3′,长度64 bp,GCLC引物上游:5′-GAT GCT GTC TTG CAG GGA ATG-3′,下游5′-AGC GAG CTC CGT GCT GTT-3′,长度105 bp,GCLM引物上游:5′-ACA GGT AAA ACC AAA TAG TAA CCA AGT TAA-3′,下游5′-TGT TTA GCA AAT GCA GTC AAA TCT G-3′,长度81 bp,HO1引物上游:5′-GCC TGG AAG ACA CCC TAA TGT G-3′,下游5′-GGC CGT GTC AAC AAG GAT ACT T-3′,长度79 bp,AKR1C1引物上游:5′-TGG GAG GCC GTG GAG AA-3′,下游5′-GGA CAC CCC GAT GGA CTT G-3′,长度57 bp,荧光染料SYBR Green PCR试剂盒被用于实时定量PCR分析,实时荧光检测使用ABI Q6 Sequence Detector。
1.5 NRF2因子表达检测采用Western blot法,细胞接种于6 cm培养皿,不同剂量镉(0、1、2、5、10、20 μmol/L)处理6 h后,弃培养液,应用预冷的PBS洗2次,加入100 μL含有蛋白酶抑制剂和磷酸酶抑制剂的细胞裂解液,收集细胞,4 ℃,12 000 g离心10 min,收集上清测定蛋白浓度后,调整蛋白浓度,95 ℃变性10 min;蛋白质样品通过聚丙烯酰胺凝胶电泳(sodium dodecyl-polyacryl gradient gel electrophoresis, SDS-PAGE)分离目的蛋白(100 V,1.5 h)后,转印至硝酸纤维素膜上(25 V,2 h),将转印后的硝酸纤维素膜在3%牛血清蛋白中封闭1 h,加入NRF2一抗(1:1 000)4 ℃孵育过夜,一抗杂交后Tris-HCl缓冲液与吐温20混合液(Tris buffered saline, with Tween-20, pH 8.0,TBST)洗3次,辣根过氧化物酶偶联的二抗(1:3 000) 室温孵育1 h,TBST洗3次,加入增强化学发光底物,应用成像系统采集发光条带;应用Image J软件分析计算NRF2灰度值与β-actin蛋白灰度值的比值,作为目的蛋白的相对表达量。
1.6 统计分析采用Graph Pad Prism 4软件对数据进行统计分析,数据以x±s表示,采用单因素方差分析比较各组间差异,进一步两两比较采用Bonferroni检验;以P<0.05为差异有统计学意义。
2 结果 2.1 镉暴露对HepG2细胞活力影响对照组HepG2细胞活力为(100±5.19)%,1、2.5、5、10、25、50、100、200 μmol/L镉处理组细胞活力分别为(107.88±3.92)%、(100.58±3.10)%、(99.94±3.20)%、(85.12±1.68)%、(72.43±1.89)%、(55.27±0.87)%、(33.79±3.95)%和(20.51±3.12)%;随镉处理浓度增加,细胞活力逐渐降低,镉剂量大于10 μmol/L时,细胞活力明显低于对照组,差异有统计学意义(P<0.05)。
2.2 镉处理对HepG2细胞中NRF2蛋白表达水平影响(图 1)
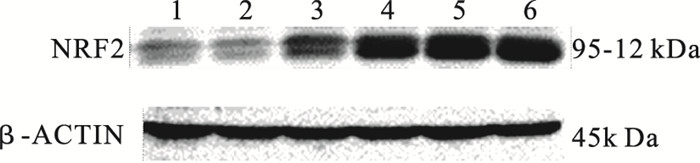
|
注:1:对照组;2~6:1、2、5、10、20 μmol/L染镉组。 图 1 镉处理对HepG2细胞NRF2蛋白表达影响 |
对照组、1、2、5、10、20 μmol/L CdCl2处理组HepG2细胞中NRF2蛋白表达水平分别为(0.60±0.01)、(0.65±0.01)、(1.37±0.04)、(1.94±0.05)、(2.24±0.07) 和(2.22±0.05);与对照组比较,镉处理组HepG2细胞中NRF2蛋白表达水平明显升高,差异有统计学意义(P<0.05)。
2.3 镉处理不同时间对HepG2细胞NRF2通路下游基因mRNA表达影响(表 1)| 表 1 镉处理不同时间对HepG2细胞NRF2下游基因mRNA表达影响(x±s,n=3) |
细胞NRF2通路下游基因mRNA表达影响(表1) 与对照组比较,各剂量镉处理组HepG2 细胞中NRF2通路下游基因GCLC、GCLM、HO1和AKR1C1 mRNA表达水平明显升高,差异有统计学意义(P<0.05),且均在镉处理6 h时表达量出现峰值。
2.4 不同剂量镉处理对HepG2细胞NPF2下游基因mRNA表达影响(表 2)| 表 2 不同剂量镉对HepG2细胞NRF2下游基因mRNA表达影响(x±s,n=3) |
与对照组比较,各剂量镉处理组HepG2细胞中NRF2通路下游基因GCLC、GCLM、HO1和AKR1C1 mRNA水平均明显升高,差异有统计学意义(P<0.05)。
3 讨论镉污染是当今社会的一个重要环境问题,人类可经呼吸、饮食、饮水等多种途径接触镉金属,急慢性镉暴露会引起人肝肾等器官损伤及癌症[2]。目前镉毒性作用及致癌机制尚不明确。NRF2作为核转录因子在机体适应性抗氧化反应过程中起到关键作用,近年来引起研究者们的广泛关注。目前,数以百计的受NRF2调控的具有细胞保护功能和解毒功能的基因已被发现,如抗氧化酶:HO1、超氧化物歧化酶(superoxide dismutase, SOD);Ⅱ相解毒酶:醌氧化还原酶[NAD(P)H-quinone oxidoreductase 1, NQO1]、谷胱甘肽硫转移酶(glutathione S-transferase, GSTs);多药耐药蛋白(multidrug-resistance-associated proteins, MRP)家族的MRP1和MRP2等[19]。AKR1C1属于人类醛-酮还原酶家族的一员,在维持类固醇激素平衡中具有关键作用。另外醛-酮还原酶还能催化还原氧化应激产生的活性醛和酮,起到解毒作用[20]。NRF2-ARE信号通路是细胞对抗氧化损伤和解毒的最重要防御机制,但NRF2的负面机制也越来越引起人们关注。如果NRF2持续被激活,则会促进癌症发生;相关机制包括NRF2/Keap1信号通路中的基因突变或者表观遗传学修饰,与其他致癌通路的交互作用,NRF2与Keap1之间的结构被干扰等[21]。除上调NRF2下游的细胞保护基因,NRF2的持续激活还会促进细胞增殖,产生化疗耐药性,抑制细胞凋亡,从而为癌细胞的生存提供有利条件[22]。
大量体外研究表明,镉能引起小鼠肝癌Hepa1c1c7细胞、人胚胎肾细胞HEK293、人星形胶质瘤1321N1细胞等NRF2及其调控的下游基因转录水平升高[6, 23-24]。在体内实验中,镉暴露也可引起NRF2通路活化[6, 25-26]。然而,有研究发现NRF2在镉慢性致癌中具有重要作用,慢性镉暴露会导致人肺支气管上皮细胞BEAS-2B发生恶性转化,其中恶性转化的细胞NRF2表达水平更高,而且在NRF2基因沉默的镉恶性转化细胞中,细胞克隆生长明显抑制,推测NRF2在镉致癌机制中可能起到重要作用[18]。本研究结果显示,在HepG2细胞中,镉能激活NRF2下游基因GCLC、GCLM、HO1和AKR1C1的转录水平及NRF2蛋白水平。与已有研究中镉通过激活NRF2通路使AKR1C3表达水平升高结论一致[27]。提示,长期低剂量镉暴露可持续激活NRF2通路,可能是镉毒性作用及癌症的发生发展机制之一。
| [1] | Nzengue Y, Candeias SM, Sauvaigo S, et al. The toxicity redox mechanisms of cadmium alone or together with copper and zinc homeostasis alteration:its redox biomarkers[J]. Journal of Trace Elements in Medicine and Biology:Organ of the Society for Minerals and Trace Elements (GMS), 2011, 25(3): 171–180. DOI:10.1016/j.jtemb.2011.06.002 |
| [2] | Cuypers A, Plusquin M, Remans T, et al. Cadmium stress:an oxidative challenge[J]. Biometals:an International Journal on the Role of Metal Ions in Biology, Biochemistry, and Medicine, 2010, 23(5): 927–940. DOI:10.1007/s10534-010-9329-x |
| [3] | Waalkes MP. Cadmium carcinogenesis[J]. Mutation Research, 2003, 533(1-2): 107–120. DOI:10.1016/j.mrfmmm.2003.07.011 |
| [4] | Liu J, Qu W, Kadiiska MB. Role of oxidative stress in cadmium toxicity and carcinogenesis[J]. Toxicology and Applied Pharmacology, 2009, 238(3): 209–214. DOI:10.1016/j.taap.2009.01.029 |
| [5] | Jarup L, Akesson A. Current status of cadmium as an environmental health problem[J]. Toxicology and Applied Pharmacology, 2009, 238(3): 201–208. DOI:10.1016/j.taap.2009.04.020 |
| [6] | He X, Chen MG, Ma Q. Activation of Nrf2 in defense against cadmium-induced oxidative stress[J]. Chemical Research in Toxicology, 2008, 21(7): 1375–1383. DOI:10.1021/tx800019a |
| [7] | 杨敬华, 徐兆发, 徐斌, 等. 镉致大鼠肾脏毒性机制研究[J]. 中国公共卫生, 2007, 23(7): 887–888. DOI:10.11847/zgggws2007-23-07-62 |
| [8] | 田婷, 毛伟平, 张超, 等. 镉致HEK293细胞凋亡中氧化应激作用[J]. 中国公共卫生, 2007, 23(10): 1192–1193. DOI:10.11847/zgggws2007-23-10-22 |
| [9] | Waisberg M, Joseph P, Hale B, et al. Molecular and cellular mechanisms of cadmium carcinogenesis[J]. Toxicology, 2003, 192(2-3): 95–117. DOI:10.1016/S0300-483X(03)00305-6 |
| [10] | Zhang H, Davies KJ, Forman HJ. Oxidative stress response and Nrf2 signaling in aging[J]. Free Radical Biology and Medicine, 2015, 88(Pt B): 314–336. |
| [11] | 朱佳玉, 邓宇, 徐斌, 等. 锰对小鼠黑质内活性氧及Nrf2信号通路影响[J]. 中国公共卫生, 2014, 30(4): 460–462. DOI:10.11847/zgggws2014-30-04-24 |
| [12] | Maher J, Yamamoto M. The rise of antioxidant signaling-the evolution and hormetic actions of Nrf2[J]. Toxicology and Applied Pharmacology, 2010, 244(1): 4–15. DOI:10.1016/j.taap.2010.01.011 |
| [13] | Singh A, Boldin-Adamsky S, Thimmulappa RK, et al. RNAi-mediated silencing of nuclear factor erythroid-2-related factor 2 gene expression in non-small cell lung cancer inhibits tumor growth and increases efficacy of chemotherapy[J]. Cancer Research, 2008, 68(19): 7975–7984. DOI:10.1158/0008-5472.CAN-08-1401 |
| [14] | Kawasaki Y, Ishigami S, Arigami T, et al. Clinicopathological significance of nuclear factor (erythroid-2)-related factor 2 (Nrf2) expression in gastric cancer[J]. BMC Cancer, 2015, 15: 5. DOI:10.1186/s12885-015-1008-4 |
| [15] | Hayden A, Douglas J, Sommerlad M, et al. The Nrf2 transcription factor contributes to resistance to cisplatin in bladder cancer[J]. Urologic Oncology, 2014, 32(6): 806–814. DOI:10.1016/j.urolonc.2014.02.006 |
| [16] | Konstantinopoulos PA, Spentzos D, Fountzilas E, et al. Keap1 mutations and Nrf2 pathway activation in epithelial ovarian cancer[J]. Cancer Research, 2011, 71(15): 5081–5089. DOI:10.1158/0008-5472.CAN-10-4668 |
| [17] | Jiang T, Chen N, Zhao F, et al. High levels of Nrf2 determine chemoresistance in type Ⅱ endometrial cancer[J]. Cancer Research, 2010, 70(13): 5486–5496. DOI:10.1158/0008-5472.CAN-10-0713 |
| [18] | Son YO, Pratheeshkumar P, Roy RV, et al. Nrf2/p62 signaling in apoptosis resistance and its role in cadmium-induced carcinogenesis[J]. The Journal of Biological Chemistry, 2014, 289(41): 28660–28675. DOI:10.1074/jbc.M114.595496 |
| [19] | Xu X, Zhang Y, Li W, et al. Wogonin reverses multi-drug resistance of human myelogenous leukemia K562/A02 cells via downregulation of MRP1 expression by inhibiting Nrf2/ARE signaling pathway[J]. Biochemical Pharmacology, 2014, 92(2): 220–234. DOI:10.1016/j.bcp.2014.09.008 |
| [20] | Ellis EM. Reactive carbonyls and oxidative stress:potential for therapeutic intervention[J]. Pharmacology and Therapeutics, 2007, 115(1): 13–24. DOI:10.1016/j.pharmthera.2007.03.015 |
| [21] | 辛爱, 唐修文. Nrf2-ARE信号通路与肿瘤发生及耐药性的关系[J]. 细胞生物学杂志, 2003, 31(3): 319–324. |
| [22] | Ganan-Gomez I, Wei Y, Yang H, et al. Oncogenic functions of the transcription factor Nrf2[J]. Free Radical Biology and Medicine, 2013, 65: 750–764. DOI:10.1016/j.freeradbiomed.2013.06.041 |
| [23] | Lawal AO, Ellis EM. Nrf2-mediated adaptive response to cadmium-induced toxicity involves protein kinase C delta in human 1321N1 astrocytoma cells[J]. Environmental Toxicology and Pharmacology, 2011, 32(1): 54–62. DOI:10.1016/j.etap.2011.03.010 |
| [24] | Lawal AO, Ellis E. Differential sensitivity and responsiveness of three human cell lines HepG2, 1321N1 and HEK 293 to cadmium[J]. The Journal of Toxicological Sciences, 2010, 35(4): 465–478. DOI:10.2131/jts.35.465 |
| [25] | Nazimabashir, Manoharan V, Miltonprabu S. Cadmium induced cardiac oxidative stress in rats and its attenuation by GSP through the activation of Nrf2 signaling pathway[J]. Chemico-Biological Interactions, 2015, 242: 179–193. DOI:10.1016/j.cbi.2015.10.005 |
| [26] | Milton Prabu S, Muthumani M, Shagirtha K. Quercetin potentially attenuates cadmium induced oxidative stress mediated cardiotoxicity and dyslipidemia in rats[J]. European Review for Medical and Pharmacological Sciences, 2013, 17(5): 582–595. |
| [27] | Lee YJ, Lee GJ, Baek BJ, et al. Cadmium-induced up-regulation of aldo-keto reductase 1C3 expression in human nasal septum carcinoma RPMI-2650 cells:Involvement of reactive oxygen species and phosphatidylinositol 3-kinase/Akt[J]. Environmental Toxicology and Pharmacology, 2011, 31(3): 469–478. DOI:10.1016/j.etap.2011.03.006 |
 2017, Vol. 33
2017, Vol. 33


