2. 潍坊市人民医院乳腺外科
乳腺癌是女性常见恶性肿瘤,严重威胁女性的健康,根据世界卫生组织 (World Health Organization, WHO) 公布的最新统计资料显示,乳腺癌目前高居女性恶性肿瘤发病率第1位,在总人群恶性肿瘤排列中占据第4位,也是中国女性最常见的恶性肿瘤之一[1-2]。虽然近年来针对乳腺癌的诊断和治疗取得明显进展,但每年仍有大量乳腺癌患者最终死于肿瘤的复发和转移。有研究证实,乳腺癌转移患者的5年存活率不足25%[3]。因此,从基因水平和细胞水平探讨乳腺癌细胞的转移机制非常重要。本研究以2种不同乳腺癌细胞系MCF-7(低转移株) 和MDA-MB-231(高转移株) 为研究对象,通过细胞划痕实验、细胞黏附实验及Transwell侵袭实验比较2种乳腺癌细胞体外侵袭能力差异,实时荧光定量PCR检测并筛选肿瘤侵袭转移相关基因在2种细胞间表达差异。结果报告如下。
1 材料与方法 1.1 主要试剂与仪器乳腺癌细胞株MCF-7及MDA-MB-231由潍坊医学院免疫学实验室保存;达尔伯克氏必需基本培养基 (Dulbecco′s modified Eagle media,DMEM)(美国Gibco公司);胎牛血清 (美国Hyclone公司);Transwell细胞培养小室 (美国COSTAR公司),Matrigel胶 (美国BD公司);Trizol试剂、逆转录试剂及实时荧光定量PCR试剂 (大连宝生物公司);细胞间黏附分子1(intercellular adhesion molecule 1,ICAM-1) 抗体 (美国CST公司),乳腺癌候选抑制蛋白1(breast cancer suppressor candidate 1,BCSC-1) 抗体和基质金属蛋白酶14(matrix metalloproteinase 14,MMP-14) 抗体 (美国Abcam公司);Substance P (SP) 免疫组化试剂盒 (北京博奥森公司)。NIS-Elements D 3.2电子显微镜 (日本尼康公司);Bio-Rad iQ5实时荧光定量PCR仪 (美国Bio-Rad公司);MK3型酶标仪 (美国Thermo公司)。
1.2 细胞培养乳腺癌细胞株MCF-7及MDA-MB-231于10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的DMEM培养基中,于37 ℃、5%CO2培养箱中培养,待细胞处于对数生长期时进行后续实验。
1.3 指标与方法 1.3.1 细胞划痕实验取对数生长期细胞,胰酶消化处理,完全DMEM重悬并制成1×105个/mL的细胞悬液,每孔2 mL接种于6孔板中,待细胞长成80%汇合度后弃去原培养基,加入无血清DMEM培养基继续培养24 h;200 μL无菌枪头在6孔板中垂直划线并于显微镜下观察24、48 h细胞迁移情况,NIS-Elements D电子显微镜拍照并测量细胞的平均迁移距离 (μm)。
1.3.2 细胞黏附能力测定25 μL/孔Matrigel胶包被96孔板并4 ℃过夜,20 μL/孔含2%牛血清白蛋白的DMEM培养基37 ℃封阻2 h,磷酸缓冲盐溶液 (phosphate buffer saline,PBS) 冲洗3遍。收集对数生长期细胞并调整细胞浓度至1×105个/mL,100 μL/孔接种于96孔板中。培养2 h后,对照组每孔加入20 μL噻唑蓝 (5 mg/mL) 继续培养4 h;实验组洗去未黏附细胞后每孔加入100 μL DMEM培养基和20 μL噻唑蓝 (5 mg/mL) 继续培养4 h。培养结束后对照组和实验组均加入三联液 (10%SDS+5%异丁醇+0.01 mol/L HCl)100 μL/孔过夜,酶标仪570 nm测吸光度值 (A值),并比较两种细胞黏附率的差异。细胞黏附率=实验组A570/对照组A570×100%。
1.3.3 Transwell侵袭实验实验前将MDA-MB-231细胞及MCF-7细胞于无血清培养基中饥饿12 h。Matrigel胶与DMEM按1:8比例稀释,60 μL/孔包被Transwell小室的上室面,置于37 ℃使胶聚合,将含有20%血清的DMEM培养基加入Transwell小室的下室。调细胞密度至5×105个/mL,100 μL/孔加入Transwell小室中,培养24 h后取出培养板,弃去小室中培养基,PBS冲洗3遍,预冷甲醇固定30 min,弃去甲醇,1%结晶紫染色30 min,弃去结晶紫,用棉签轻轻擦掉上室中未迁移的细胞,PBS冲洗掉背景颜色,倒置显微镜下观察细胞迁移情况;每个滤膜随机选取5个200倍视野,计数透膜细胞数。
1.3.4 实时荧光定量PCR采用Trizol法提取各组细胞总RNA,按试剂盒说明将400 ng RNA逆转录为cDNA,取2 μL cDNA为模板进行Real Time PCR反应,反应体系为25 μL,反应条件为:94 ℃预变性1 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s共40个循环;72 ℃ 10 min;将待测基因及β-actin的Ct值代入公式2-△△Ct计算各待测基因的表达水平。2种细胞分别以管家基因 (β-actin) 为对照,计算出各种基因表达量,然后再相互比较2种细胞中各基因表达差异。与肿瘤细胞浸润转移有关的基因:垂体瘤转化基因 (pituitary tumor transforming gene,PTTG)、血管内皮生长因子 (vascular endothelial growth factor,VEGF)、缺氧诱导因子1a (hypoxia inducible factor l,HIF1a)、Ki67、层粘连蛋白 (laminin)、骨桥蛋白 (osteopontin,OPN)、ICAM-1、BCSC-1、MMP-14、β-肌动蛋白 (β-actin) 引物见表 1。
| 表 1 Real time PCR所用引物序列 |
1.3.5 细胞免疫组化
调整细胞浓度至1×105个/mL并接种于6孔板中进行爬片,24 h后进行染色。PBS清洗细胞3遍,4%多聚甲醛固定15 min,PBS清洗3遍,0.5% Triton X-100 37 ℃温育20 min,PBS清洗3遍,3% H2O2 37 ℃温育15 min,滴加山羊血清工作液37 ℃封闭15 min,滴加一抗 (BCSC-1稀释度1:500;ICAM-1稀释度1:200;MMP-14稀释度1:500) 并放入湿盒4 ℃过夜;PBS清洗3遍,滴加生物素化二抗工作液温育30 min,PBS洗3遍,滴加辣根酶标记卵白素工作液温育15 min,PBS洗3遍,二氨基联苯胺 (diaminobenzidine, DAB) 显色5 min。自来水冲洗,苏木素复染,常规脱水封片。
1.4 统计分析实验数据以x±s表示,应用SPSS 10.0软件进行统计分析,组间比较采用Student′s t检验,以P < 0.05为差异有统计学意义,上述实验均重复3遍。
2 结果 2.1 2种细胞迁移距离比较 (图 1)
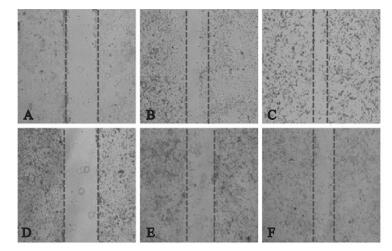
|
注:A、B、C:MDA-MB-231细胞分别培养0、24、48 h;D、E、F:MCF-7细胞分别培养0、24、48 h。 图 1 2种乳腺癌细胞迁移距离比较 (×40) |
划痕实验结果显示,MDA-MB-231细胞24、48 h的平均迁移距离分别为 (218.75±20.16)、(211.50±16.54)μm;MCF-7细胞24、48 h的平均迁移距离分别为 (130 ± 29.62)、(119.50 ± 25.65)μm,MDA-MB-231细胞平均迁移距离明显长于MCF-7细胞,差异有统计学意义 (t=4.93、6.03,P < 0.01)。
2.2 细胞黏附能力测定2种细胞的体外黏附能力存在差异,MCF-7细胞的平均黏附率为 (0.35±0.03)%,MDA-MB-231细胞的平均黏附率为 (0.52±0.11)%;MDA-MB-231细胞的黏附能力明显高于MCF-7细胞,(t=3.22,P < 0.05)。
2.3 2种细胞穿膜细胞数比较 (图 2)
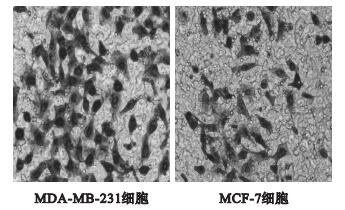
|
图 2 不同乳腺癌细胞Transwell侵袭实验 (结晶紫染色,×200) |
MDA-MB-231细胞24 h平均穿膜细胞数为 (57.75±4.19) 个,MCF-7细胞24 h平均穿膜细胞数为 (35.50±4.20) 个;MDA-MB-231细胞的穿膜细胞数量明显多于MCF-7细胞 (t=7.49,P < 0.01)。
2.4 2种细胞侵袭转移相关基因表达水平比较 (表 2)| 表 2 2种乳腺癌细胞侵袭转移相关基因表达比较 (x±s,n=3) |
MDA-MB-231细胞中ICAM-1及BCSC-1表达水平明显低于MCF-7细胞 (t=82.52、38.05,P < 0.01);MDA-MB-231细胞中MMP-14表达水平明显高于MCF-7细胞 (t=23.06,P < 0.01)。
2.5 2种细胞中ICAM-1、BCSC-1及MMP-14表达 (图 3)
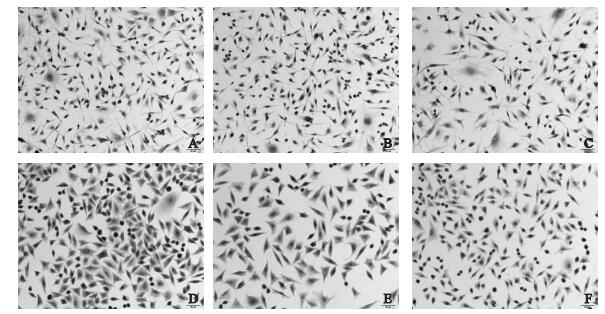
|
注:A、B、C:MDA-MB-231细胞ICAM-1、BCSC-1、MMP-14表达;D、E、F:MCF-7细胞ICAM-1、BCSC-1、MMP-14表达。 图 3 ICAM-1、BCSC-1以及MMP-14在2种乳腺癌细胞中的表达差异 (SP,×200) |
免疫组化结果显示,ICAM-1、BCSC-1及MMP-14在2种乳腺癌细胞中均有表达;其中ICAM-1和MMP-14主要表达于细胞膜上,在胞质中也有表达;BCSC-1主要集中在细胞质,在细胞核周也有聚集现象;ICAM-1及BCSC-1在MDA-MB-231细胞中表达低于MCF-7细胞,而MMP-14表达水平则高于MCF-7细胞。
3 讨论乳腺癌是女性最常见的恶性肿瘤之一,发病率近年来在全世界范围内呈上升趋势,严重威胁女性身心健康。在中国,乳腺癌发病率每年以3%速度增长[4]。虽然近年来对乳腺癌的治疗有了长足进步,但每年仍有约30%的患者死于转移和复发,且乳腺癌一旦复发,患者的中位生存时间不足2年。目前认为,肿瘤细胞的浸润和转移是导致病情恶化和患者死亡的关键因素[5]。因此,探讨影响肿瘤细胞浸润和转移的因素,控制和减少乳腺癌的复发,具有重要意义。
MCF-7及MDA-MB-231乳腺癌细胞株,生物学行为具有较大差异。MCF-7属上皮细胞型,属低转移株,体外侵袭能力较弱,MDA-MB-231属于间叶细胞型,属高转移株,体外侵袭能力较强[6]。本研究结果显示,MDA-MB-231细胞侵袭能力明显高于MCF-7细胞;MDA-MB-231细胞ICAM-1、BCSC-1表达水平明显低于MCF-7细胞,而MMP-14表达水平明显高于MCF-7细胞。ICAM-1作为一种重要的细胞间黏附分子,广泛参与细胞生长、分化、凋亡、血管生成及肿瘤细胞的浸润和转移等过程[7]。目前对ICAM-1在肿瘤浸润转移中的具体作用尚存争议。有观点认为,ICAM-1表达缺失或下调,能够降低肿瘤细胞之间的附着能力,有助于肿瘤细胞脱离癌巢并转移至远端组织,而且低水平的ICAM-1能通过减少与其配体分子的结合而逃脱机体杀伤性T细胞的识别和杀伤,从而逃脱机体免疫系统的监视,造成肿瘤的免疫逃逸现象[8-9]。有研究证实ICAM-1还可以抑制肿瘤细胞增殖从而发挥抑癌作用[10]。ICAM-1在乳腺癌、肺癌和胰腺癌等肿瘤中高表达,能够通过促进肿瘤细胞与淋巴管内皮细胞或血管内皮细胞之间的黏附,从而促进肿瘤细胞的侵袭和转移[11]。BCSC-1是从早期乳腺癌患者中发现的一个抑癌基因,定位于人类染色体11q23~q24,在乳腺癌、肺癌和食管癌等多种肿瘤中表达均下调或缺失[12-13]。Anghel等[14]证实BCSC-1能够通过下调微小转录因子 (microphthalmia transcription factor, MITF) 的表达抑制黑色素瘤的细胞增殖。BCSC-1对人乳腺癌细胞具有抑制性作用,转染BCSC-1基因能有效降低人乳腺癌细胞MDA-MB-231的体外侵袭能力[15]。MMP-14即MT1-MMP,是一种膜型基质金属蛋白酶,在多种肿瘤细胞中高表达。MMP-14不仅能够通过降解胶原、破坏基质膜以及形成浸润性伪足等方式促进肿瘤细胞侵袭转移,还可通过激活其他的MMPs如MMP-2和MMP-13进一步扩大其降解细胞外基质能力,高表达MMP-14的肿瘤患者一般预后较差[16-18]。MMP-14在乳腺癌中高表达,通过激活蛋白激酶C (protein kinase C,PKC) 等信号通路促进肿瘤发展,还可通过浸润性伪足的形成促进肿瘤细胞的浸润与转移[19]。阻断MMP-14活性可明显抑制小鼠乳腺癌细胞系4T1和E0771在小鼠乳腺中的成瘤能力[20]。Mali等[21]研究肠内酯对乳腺癌细胞的影响中发现,MMP-14在MCF-7细胞中的表达水平低于MDA-MB-231细胞。与本研究结果一致。
综上所述,乳腺癌MDA-MB-231细胞侵袭能力明显高于MCF-7细胞,其机制可能与细胞中ICAM-1、BCSC-1低表达、MMP-14高表达有关。
| [1] | Chen W, Zheng R, Zeng H, et al. The updated incidences and mortalities of major cancers in China, 2011[J]. Chin J Cancer, 2015, 34(3): 1–6. DOI:10.1186/s40880-015-0006-x |
| [2] | 郑艳敏, 沈月平, 刘银梅, 等. 中国女性乳腺癌危险因素Meta分析[J]. 中国公共卫生, 2012, 28(12): 1645–1648. DOI:10.11847/zgggws-2012-28-12-35 |
| [3] | Hong W, Dong E. The past, present and future of breast cancer research in China[J]. Cancer Letters, 2014, 351(1): 1–5. DOI:10.1016/j.canlet.2014.04.007 |
| [4] | 杨海英, 朱建红, 金玉凤. 社区居民乳腺癌患病及危险因素调查[J]. 中国公共卫生管理, 2015(4): 573–574. |
| [5] | Ortiz-Martinez F, Sanmartin E, Pomares-Navarro E, et al. Osteopontin regulates VEGFA and ICAM-1 mRNA expression in breast carcinoma[J]. American Journal of Clinical Pathology, 2015, 143(6): 812–822. DOI:10.1309/AJCP6F2VNDAMSULA |
| [6] | 尹玉慧, 吕新全, 杨建萍, 等. 干细胞样细胞在不同乳腺癌细胞系的标记研究[J]. 实用医学杂志, 2010, 26(23): 4286–4289. DOI:10.3969/j.issn.1006-5725.2010.23.017 |
| [7] | Ramos TN, Bullard DC, Barnum SR. ICAM-1:isoforms and phenotypes[J]. The Journal of Immunology, 2014, 192(10): 4469–4474. DOI:10.4049/jimmunol.1400135 |
| [8] | Jenkinson C, Elliott V, Menon U, et al. Evaluation in pre-diagnosis samples discounts ICAM-1 and TIMP-1 as biomarkers for earlier diagnosis of pancreatic cancer[J]. Journal of Proteomics, 2015, 113: 400–402. DOI:10.1016/j.jprot.2014.10.001 |
| [9] | Kotteas EA, Boulas P, Gkiozos I, et al. The intercellular cell adhesion molecule-1(icam-1) in lung cancer:implications for disease progression and prognosis[J]. Anticancer Res, 2014, 34(9): 4665–4672. |
| [10] | Groote MLD, Kazemier HG, Huisman C, et al. Upregulation of endogenous ICAM-1 reduces ovarian cancer cell growth in the absence of immune cells[J]. International Journal of Cancer, 2014, 134(2): 280–290. DOI:10.1002/ijc.28375 |
| [11] | Haustein M, Ramer R, Linnebacher M, et al. Cannabinoids increase lung cancer cell lysis by lymphokine-activated killer cells via upregulation of ICAM-1[J]. Biochemical Pharmacology, 2014, 92(2): 312–325. DOI:10.1016/j.bcp.2014.07.014 |
| [12] | Zhao CL, Yu WJ, Gao ZQ, et al. Association of BCSC-1 with human esophageal squamous cell carcinoma[J]. Neoplasma, 2015, 62(5): 765–769. DOI:10.4149/neo_2015_091 |
| [13] | Martin ES, Cesari R, Pentimalli F, et al. The BCSC-1 locus at chromosome 11q23-q24 is a candidate tumor suppressor gene[J]. Proc Natl Acad Sci USA, 2003, 100(20): 11517–11522. DOI:10.1073/pnas.1934602100 |
| [14] | Anghel SI, Correarochal R, Budinská E, et al. Breast cancer suppressor candidate-1(BCSC-1) is a melanoma tumor suppressor that down regulates MITF[J]. Pigment Cell and Melanoma Research, 2012, 25(4): 482–487. DOI:10.1111/pcr.2012.25.issue-4 |
| [15] | 邸大琳, 陈蕾, 王丽娜, 等. BCSC-1基因异位表达对MDA-MB-231体外侵袭能力影响及其机制的探讨[J]. 中华肿瘤防治杂志, 2014, 21(6): 415–419. |
| [16] | Dong Y, Chen G, Gao M, et al. Increased expression of MMP14 correlates with the poor prognosis of Chinese patients with gastric cancer[J]. Gene, 2015, 563(1): 29–34. DOI:10.1016/j.gene.2015.03.003 |
| [17] | Wu KP, Li Q, Lin FX, et al. MT1-MMP is not a good prognosticator of cancer survival:evidence from 11 studies[J]. Tumor Biology, 2014, 35(12): 12489–12495. DOI:10.1007/s13277-014-2567-8 |
| [18] | Williams KC, McNeilly RE, Coppolino MG. SNAP23, syntaxin4, and vesicle-associated membrane protein 7(VAMP7) mediate trafficking of membrane type 1-matrix metalloproteinase (MT1-MMP) during invadopodium formation and tumor cell invasion[J]. Molecular Biology of the Cell, 2014, 25(13): 2061–2070. DOI:10.1091/mbc.E13-10-0582 |
| [19] | Rosse C, Lodillinsky C, Fuhrmann L, et al. Control of MT1-MMP transport by atypical PKC during breast-cancer progression[J]. Proceedings of the National Academy of Sciences, 2014, 111(18): 1872–1879. DOI:10.1073/pnas.1400749111 |
| [20] | Ager EI, Kozin SV, Kirkpatrick ND, et al. Blockade of MMP14 activity in murine breast carcinomas:implications for macrophages, vessels, and radiotherapy[J]. Journal of the National Cancer Institute, 2015, 107(4): v17. |
| [21] | Mali AV, Wagh UV, Hegde MV, et al. In vitro anti-metastatic activity of enterolactone, a mammalian lignan derived from flax lignan, and down-regulation of matrix metalloproteinases in MCF-7 and MDA MB 231 cell lines[J]. Indian Journal of Cancer, 2012, 49(1): 181–187. DOI:10.4103/0019-509X.98948 |
 2017, Vol. 33
2017, Vol. 33


