2. 吉林医药学院附属医院病理科
肝脏疾病是威胁人类健康的主要疾病之一。随着生活水平提高,肝脏疾病的发生率也不断上升。脂肪肝、酒精肝、病毒性肝炎、免疫性肝损伤受到越来越广泛的重视。研究表明,许多肝脏疾病的发生、发展和预后与肝细胞凋亡有密切关系[1-2],氧自由基 (reactive oxygen species,ROS) 在肝细胞凋亡发生发展中起着主要作用,几乎所有肝损伤均与自由基所致机体蛋白质氧化损伤有关[3]。萱草花 (Hemerocallis citrina baroni) 又名黄花菜,是常用的补益类中药,有利湿热、宽胸隔、安五脏、治酒疸,安寐解郁等作用[4],中医用来治疗胸隔烦热、肝性黄疸、改善肝功能[5]。萱草花总黄酮 (Hemerocallis citrina baroni flavonids,HCBF) 是其主要功效成分之一,具有护肝、抗抑郁、镇静催眠、抗氧化等药理作用[6]。本研究以卡介苗与脂多糖诱导免疫性肝损伤小鼠为模型,通过观察HCBF对小鼠抗氧化能力及肝细胞凋亡相关基因表达影响,探讨HCBF抗免疫性肝损伤作用及机制,结果报告如下。
1 材料与方法 1.1 实验动物昆明种小鼠80只,雄性,SPF级,体重 (20±3) g,购于吉林大学动物实验中心,许可证号:SCXK (吉)2010-0001。各组小鼠饲养于吉林医药学院机能实验动物中心,基础饲料喂养,自由饮水,光照时间7:00-19:00,湿度45%,适应饲养1周。
1.2 主要试剂与仪器HCBF提取物 (总黄酮提取率为26.5%,1 g提取物相当于生药材28 g,吉林医药学院药学院提取);卡介苗 (武汉生物制品所);细菌脂多糖 (lipopolysaccharide, LPS)、2, 4-二硝基氯苯 (2,4-dinitrochlorobenzene,CDNB)(美国Sigma公司);超氧化物歧化酶 (superoxide dismutase,SOD)、丙二醛、谷胱甘肽过氧化物酶 (glutathione-peroxidase,GSH-Px) 试剂盒 (南京建成生物工程研究所);BCL-2-associated X protein (bax)、lymyhoma/leukemia-2 protein (bcl-2) 免疫组织化学试剂盒 (武汉博士德生物工程公司)。BECKMAN CX7全自动生化分析仪 (美国贝克曼公司);751分光光度计 (上海分析仪器厂);EL-301型酶联免疫仪 (美国Bio-Tek公司);Vanox多功能显微镜 (日本Olympus公司)。
1.3 HCBF制备取萱草花粗粉适量,添加20倍量70%乙醇,加热、回流提取4 h,提取3次,冷冻干燥,得提取物粉末,按照文献[7]方法测定总黄酮含量,HCBF含量为9.4 mg/g,提取物粉末总黄酮含量为5.6%。取提取物粉末加水溶解成10 g/L水溶液 (总黄酮:0.56 g/L),作为大孔吸附树脂纯化准备液。取预先处理好AB-8大孔吸附树脂,按照径高比1:6湿法装柱,取准备液6倍柱体积 (bed volume, BV) 上样 (2 mL/min),用6 BV蒸馏水洗脱除杂 (2 mL/min),加入30%乙醇洗脱,收集3 BV洗脱液,30%洗脱液浓缩回收乙醇,冷冻干燥,得提取物粉末,依法测定总黄酮含量,纯化粉末总黄酮含量为26.5 %,备用。
1.4 动物模型建立及分组[8]小鼠按体重随机分为5组 (n=16):对照组、模型组、HCBF低、中、高剂量组 (15、30、60 mg/kg)。各组小鼠腹腔注射卡介苗15 mg/g (溶于0.2 mL生理盐水中,新鲜配制),对照组注射同等体积生理盐水,HCBF各剂量组小鼠灌胃给予相应剂量HCBF,1次/d,连续7 d,对照组小鼠灌胃等量双蒸水。第8天小鼠腹腔注射LPS 2 μg/g,对照组小鼠腹腔注射同等体积生理盐水,8 h后,各组随机取8只小鼠断头处死,分离血清,待测;取肝组织,4 ℃生理盐水冲洗,加双蒸水冰浴匀浆,20%匀浆液离心,取上清,-20 ℃贮存。另8只小鼠,以0.4%戊巴比妥钠 (0.01 mL/g) 腹腔麻醉,开胸,门静脉插管,用灌注液 (4 ℃乙醇、磷酸盐缓冲液50 mmol/L、NaCl 120 mmol/L,乙二胺四乙酸10 mmol/L、pH 8.0) 灌流10 min,取肝脏左叶制备石蜡切片,进行组织病理学检查。
1.5 指标与方法 1.5.1 小鼠体重及肝、脾指数测定[9]最后一次灌胃8 h后,各组小鼠断头处死,解剖肝、脾称量重量,并按照下列公式计算肝指数、脾指数。肝指数=(肝重量×100%)/体重;脾指数=(脾重量×100%)/体重。
1.5.2 小鼠血清alanine aminotransferase (ALT) 活性检测[10]小鼠断头取血1 mL,3 500 r/min离心5 min,分离血清,用自动生化分析仪测定各组小鼠血清ALT活性。
1.5.3 小鼠肝组织病理切片观察取小鼠肝脏左叶,10%甲醛固定、选块、3 μm切片、苏木精-伊红染色法 (hematoxylin-eosin staining,HE),200倍显微镜观察。
1.5.4 肝组织丙二醛含量和SOD、GSH-Px活力检测[11]取肝脏左叶0.5 g,冰冷生理盐水漂洗,去血液,冰浴条件下,以1:4(M/V) 加入生理盐水制成20 %组织匀浆,3 500 r/min低温离心10 min,取上清,采用硫代巴比妥酸反应法检测丙二醛含量,采用硝酸还原酶法检测SOD活力,采用比色法检测GSH-Px活力,严格按照试剂盒说明书操作。
1.5.5 肝组织中bax、bcl-2表达检测采用免疫组织化学 (streptavidin-biotin complex, SABC) 法[12],取小鼠肝组织3×3 mm,固定、脱水、包埋、切片,按常规SABC法烤片、脱蜡,浸入无水乙醇Ⅰ、无水乙醇Ⅱ中各3 min,浸入95%、90%、80%、70%酒精中各3 min,蒸馏水洗3 min,浸入3%H2O2 5 min,0.01 mol/L构椽酸盐缓冲液 (pH6) 加热10 min,磷酸缓冲盐溶液 (phosphate buffer saline,PBS) 洗3次,加5%牛血清蛋白封闭液20 min,吸干后加入一抗 (兔抗鼠bax、bcl-2),4 ℃过夜,PBS洗3次,加入二抗,30 min,PBS洗3次,加入SABC液,20 min,PBS洗3次,二氨基联苯胺 (diaminobenzidine,DAB) 显色,苏木素复染,脱水后,中性树胶封片,显微镜观察。全自动图像分析仪随机取10个视野测定阳性面积,HPIAS图像分析软件计算肝组织阳性细胞面积吸光度平均值,为bax、bcl-2表达相对含量。
1.6 统计分析数据以±s表示,采用SPSS 16.0软件进行统计分析,组间比较采用t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 HCBF对免疫性肝损伤小鼠血清ALT活性影响对照组、模型组、HCBF低、中、高剂量组小鼠血清ALT活性分别为 (36.83±12.17)、(105.48±46.34)、(65.57±24.54)、(56.38±26.31)、(59.77±13.34) U/L;与对照组比较,模型组小鼠血清中ALT活性明显升高,差异有统计学意义 (P < 0.01),表明模型建立成功。与模型组比较,HCBF低、中、高剂量组小鼠血清ALT活性均明显降低,差异有统计学意义 (P < 0.05)。
2.2 HCBF对免疫性肝损伤小鼠肝组织病理学影响 (图 1)
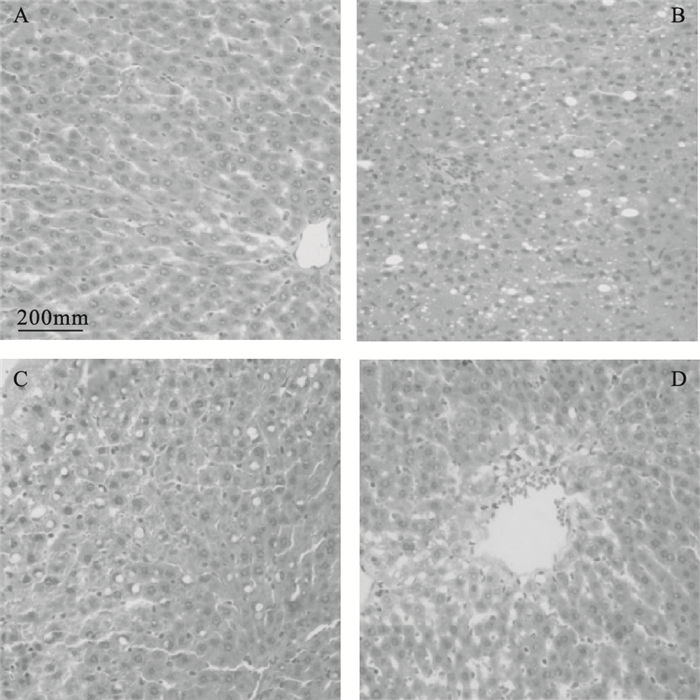
|
注:A:对照组;B:模型组;C、D:HCBF 30、60 mg/kg组。 图 1 HCBF对免疫性肝损伤小鼠肝组织病理影响 (HE,×200) |
对照组小鼠肝组织结构清晰,肝细胞索排列整齐呈放射状 (图 1A);与对照组比较,模型组小鼠肝细胞坏死严重,排列紊乱,伴大量淋巴细胞侵润,胞浆水肿,部分细胞出现脂肪空泡变性 (图 1B);HCBF 30、60 mg/kg剂量组小鼠肝脏可见肝细胞轻度胞浆疏松,炎细胞侵润轻重不一,少量细胞见脂肪空泡,坏死程度较模型组减轻,肝细胞主要表现为胞浆弥漫性水肿 (图 1C、D)。
2.3 HCBF对免疫性肝损伤小鼠肝组织抗氧化能力影响 (表 1)| 表 1 HCBF对免疫性损伤小鼠肝脏抗氧化能力影响 (x±s,n=8) |
与对照组比较,模型组小鼠肝组织中SOD、GSH-Px活力明显降低、丙二醛含量明显升高,差异有统计学意义 (P < 0.01);与模型组比较,HCBF各剂量组小鼠肝脏中SOD活力均明显升高 (P < 0.05),HCBF中、高剂量组小鼠肝脏中GSH-Px活力均明显升高 (P < 0.01)、丙二醛含量明显下降 (P < 0.05)。
2.4 HCBF对小鼠体重及肝、脾指数影响 (表 2)| 表 2 HCBF对小鼠体重及肝、脾指数影响 (x±s,n=8) |
与对照组比较,模型组小鼠体重下降 (P < 0.05),肝指数升高 (P < 0.05);与模型组比较,HCBF 60 mg/kg组小鼠体重升高,肝指数下降,差异有统计学意义 (P < 0.05);各组小鼠脾指数变化不明显。
2.5 HCBF对小鼠肝组织中bax、bcl-2表达影响 (表 3)| 表 3 HCBF对小鼠肝组织中bax、bcl-2表达影响 (x±s,n=8) |
与对照组比较,模型组小鼠肝脏中bax表达升高,bcl-2表达下降 (P < 0.05),bax/bcl-2比例明显升高;与模型组比较,HCBF 30、60 mg/kg剂量组小鼠肝脏中bax表达下降,bcl-2表达明显升高 (P < 0.05)。
3 讨论肝是机体物质代谢重要器官,当受到药物、病毒、缺氧、免疫等有害因子侵害时,肝细胞可出现损伤,发生炎症、坏死及纤维化等病理改变。肝损伤发生机制涉及多环节,氧化应激反应在免疫性肝损伤发生发展过程中扮演着重要角色,维持氧自由基动态平衡,可有效减轻肝损伤[13]。本研究采用卡介苗和脂多糖诱导小鼠免疫性肝损伤,该模型稳定且重现性好。本研究结果显示,HCBF能够明显降低免疫性肝损伤小鼠血清ALT活性,表明HCBF对小鼠肝脏过氧化脂质生成具有明显抑制作用;病理切片结果表明HCBF可明显减轻肝细胞变性、坏死及炎性侵润,减轻肝组织病理性损伤。提示,HCBF对免疫性肝损伤具有保护作用。
SOD是机体抗氧化体系的一种含金属离子酶,可催化超氧自由基的歧化反应,保护细胞膜结构与功能完整性[14]。丙二醛是自由基代谢机体不饱和脂肪酸形成的脂质过氧化产物。GSH-Px主要作用为清除超氧阴离子 (O2-) 和过氧化氢 (H2O2)[15]。本研究结果表明HCBF各剂量组小鼠肝细胞抗氧化酶SOD、GSH-Px活力明显高于模型组,丙二醛含量低于模型组。提示,HCBF可降低卡介苗和脂多糖诱导的免疫性肝损小鼠氧化应激程度。
位于线粒体膜、核膜、内质网膜上的bcl-2蛋白可抑制组织细胞凋亡,其家族中的bax可对抗bcl-2抗凋亡作用,是促凋亡基因。bcl-2与bax形成同二聚体或异二聚体,从而改变线粒体膜通透性,加速细胞凋亡[16-17]。bax与bcl-2的表达程度与2者比值对细胞凋亡起关键作用[18]。bax在体内组织中表达较bcl-2广泛,bcl-2在肝组织中仅少量表达或不表达,而bax在肝组织为中等表达。本研究结果显示,对照组小鼠肝脏未见bcl-2蛋白表达,而Bax蛋白在各组小鼠肝脏中均有不同程度表达;与模型组比较,HCBF 30、60 mg/kg组小鼠肝脏bcl-2蛋白表达升高,Bax蛋白表达减少,bax/bcl-2比例下降。提示,HCBF拮抗卡介苗和脂多糖诱导的免疫性肝损伤机制可能与促进肝脏bcl-2表达、降低bax蛋白表达,进而抑制免疫性肝损伤细胞凋亡有关。
| [1] | 刘欢, 陈英利, 张冰, 等. 酒精性肝损伤的氧化应激和同型半胱氨酸促进肝细胞凋亡及其机制[J]. 哈尔滨医科大学学报, 2015, 49(3) : 219–224. |
| [2] | 李素婷, 吴淑彦, 杜超, 等. 山楂叶总黄酮对酒精性肝损伤小鼠肝细胞凋亡的影响[J]. 中国老年学杂志, 2015, 35(7) : 1889–1891. |
| [3] | 杨社华, 葛斌, 王艳红, 等. 马栗籽提取物对急性肝损伤小鼠自由基及TNF-α含量的影响[J]. 中国医院药学杂志, 2014, 34(17) : 1453–1456. |
| [4] | 王云锋, 赵丽晶, 徐博, 等. 萱草花的营养成分和生物活性研究进展[J]. 吉林医药学院学报, 2012, 33(1) : 46–49. |
| [5] | 潘红, 郝丽静, 黄建梅, 等. 萱草花化学成分研究[J]. 时珍国医国药, 2012, 23(9) : 2186–2187. |
| [6] | 安英, 沈楠, 赵丽晶, 等. 萱草花总黄酮对四氯化碳诱导大鼠慢性肝纤维化的保护作用[J]. 时珍国医国药, 2015, 26(7) : 1623–1625. |
| [7] | 郭冷秋, 张颖, 张博, 等. 萱草根及萱草花的化学成分和药理作用研究进展[J]. 中华中医药学刊, 2013, 31(1) : 74–76. |
| [8] | 龚晓男, 王晶. 黄芪甲苷对免疫性肝损伤大鼠保护作用[J]. 中国公共卫生, 2014, 30(5) : 634–636. |
| [9] | 杨逸, 覃筱燕, 郭哲, 等. 人参皂苷Rg1对小鼠免疫性肝损伤保护作用[J]. 中国公共卫生, 2015, 31(3) : 309–311. |
| [10] | Long Y, Dong X, Yuan Y, et al. Metabolomics changes in a rat model of obstructive jaundice:mapping to metabolism of amino acids, carbohydrates and lipids as well as oxidative stress[J]. J Clin Biochem Nutr, 2015, 57(1) : 50–59. DOI:10.3164/jcbn.14-147 |
| [11] | Amorim BO, Covolan L, Ferreira E, et al. Deep brain stimulation induces antiapoptotic and anti-inflammatory effects in epileptic rats[J]. J Neuroinflammation, 2015, 12(1) : 162. DOI:10.1186/s12974-015-0384-7 |
| [12] | 秦佩, 雷志明, 吴双, 等. 槲皮素对Con A诱导自身免疫性肝损伤作用[J]. 中国公共卫生, 2015, 31(6) : 757–759. |
| [13] | Sen S, Chakraborty R, Thangavel G, et al. Hepatoprotective and antioxidant activity of Karisalai Karpam, a polyherbal Siddha formulation against acetaminophen-induced hepatic damage in rats[J]. Anc Sci Life, 2015, 34(4) : 198–202. DOI:10.4103/0257-7941.160863 |
| [14] | Choi EK, Jung H, Kwak KH, et al. Effects of allopurinol and apocynin on renal ischemia-reperfusion injury in rats[J]. Transplant Proc, 2015, 47(6) : 1633–1638. DOI:10.1016/j.transproceed.2015.06.007 |
| [15] | Jiang H, Wang Z, Ma Y, et al. Effects of dietary lycopene supplementation on plasma lipid profile, lipid peroxidation and antioxidant defense system in feedlot Bamei lamb[J]. Asian-Australas J Anim Sci, 2015, 28(7) : 958–965. DOI:10.5713/ajas.14.0887 |
| [16] | Kuroda K, Kabata T, Hayashi K, et al. The paracrine effect of adipose-derived stem cells inhibits osteoarthritis progression[J]. BMC Musculoskelet Disord, 2015, 16(1) : 236. DOI:10.1186/s12891-015-0701-4 |
| [17] | Carnet O, Lecomte J, Masset A, et al. Mesenchymal stem cells shed amphiregulin at the surface of lung carcinoma cells in a juxtacrine manner[J]. Neoplasia, 2015, 17(7) : 552–563. DOI:10.1016/j.neo.2015.07.002 |
| [18] | 杨方万, 穆茂媛, 肖娟娟, 等. 内质网应激诱导细胞凋亡机制的研究进展[J]. 医学研究杂志, 2014, 43(10) : 176–180. |
 2017, Vol. 33
2017, Vol. 33


