慈菇,又称剪刀草、燕尾草、蔬卵,属泽泻科,是一种药食兼用的天然抗氧化食物,盛产于中国南方山区,如福建闽西连城、上杭一带。研究显示,慈菇多糖能够提高小鼠的胸腺指数、脾脏指数及小鼠腹腔巨噬细胞的吞噬能力[1],本研究通过观察不同剂量慈菇多糖对小鼠巨噬细胞增殖影响,探讨慈菇多糖提高巨噬细胞功能的可能机制,结果报告如下。
1 材料与方法 1.1 主要试剂与仪器慈菇多糖,纯度73.81%,由福建省环境与健康研究所提供(经水提醇沉法、二乙氨乙基纤维素色谱柱提纯获得);香菇多糖(山东振东泰盛制药有限公司,规格:1 mg/支);DMEM高糖培养基(美国Hyclone公司);胰蛋白酶、双抗(链、青霉素)(美国Gibco公司);胎牛血清(杭州四季青生物工程材料有限公司);二甲基亚砜(厦门鹭隆生物科技发展有限公司);小鼠白细胞介素2(interleukin-2,IL-2)、肿瘤坏死因子α(tumor necrosis factor α, TNF-α) ELISA试剂盒(上海蓝基生物科技有限公司);去DNA逆转录试剂盒、SYBR Premix Ex Taq荧光定量试剂盒(日本TaKaRa公司);Trizol Reagent (美国Invitrogen公司);哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)抗体(兔抗鼠)、第10染色体缺失与张力蛋白同源磷酸酶基因(phosphatase and tensin homologdeleted on chromosome ten,PTEN)抗体(兔抗鼠)(美国Cell Signaling Technology公司);兔抗鼠甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(英国Abcam公司)。CK40-F200 BH-2倒置显微镜(日本Olympus公司);GeneAmp PCR System 2400(美国Foster City公司);Lighter 480型荧光定量PCR仪(美国Roche公司);垂直电泳槽、电泳仪、半干电转仪(美国Bio-Rad公司);Odyssey SA近红外双色激光成像系统(美国LI-COR公司)。
1.2 RAW 264.7细胞与培养小鼠巨噬细胞RAW 264.7(中科院上海细胞库),小鼠巨噬细胞RAW 264.7以含10%胎牛血清的DMEM高糖培养基(含100 IU/mL青霉素和100 IU/mL链霉素),37 ℃、5%CO2环境培养,取对数生长期细胞进行实验。
1.3 指标与方法 1.3.1 RAW 264.7细胞增殖检测以5.6×104个/孔密度将细胞接种于96孔板,实验设慈菇多糖5、50、500、5 000 μg/mL剂量组,每组5个复孔,同时设对照组(未加慈菇多糖干预物)和培养液空白组;作用12、24、36 h后,加入20 μL噻唑蓝[3-(4, 5-dimethylthiazol-2-yl)-2, 5-diphenyltetrazolium bromide,MTT](5 g/L),于37 ℃、5%CO2培养箱孵育4 h,每孔加100 μL二甲基亚砜,轻震10 min,酶标仪550 nm波长检测吸光度(A)值,计算细胞增值率,细胞增值率=(实验组A值-对照组A值)/对照组A值×100%。
1.3.2 RAW 264.7细胞因子水平检测取对数生长期细胞以2×106个/孔接种于6孔板,实验设对照组、慈菇多糖低、中、高剂量组(5、50、500 μg/mL)和香菇多糖组(100 μg/mL),每组3个复孔;铺板24 h后分别给予无血清DMEM、慈菇多糖、香菇多糖,于37 ℃、5%CO2培养箱孵育12 h后,观察细胞形态;吸取上清液,测定细胞因子IL-2、TNF-α分泌水平;裂解细胞,按试剂盒说明书测定细胞内NO含量。
1.3.3 RAW 264.7细胞mTOR、PTEN mRNA表达检测引物设计与合成由上海生工生物工程有限公司完成。引物序列如下:β-actin上游:5′-AAATCG-TGCGTGACATCAAAGA-3′,下游:5′-GGCCATC-TCCTGCTCGAA-3′;mTOR上游:5′-CCGCATCATTCACCCAATAGTTC-3′,下游:5′-CGCACGAGGACTTTATTCACCA-3′;PTEN上游:5′-AGACCATA-ACCCACCACAGC-3′,下游:5′-TACACCAGT-CCGTCCCTTTC-3′。取对数生长期细胞以2×106个/孔接种于6孔板,分组与处理方法同1.3.2;各组于37 ℃、5%CO2培养箱干预12 h,抽提总RNA,参照逆转录试剂盒操作进行cDNA合成(37 ℃ 15 min,85 ℃ 5 s,-4 ℃冷却,-20 ℃保存);Real time PCR反应条件:95 ℃ 30 s循环1次,95 ℃ 5 s、60 ℃ 34 s循环40次。采用β-actin基因作为内对照,应用实时荧光定量PCR检测各组细胞mTOR、PTEN基因表达,每组3个复孔,取平均值。
1.3.4 RAW264.7细胞mTOR、PTEN蛋白表达检测采用Western blot法,取对数生长期细胞以2×106个/孔接种于6孔板,分组与处理方法同1.3.2;于37 ℃、5%CO2培养箱干预12 h后提取蛋白;配制分离胶和浓缩胶;蛋白样品沸水煮5~10 min致蛋白变性,上样;浓缩胶80 V、分离胶100 V电泳分离;硝酸纤维素膜转膜,封闭;加入封闭液稀释的一抗,孵育1.5 h;TBST缓冲液洗膜;加入TBST缓冲液稀释的二抗,孵育3 h;TBST缓冲液洗膜;Odyssey红外成像仪800通道检测mTOR、PTEN蛋白表达水平。
1.4 统计分析数据采用x±s表示,应用SPSS 18.0软件进行统计分析,多组间均数比较采用单因素方差分析、组间两两比较采用最小显著差法(方差齐性)和Dunnett T3(方差不齐),检验水准α=0.05。
2 结果 2.1 慈菇多糖对RAW264.7细胞增殖影响(表 1)| 表 1 慈菇多糖对RAW 264.7细胞增值率影响(%,x±s,n=5) |
对照组细胞呈圆形或椭圆形,贴壁良好,突起较少,而慈菇多糖干预后细胞数目增加,体积明显增大,呈现菱形、梭形或不规则形,可见较长伪足,以50~500 μg/mL剂量组、干预12 h最为显著;与对照组比较,各慈姑多糖干预组RAW 264.7细胞增殖率明显升高(F=95.157,P < 0.01)、不同干预时间各组RAW 264.7细胞增殖率差异明显(F=43.946,P < 0.01);以500 μg/mL慈菇多糖干预12 h,RAW 264.7细胞增殖率最高。
2.2 慈菇多糖对RAW 264.7细胞因子水平影响(表 2)| 表 2 慈菇多糖对RAW264.7细胞因子水平影响(x±s,n=3) |
与对照组比较,慈菇多糖低、中、高剂量组及香菇多糖组RAW 264.7细胞内IL-2水平升高,慈菇多糖中、高剂量组及香菇多糖组RAW 264.7细胞内TNF-α水平升高,慈菇多糖高剂量组RAW 264.7细胞内NO水平升高,差异有统计学意义(P < 0.01)。
2.3 慈菇多糖对RAW 264.7细胞mTOR、PTEN mRNA表达影响(表 3)| 表 3 慈菇多糖对RAW 264.7 mTOR、PTEN mRNA表达影响(x±s,n=3) |
与对照组比较,慈菇多糖中、高剂量组RAW 264.7细胞内mTOR mRNA表达降低,慈菇多糖高剂量组RAW 264.7细胞内PTEN mRNA表达降低,差异有统计学意义(P < 0.05)。
2.4 慈菇多糖对RAW 264.7细胞mTOR、PTEN蛋白表达影响(图 1)
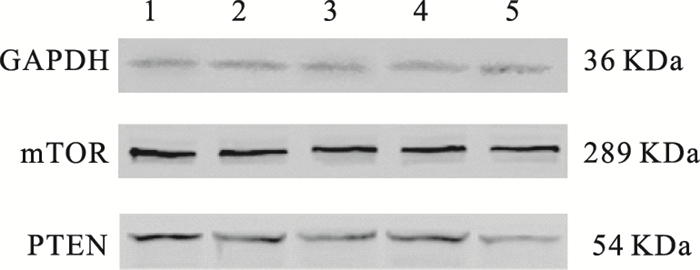
|
注:1:对照组;2~4:慈菇多糖低、中、高剂量组;5:香菇多糖组。 图 1 慈菇多糖对RAW 264.7细胞mTOR、PTEN蛋白表达影响 |
结果显示,慈菇多糖干预12 h后,对照组, 慈菇多糖低、中、高剂量组, 香菇多糖组RAW 264.7细胞内mTOR蛋白表达水平分别为(2.618±0.134)、(2.485±0.178)、(2.354±0.316)、(1.925±0.287)、(2.223±0.015);与对照组比较,慈菇多糖高剂量组、香菇多糖组RAW 264.7细胞内mTOR蛋白表达降低(P < 0.05)。对照组,慈菇多糖低、中、高剂量组,香菇多糖组RAW 264.7细胞内PTEN蛋白表达水平分别为(1.168±0.135),(0.780±0.213)、(1.159±0.354)、(1.138±0.106),(0.751±0.274);各组间无明显差异。
3 讨论研究发现,多糖类免疫应答调节剂(biological responsemodifier,BRM)与巨噬细胞(MF)等免疫细胞表面模式识别受体(pattern recognition receptor,PRR)结合启动免疫应答[2]。多糖类BRM与MF等免疫细胞的表面多糖受体结合,激活细胞的信号转导途径,增强MF的免疫功能并促使IL-1、TNF-α、NO等细胞因子的分泌增加。这些免疫活性分子作为细胞间相互作用的内源性信号,继发地诱导产生其他细胞因子,如IL-2、IL-6、IL-8、IL-12,并对机体的免役应答起到重要的调节作用[3-4]。本研究结果显示,与对照组比较,慈菇多糖各剂量组RAW 264.7细胞内IL-2、TNF-α、NO含量升高,且慈菇多糖高剂量组RAW 264.7细胞内TNF-α、NO浓度高于香菇多糖组。提示慈菇多糖具有促进巨噬细胞产生细胞因子的能力,且在一定条件下效果优于香菇多糖。
mTOR的主要生物学作用为调控细胞生长和蛋白质合成、细胞运动、细胞自噬、调节免疫、影响肿瘤发生、控制能量代谢[5]。在免疫系统中,mTOR信号对维持免疫稳态起重要作用。无论是天然免疫细胞(如中性粒细胞、肥大细胞、巨噬细胞、树突状细胞)的存活迁移及炎症因子分泌[6-7],还是适应性免疫细胞(如T细胞)的分化决定均离不开mTOR信号调节[8-10]。本研究结果显示,慈菇多糖中、高剂量组RAW 264.7细胞的mTOR mRNA基因表达下降,慈菇多糖高剂量组、香菇多糖组mTOR蛋白表达也显著低于对照组。PTEN蛋白表达(位于PI3K/PTEN/Akt/mTOR信号通路上)未见改变,仅慈菇多糖高剂量组PTEN mRNA表达有所下降,提示慈菇多糖提高免疫功能机制可能与PI3K/PTEN/Akt/mTOR有关。
| [1] | 吴小南, 杨雪帆, 朱萍萍, 等. 慈菇多糖对免疫功能低下小鼠免疫调节作用[J]. 中国公共卫生, 2015, 31(1) : 73–75. |
| [2] | Schepetkin IA, Quinn MT. Botanical polysaccharides:macrophage immunomodulation and therapeutic potential[J]. Int Immunopharmacol, 2006, 6(3) : 317–333. DOI:10.1016/j.intimp.2005.10.005 |
| [3] | Kim HS, Kim YJ, Lee HK, et al. Activation of macrophages by polysaccharide isolated from Paecilomyces cicadae through toll-like receptor 4[J]. Food and Chemical Toxicology, 2012, 50(9) : 3190–3197. DOI:10.1016/j.fct.2012.05.051 |
| [4] | Huang M, Mei X, Zhang S. Mechanism of nitric oxide production in macrophages treated with medicinal mushroom extracts (review)[J]. International Journal of Medicinal Mushrooms, 2011, 13(1) : 1–6. DOI:10.1615/IntJMedMushr.v13.i1 |
| [5] | Laplante M, Sabatini DM. mTOR signaling in growth control and disease[J]. Cell, 2012, 149(2) : 274–293. DOI:10.1016/j.cell.2012.03.017 |
| [6] | Weichhart T, Costantino G, Poglitsch M, et al. The TSC-mTOR signaling pathway regulates the innate inflammatory response[J]. Immunity, 2008, 29(4) : 565–577. DOI:10.1016/j.immuni.2008.08.012 |
| [7] | Katholnig K, Linke M, Pham H, et al. Immune responses of macrophages and dendritic cells regulated by mTOR signaling[J]. Biochem Soc Trans, 2013, 41(4) : 927–933. DOI:10.1042/BST20130032 |
| [8] | Delgoffe GM, Kole TP, Zheng Y, et al. The mTOR kinase differentially regulates effector and regulatory T cell lineage commitment[J]. Immunity, 2009, 30(6) : 832–844. DOI:10.1016/j.immuni.2009.04.014 |
| [9] | Park Y, Jin HS, Lopez J, et al. TSC1 regulates the balance between effector and regulatory T cells[J]. J Clin Invest, 2013, 123(12) : 5165–5178. DOI:10.1172/JCI69751 |
| [10] | Zeng H, Yang K, Cloer C, et al. mTORC1 couples immune signals and metabolic programming to establish T (reg)-cell function[J]. Nature, 2013, 499(7459) : 485–490. DOI:10.1038/nature12297 |
 2016, Vol. 32
2016, Vol. 32


