2. 江苏省疾病预防控制中心慢性非传染病防制所, 江苏 南京 210009
吸烟是糖尿病、心脑血管疾病、肿瘤和慢性呼吸系统疾病等4种主要慢性非传染性疾病的首要危险因素之一。从香烟烟雾中分离出化学物质多达3 000余种,主要有害成分包括尼古丁、烟焦油、一氧化碳和芳香化合物等一系列有毒、有害物[1],长期的被动吸烟还会导致血糖血脂及代谢异常[2]。2002年开展的全国性吸烟流行病学调查显示,中国人群现在吸烟率为31.4%[3],根据该吸烟率估计总吸烟者为3.5亿人。2008年和2010年调查显示,中国糖尿病的患病率分别为9.7%和11.6%[4-5]。研究表明,丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号级联系统在细胞内外信号转导过程中起着重要的作用。本实验通过香烟烟雾提取物(cigarette smoke extract, CSE)模拟吸烟效应,探讨MAPK信号通路在CSE所致胰岛细胞增殖抑制中的作用及其机制。
1 材料与方法 1.1 主要试剂与仪器MIN6细胞系购自American Type Culture Collection (ATCC)细胞库, 高糖Dulbecco′s modified Eagle medium (DMEM)培养基、胎牛血清(美国GIBCO公司),β-巯基乙醇(美国Sigma Aldrich公司),青霉素-链霉素溶液、胰岛白酶、细胞裂解液、CCK-8和蛋白含量测定法(bicinchonininc acid, BCA)试剂盒(上海碧云天生物有限公司),fluorescein isothiocyanate (FITC)-annexin V双染法细胞凋亡试剂盒、BD FACS-Calibur流式细胞仪(美国BD公司),c-Jun N-terminal kinase (JNK)、extracellular-signal-regulated kinase (ERK)、p38MAPK及cleaved-caspase-3(美国CST公司),tubulin抗体、辣根过氧化物酶二抗(上海碧云天生物有限公司),倒置相差显微镜(日本Olympus公司),M200光栅型连续波长酶标仪(瑞士TECAN公司),电泳仪、电泳槽、转移槽(美国伯乐公司),ECL发光液(英国ABCAM公司)。
1.2 细胞培养与传代MIN6细胞用高糖(25 mmol/L葡萄糖) DMEM培养基(含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素、5.5 μmol/L β-巯基乙醇)传代培养,置于37 ℃、5% CO2细胞培养箱中培养,待细胞生长进入对数期时,采用2.5%胰酶消化1 min,制成单细胞悬液后分皿培养。
1.3 指标与方法 1.3.1 CSE的配置购于肯塔基大学烟草研究所的1R4F标准卷烟(焦油含量9 mg/支,烟碱含量0.8 mg/支)连于一个抽吸装置点燃,每支香烟抽吸1 min/次,每次持续2 s,每支香烟抽吸5 min, 每支香烟约产生10 mg CSE,溶解于无血清培养液配置成CSE原液(吸光度320 nm下,校正浓度为1 mg/mL, 将其pH值调至7.2~7.4,用0.2 μm孔膜进行滤菌处理,CSE原液储存在-80 ℃备用。
1.3.2 胰岛细胞形态及活力的测定培养良好的MIN6细胞消化制成悬液后铺24孔板,待过夜细胞贴壁后更换新鲜培养液,处理方式为正常对照组(即CSE浓度为0 μg/mL),CSE各浓度处理组:20、50、100和200 μg/mL。处理24 h后,倒置相差显微镜下观察MIN6细胞形态变化;MIN6细胞密度为1×106个/mL接种于96孔板,平行接种2个板,每个实验处理组设3个复孔,每孔100 μL培养体系。待过夜细胞贴壁后,加入CSE,处理浓度同上,但2板分别处理24和48 h。处理完毕后倒去原培养液,一组每孔分别加入10 μL的CCK-8试剂和90 μL无血清培养液,培养箱中孵育1~3 h,检测波长450 nm (参比波长600 nm)检测细胞的A值。
1.3.3 JNK、ERK、p38MAPK和caspase-3蛋白表达检测采用蛋白印迹法(Western blot,WB)方法。处理好的细胞用细胞刮子收集细胞,细胞裂解液裂解细胞后离心收集细胞总蛋白,BCA法测定总蛋白浓度后,确定上样量,加热变性后与5X上样缓冲液混匀后进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)电泳,加入电泳缓冲液后上样,约3 h后半干法转硝酸纤维素膜(nitrocellulose membrane,NC),5%脱脂奶粉封闭1 h,一抗(1:1 000)4 ℃孵育过夜,次日洗完一抗后,二抗(1:1 000~1:2 000)孵育1 h,洗膜后加入electrogenerated chemiluminescence (ECL)发光液显色,暗室曝光。
1.4 统计分析数据以x±s表示,采用SPSS 19.0软件进行统计分析, 实验组数据与对照组的比较采用SNK法进行方差分析,方差不齐则采用多样本Kruskal-Wallis秩和分析,以P < 0.05为差异有统计学意义。
2 结果 2.1 CSE对MIN6细胞形态的影响(图 1)
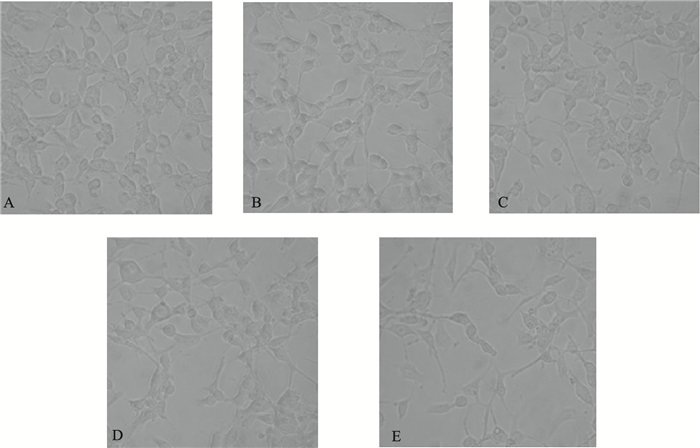
|
注:A:对照组;B~E为处理组,CSE浓度分别为20、50、100和200 μg/mL。 图 1 CSE对MIN6细胞形态的影响 |
对照组MIN6细胞(无CSE处理)聚生长,胞间粘附及贴壁均较牢, 细胞核致密, 状态良好;与对照组相比,随着CSE浓度的增加细胞出现变形,当CSE达到100 μg/mL及以上浓度时,MIN6细胞拉长并出现梭形样改变,胞核固缩,贴壁细胞出现脱落现象,可见较多细胞碎片。
2.2 CSE对MIN6细胞增殖的影响(表 1)| 表 1 CSE对MIN6细胞活性的影响 |
与对照组比较,随着CSE剂量的增加, MIN6细胞的活力下降,20、50 μg/mL CSE实验组细胞活力分别为(97.32±2.67)%和(94.67±5.33)%; 与对照组相比,100 μg/mL CSE实验组细胞活力[(87.71±12.3)%]明显下降(P < 0.05), CSE浓度达到200 μg/mL时,细胞活力下降更为明显,为(74.23±25.8)%,且差异有统计学意义(P < 0.01),并呈一定剂量-效应关系。鉴于高剂量CSE引起细胞活力的明显下降,浓度为20~100 μg/mL的CSE用于进一步实验研究。
2.3 CSE对MIN6细胞JNK、ERK和p38MAPK蛋白表达的影响(图 2)
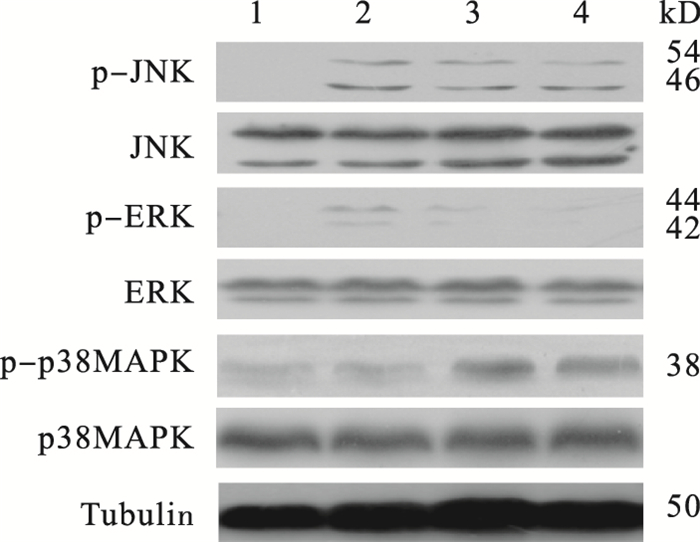
|
注:1:对照组; 2~4:20、50、100 μg/mL CSE。 图 2 CSE对MIN6细胞中JNK、ERK、p38MAPK蛋白表达及磷酸化水平的影响 |
WB结果显示,对照组JNK、ERK和p38MAPK蛋白均有表达,但p-JNK、p-ERK和p-p38MAPK均未激活;与对照组比较,除20 μg/mLCSE实验组外,其他各剂量实验组的p-ERK均没有明显激活(P < 0.05);p-JNK和p-p38MAPK在各剂量CSE组处理的MIN6细胞中均被明显激活,与对照组相比差异有统计学意义(P < 0.05),且磷酸化程度随着剂量的增加升高,呈一定的剂量-效应关系。
3 讨论许多研究表明,吸烟可导致诸如动脉粥样硬化、呼吸道炎症及癌症等各种疾病[6-9]。吸烟对健康的危害主要来源于烟草燃烧后烟雾中释放的有害化学物质,吸烟者在吸入卷烟时,卷烟在不完全燃烧中发生一系列的热分解与热合成的化学反应,形成大量新的有害物质,其化学成分复杂,主要是刺激性气体和致癌的焦油颗粒物的混合物。慢性吸烟者呈现代谢综合征状态,现代流行病学证据也已经表明吸烟与一定程度的胰岛素抵抗相关,并会导致2型糖尿病发病风险明显增加[10-11]。同时,越来越多的研究认为,不管是因自身免疫炎症性破坏所致胰岛细胞破坏而导致胰岛素绝对量缺乏的Ⅰ型糖尿病(type 1 diabetes, T1D),还是由于功能性胰岛细胞不能代偿胰岛素抵抗而产生的Ⅱ型糖尿病(type 2 diabetes, T2D),均存在炎症性胰岛细胞损害。本研究表明,香烟烟雾提取物可引起MIN6细胞形态异常及细胞活力下降,并呈一定的剂量-效应关系。提示香烟烟雾提取可致胰岛细胞损害,显著降低细胞活性。
MAPKs信号转导通路是胞外信号从胞膜传递至胞浆再到胞核内DNA的重要信号转导通路,参与调控细胞的众多生物学过程,如增殖、生长、分化及死亡等[12-13]。目前研究最多的是ERK、JNK、p38MAPK3条途径,研究认为JNK和p38属于应激型MAPK,可被应激刺激、炎症因子、紫外线照射及热休克等激活,通常二者表现为协同作用,参与细胞炎症及损害反应、癌基因转化和细胞凋亡过程。本研究发现,随着实验组CSE剂量的增加,MIN6细胞的JNK及p38MAPK信号通路被激活, 磷酸化蛋白p-JNK和p38MAPK表达水平明显升高。提示CSE引起胰岛细胞炎症及损害的机制可能与CSE应激激活MIN6细胞内JNK和p38MAPK信号通路有关,但有关JNK和p38MAPK信号通路在其中发挥的具体作用有待进一步研究。
| [1] | van Zeeland AA, de Groot AJ, Hall J, et al. 8-Hydroxydeoxy-guanosine in DNA from leukocytes of healthy adults:relationship with cigarette smoking, environmental tobacco smoke, alcohol and coffee consumption[J]. Mutat Res, 1999, 439(2) : 249–257. DOI:10.1016/S1383-5718(98)00192-2 |
| [2] | 姜昆, 赵博, 崔荣, 等. 长期被动吸烟与血糖及血脂关系病例对照研究[J]. 中国公共卫生, 2016, 32(2) : 218–221. |
| [3] | 杨功焕, 马杰民, 刘娜, 等. 中国人群2002年吸烟和被动吸烟的现状调查[J]. 中华流行病学杂志, 2005, 26(2) : 77–83. |
| [4] | Sung HY, Wang L, Jin S, et al. Economic burden of smoking in China, 2000[J]. Tob Control, 2006, 15(Suppl 1) : i5–i11. |
| [5] | Ma RC, Lin X, Jia W. Causes of type 2 diabetes in China[J]. Lancet Diabetes Endocrinol, 2014, 2(12) : 980–991. DOI:10.1016/S2213-8587(14)70145-7 |
| [6] | Zhao Y, Xu Y, Li Y, et al. NF-B-mediated inflammation leading to EMT via miR-200c is involved in cell transformation induced by cigarette smoke extract[J]. Toxicological Sciences, 2013, 135(2) : 265–276. DOI:10.1093/toxsci/kft150 |
| [7] | Ota Y, Kugiyama K, Sugiyama S, et al. Impairment of endothelium-dependent relaxation of rabbit aortas by cigarette smoke extract-role of free radicals and attenuation by captopril[J]. Atherosclerosis, 1997, 131(2) : 195–202. DOI:10.1016/S0021-9150(97)06106-6 |
| [8] | Rom O, Avezov K, Aizenbud D, et al. Cigarette smoking and inflammation revisited[J]. Respiratory Physiology and Neurobiology, 2013, 187(1) : 5–10. DOI:10.1016/j.resp.2013.01.013 |
| [9] | Catsburg C, Kirsh VA, Soskolne CL, et al. Active cigarette smoking and the risk of breast cancer:a cohort study[J]. Cancer Epidemiology, 2014, 38(4) : 376–381. DOI:10.1016/j.canep.2014.05.007 |
| [10] | Willi C, Bodenmann P, Ghali WA, et al. Active smoking and the risk of type 2 diabetes:a systematic review and meta-analysis[J]. JAMA, 2007, 298(22) : 2654–2664. DOI:10.1001/jama.298.22.2654 |
| [11] | Morimoto A, Tatsumi Y, Deura K, et al. Impact of cigarette smoking on impaired insulin secretion and insulin resistance in Japanese men:The Saku Study[J]. J Diabetes Investig, 2013, 4(3) : 274–280. DOI:10.1111/jdi.2013.4.issue-3 |
| [12] | Wagner EF, Nebreda AR. Signal integration by JNK and p38 MAPK pathways in cancer development[J]. Nat Rev Cancer, 2009, 9(8) : 537–549. DOI:10.1038/nrc2694 |
| [13] | Huang P, Han J, Hui L. MAPK signaling in inflammation-associated cancer development[J]. Protein Cell, 2010, 1(3) : 218–226. DOI:10.1007/s13238-010-0019-9 |
 2016, Vol. 32
2016, Vol. 32


