食源性病毒是以食物为载体,导致人类患病的病毒。食源性病毒一直难以得到及时有效的监控,不仅对食品卫生和人民健康构成严重威胁,也对食品工业和国民经济造成很大的影响。目前,以分子生物学技术为基础的PCR方法成已为食源性病毒检测的主要方法[1],其灵敏度和精确度不断提高,但是仍存在操作误差、核酸提取效率未知等因素,影响检测结果的可靠性和可比性,不利于检测方法标准化[2]。因此,在实际检测中,需要对每个检测步骤进行严格控制。本研究以贝类为基质,研究MS2噬菌体作为食源性病毒实时荧光定量逆转录聚合酶链反应(real-time quantitative reverse transcription-PCR,qRT-PCR)检测中过程质控的应用,现将结果报告如下。
1 材料与方法 1.1 主要试剂与仪器MS2噬菌体(ATCC 15597-B1)(山东出入境检验检疫局馈赠)、MS2噬菌体宿主菌埃希大肠杆菌(ATCC 15597)(美国标准菌种保藏中心)、人星状病毒(human astrovirus,HAstV)检测核酸标准物质样品(北京出入境检验检疫局检验检疫技术中心实验室制备);SuperScript® Ⅲ Platinum® One-Step Quantitative RT-PCR System(美国Invitrogen公司)、QIAamp Viral RNA Mini Kit(德国QIAGEN公司)、蛋白酶K[天根生化科技(北京)有限公司]、Dynabeads® mRNA Purification Kit(美国Life Technology 公司)、Trizol(美国Invitrogen公司);营养肉汤、普通营养琼脂/下层营养琼脂(北京陆桥技术股份有限公司);上层营养琼脂:胰蛋白胨 10 g,NaCl 5.0 g,葡萄糖 1.0 g,琼脂粉 6.0 g,2.5 mol/L CaCl2储备液10 mL,蒸馏水 1 000 mL,调节pH至7.2[3];Fr-1iocell恒温培养箱(德国MMM公司)、7900 HT Fast实时荧光PCR仪(美国ABI公司)。
1.2 样品来源选取有日常生活中有代表性的3种贝类样品(蛏子、花蛤和青蛤)进行添加实验。所有样品均购自超市,购入后立即进行添加实验或者保存于-20 ℃,实验前先检查样品的外壳是否完整。每种样品取3份,分别进行4个水平的添加。
1.3 方法 1.3.1 MS2噬菌体培养参照卫生部《消毒技术规范》(2002年版)[4]方法,并加以改进。用5.0 mL营养肉汤溶解埃希氏大肠杆菌(ATCC 15597)的冻干粉末,37 ℃培养17~24 h,划线接种于普通营养琼脂平板,37 ℃培养17~24 h,从平板上挑取单个菌落接种于5.0 mL营养肉汤,37 ℃、220 r/min培养18~24 h,获得菌悬液。0.3 mL菌悬液与0.2 mL MS2噬菌体溶液混匀,37 ℃孵育5 min,加入4 mL冷却至50 ℃左右的上层营养琼脂,混匀后倒入已铺好的下层营养琼脂上铺平,上层营养琼脂凝固,37 ℃倒置培养17~24 h后观察噬菌斑。5.0 mL磷酸盐缓冲液(phosphate buffered saline,PBS)洗下上层琼脂,转入无菌试管,加数滴氯仿,37 ℃ 220 r/min 孵育1 h,上层液体5 000 r/min 离心15 min,上清液即为MS2噬菌体悬液。重复以上方法,实现MS2噬菌体大量增殖,经0.22 μm微孔滤器除菌后,分装为1 mL/支,-80 ℃保存。
1.3.2 噬菌体效价10倍梯度稀释MS2噬菌体悬液,各稀释度接种3个平板,按1.2.1方法培养17~24 h,取噬菌斑数在30~300个的平板计算MS2噬菌体效价:效价[噬斑形成单位(plaque forming unit,pfu)/mL]=平均pfu数÷接种体积(mL)×稀释倍数。
1.3.3 MS2噬菌体稳定性将已知效价的MS2噬菌体悬液分装到1.5 mL的环氧树脂(epoxy resin,EP)管中,每管100 μL,共100管,分别随机抽取25支分配到室温(20~25)、4、-20和-80 ℃保存。制备后第0、1、3、7、14、21和28 d从4种保存条件中分别随机取3支,提取RNA,检测循环阈值(cycle threshold,Ct),每支重复3次。
1.3.4 比较不同RNA提取方法回收率 1.3.4.1 向样品中添加MS2噬菌体及样品前处理10倍梯度稀释已知效价的MS2噬菌体悬液,参考ISO/TS品15216-2:2013(E)[5]方法,取完整的冷冻或鲜活的蛏子、花蛤和青蛤,用无菌镊子剥离出消化腺,称取(2.0±0.2)g,转移到50 mL离心管内,加入1 mL无菌PBS旋涡振荡混匀,加入10 μL MS2噬菌体悬液,每份消化腺添加1个梯度,设置1个阴性添加对照,添加10 μL无菌PBS。加入10 μL蛋白酶K,漩涡振荡混匀,37 ℃ 320 r/min 孵育1 h,60 ℃水浴15 min,3 000 r/min离心5 min,取上清称重,记为m1。
1.3.4.2 MS2噬菌体RNA的提取和纯化取280 μL上清用于提取RNA,记录质量,记为m2。用QIAamp Viral RNA Mini Kit、Trizol裂解和Trizol裂解+磁珠纯化3种方法提取RNA。
1.3.4.3 qRT-PCR检测(表 1)反应体系包括10 μmol/L上下游引物各1 μL,10 μmol/L 探针 0.5 μL,RNA模板5 μL,总体积25 μL。反应参数为:50 ℃ 15 min;95 ℃ 2 min;95 ℃ 15 s,60 ℃ 30 s,45个循环。MS2噬菌体和人星状病毒(human astrovirus,HAstV)目的基因扩增的引物和探针序列分别来源于山东出入境检验检疫局和SN/T2519[6]方法。
| 表 1 qRT-PCR反应引物和探针序列 |
1.3.4.4 建立标准曲线
取10 μL MS2噬菌体悬液,分别用1.3.4.2中QIAamp Viral RNA Mini Kit、Trizol裂解和Trizol裂解+磁珠纯化3种方法提取RNA后,焦碳酸二乙酯(diethyl paracabonate,DEPC)水10倍梯度稀释,qRT-PCR检测100、10-1、10-2、10-3、10-4、10-5梯度RNA的Ct值。MS2噬菌体效价取log10为横坐标,对应的Ct值为纵坐标绘制标准曲线,取>3个呈良好线性关系的点,使R2>0.98。3种提取方法均建立标准曲线。
1.3.4.5 回收率计算确定最适添加量MS2噬菌体悬液添加到贝类消化腺后,经前处理、核酸提取、qRT-PCR检测Ct值,带入标准曲线计算回收率,当回收率>1%时,认为MS2噬菌体RNA得到有效提取。确定最适添加范围,要求按此范围添加MS2噬菌体到不同贝类基质时,RNA均能得到有效提取。
1.3.5 MS2噬菌体对贝类食源性病毒检测影响 1.3.5.1 组别设置阳性样品:向贝类消化腺中添加本实验室保存的HAstV,制备HAstV阳性样品。阳性样品分为2组,一组添加MS2噬菌体,一组不添加;过程质控:按1.3.4.4建立标准曲线,向贝类消化腺单独添加已知效价的MS2噬菌体,提取RNA,qRT-PCR检测Ct,计算其回收率,当回收率>1%时,认为病毒RNA得到了有效提取;阴性对照:向贝类消化腺添加10 μL无菌PBS,作为阴性对照;空白对照:DEPC水。
1.3.5.2 扩增效率监控(图 1)外部质控RNA(external control RNA,EC)采用本实验室制备的HAst核酸标准物质样品,比较不同反应孔的Ct值,分析qRT-PCR中样品的扩增效率。
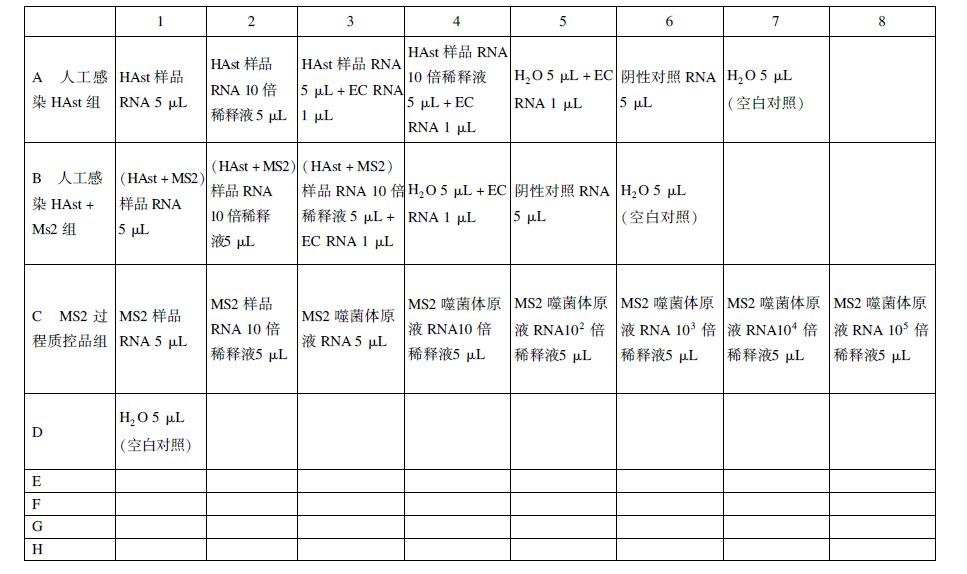
|
图 1 96孔板点样示意图 |
1.3.5.3 结果判断
Ct(样品RNA+EC RNA)-Ct(H2O+EC RNA)<2.00,认为荧光RT-PCR扩增效率较好;Ct(样品RNA+EC RNA)-Ct(H2O+EC RNA)>2.00,认为样品中有荧光RT-PCR反应抑制剂,则进行10-1样品检测;Ct(样品RNA1×10-1+EC RNA)-Ct(H2O+EC RNA)<2.00,认为荧光RT-PCR扩增效率较好;Ct(样品RNA 1×10-1+EC RNA)-Ct(H2O+EC RNA)>2.00,认为样品中有荧光RT-PCR反应抑制剂,结果不可取。比较添加与未添加MS2噬菌体悬液的2组样品的扩增效率,观察MS2噬菌体添加是否会干扰贝类中食源性病毒检测。
1.4 统计分析采用SPSS 17.0 统计软件分析,组间均数比较采用t检验,检验水准为α=0.05。
2 结 果 2.1 MS2噬菌体效价上层营养琼脂出现透亮圆形噬菌斑,则说明MS2噬菌体活化增殖。不同稀释梯度的MS2噬菌体培养平板中,只有10-9和10-10 2个梯度出现了适合计数的噬菌斑,其中10-9的3个平板噬菌斑计数分别为72、78和64 pfu。本研究使用的MS2噬菌体悬液效价(pfu/mL)=(72+78+64)/3÷0.2×107=7.13×1011(pfu/mL)。
2.2 MS2噬菌体悬液稳定性(表 2)100 μL已知效价的MS2噬菌体悬液在-20 ℃和-80 ℃中保存28 d后,MS2噬菌体RNA含量无明显变化[P=0.653(-20 ℃);P=0.561(-80 ℃)]。
| 表 2 MS2噬菌体悬液稳定性检测结果(n=6) |
2.3 不同RNA提取方法回收率比较(表 3)
向不同贝类消化腺中添加已知效价的MS2噬菌体,计算得出不同添加量和不同RNA提取方法对回收率的影响。结果表明,3种提取方法中,Trizol裂解提取方法的回收率均<1%,不符合回收率>1%的要求。其他2种提取方法中,添加10-1~10-2梯度的MS2噬菌体在不同贝类中回收率均>1%。因此,MS2噬菌体最适添加量可确定为7.13×108 ~7.13×107 pfu/mL。回收率=(A计算/A添加)×(m1/m2)×100%。其中,A计算为“标准曲线计算的MS2噬菌体含量”,即已知效价的MS2噬菌体添加到贝类消化腺,qRT-PCR检测的Ct在标准曲线上对应的MS2噬菌体效价;A添加为“MS2噬菌体添加量”,即实际添加到贝类中的MS2噬菌体效价;m1为样品前处理后上清质量,记为m1;m2为280 μL上清的质量。
| 表 3 不同浓度梯度MS2噬菌体添加的回收率 |
2.4 MS2噬菌体添加对贝类中病毒检测影响(图 2~3、表 4)
未添加MS2噬菌体阳性样品组中,Ct(样品RNA+EC RNA)-Ct(H2O+EC RNA)=23.02-32.81=-9.79<2.00;添加MS2噬菌体阳性样品组中,Ct(样品RNA+EC RNA)-Ct(H2O+EC RNA)=23.53-32.87=-9.34<2.00,说明MS2噬菌体添加不影响阳性样品qRT-PCR反应的扩增效率。过程质控:向贝类消化腺内添加的MS2噬菌体效价为7.13×108 pfu/mL;提取相同含量的MS2噬菌体的RNA,10倍梯度稀释,分别检测Ct值(图 2),以各浓度梯度的噬菌体效价log10为横坐标,相对应的Ct值为纵坐标,建立标准曲线,标准曲线方程为:Y=-3.267X+46.658,R2=0.995。利用标准曲线方程计算回收率为4.08%>1%,表明RNA得到了有效提取,检测结果有效可信。空白对照和阴性对照均无扩增曲线,且MS2噬菌体和EC RNA均呈现良好“S”扩增曲线,2种阳性样品RNA和阳性样RNA 10-1稀释检测结果Ct值均<40,且扩增曲线呈现良好的S型(图 3)。根据ISO/TS 15216-2:2013(E)结果判定方法,认为2种阳性样品均被检出,且Ct值比较接近(表 4),因此可以认为MS2噬菌体对贝类中病毒检测无影响。

|
注:1:7.13×108 pfu; 2:7.13×107 pfu; 3:7.13×106 pfu; 4:7.13×105 pfu; 5:7.13×104 pfu; 6:7.13×103 pfu。 图 2 MS2噬菌体过程质控品标准曲线 |

|
注:A:人工感染HAstV样品;B:人工感染HAstV+MS2样品。1:样品+EC;2:样品×10-1+EC;3:样品;4:样品×10-1;5:H2O+EC;6:阴性对照;7: H2O;8:样品+EC+MS2;9:10-1+EC+MS2;10:样品+MS2;11:样品×10-1+MS2;12:H2O+EC 图 3 2种人工感染HAst阳性样品扩增曲线 |
| 表 4 2种阳性样品Ct 值检测结果(n=3) |
3 讨 论
美国疾病预防控制中心(center for disease control,CDC)的数据表明,病毒已成为食源性疾病的重要病因[7]。常见的食源性病毒包括:轮状病毒(rotavirus,RV)、诺如病毒(norovirus,NoV)、HAstV、腺病毒、札如病毒等[8]。其中RV是引起儿童急性腹泻和儿童重症腹泻最常见的病毒,全球每年约有1.14亿儿童发生RV腹泻,中国每年约有27 000名<5岁儿童死于RV腹泻;而美国CDC监测数据估计30%~50%的食源性腹泻与NoV有关;且HAstV已被确认为引起婴幼儿急性腹泻的重要病原体之一[9-12]。近20年来,食品中食源性病毒的检测方法和检测标准有了明显的发展。其中,国际上的检测标准主要为欧洲标准化委员会(European Committee of Standardization,CEN)发布的ISO技术标准 ISO/TS 15216-1 和ISO/TS 15216-2,检测方法为qRT-PCR方法[5, 13];中国的检测标准主要有SN/T 2519-2010等,主要为RT-PCR、qRT-PCR和逆转录环介等温核酸扩增技术(reverse-transcription loop-mediated isothermal amplification,RT-LAMP)检测方法[6]。由此可见,以分子生物学为基础的PCR方法已成为食品中食源性病毒检测的主要手段。PCR检测方法包括病毒富集、病毒RNA核酸提取、RNA逆转录和PCR扩增反应等多个检测步骤,其中病毒富集和病毒RNA提取过程为关键步骤,必须对其进行有效的质量控制。ISO/TS 15216-1和ISO/TS 15216-2[5, 13]中均指出,使用qRT-PCR检测食品中甲肝病毒和NoV时,需要应用可体外培养增殖的无包膜正向单链RNA(+ssRNA)病毒进行过程质控,确保检测结果可靠性。该过程质控病毒应该与被检测的病毒大小相似,但与被检测病毒基因序列有明显的区别,且自然状态中不存在,只能人为添加到被检测样品中[14-16]。
ISO/TS相关标准中以门哥病毒(Mengo virus)MC0株进行过程质控品[5, 13]。门哥病毒是一种非包膜的单链RNA病毒,属于小核糖体家族,其MC0株缺乏多聚胞嘧啶束,不具有毒力,与野生型生长特征相同[17]。但ISO/TS相关标准也指出,门哥病毒MC0株是基因修饰产物,且需要特定的实验条件,在不允许应用基因修饰生物或没有相关实验条件的实验室内,应用qRT-PCR食源性病毒检测时,应该使用其他的适合的过程质控[13]。有研究应用鼠诺如病毒1(murine norovirus 1,MNV-1)对蔬菜中HAV和水中NoV、人戊型肝炎病毒qRT-PCR检测进行过程质控[18-20]。Di Pasquale等[21]也应用猫嵌环状病毒(feline calicivirus,FCV)对瓶装天然矿泉水中HAV qRT-PCR检测进行过程质控;还有研究建议,可将FCV作为食品和水中RNA病毒检测方法的过程质控品[22]。虽然这些RNA病毒具有抗DNase和RNase消化的特点,能够对RNA提取过程进行监控,但是其均有生物传染性,不易培养和纯化,且有些用作过程质控品的RNA病毒保守基因位点较少。以FCV为例,其不同的病毒株之间表现出较高的遗传多样性,不利于引物、探针的设计,且被检测病毒目的基因的引物和探针易与FCV发生交叉时,因此FCV不适于用作食源性病毒检测的过程质控[23]。MS2噬菌体是一种无包膜+ssRNA病毒,感染F+(雄株)大肠埃希氏菌,直径27 nm,易于培养和纯化,对人体无致病性,其基因组不含常见的食源性病毒的靶基因序列[24],因此可模拟待测病毒颗粒,对病毒浓缩、RNA提取、RNA逆转录和PCR扩增进行监控。Blaise-Boisseau等[25]将MS2噬菌体用于食品和水体中HAV qRT-PCR检测的过程质控,取得了理想结果。Rolfe等[26]报道采用MS2噬菌体为粪便样品中NoV检测的过程质控,研究表明是监控PCR检测假阴性结果的一种简便可靠的方法。此外,MS2噬菌体也可用于评价病毒RNA提取方法,判断病毒核酸提取是否引入了PCR扩增抑制剂[27]。这些研究表明,普通的微生物实验室即可进行MS2噬菌体的培养与纯化,可用双层培养法确定其效价,不会对实验室人员带来感染风险,且MS2噬菌体基因组序列与常规的食品样品不发生交叉,能够有效监控RNA病毒检测的病毒富集和RNA提取过程,监控PCR扩增假阴性结果。
本研究采用MS2噬菌体作为食源性病毒qRT-PCR检测方法中的过程质控品,通过双层琼脂法计算MS2噬菌体悬液的效价,再向3种贝类消化腺添加不同稀释梯度的已知效价的MS2噬菌体悬液,计算分析回收率,比较3种病毒RNA提取方法,结果表明Trizol提取法不是有效的病毒RNA提取方法,需要结合其他核酸纯化浓缩方法完成提取工作,或者直接使用可靠的商品化试剂盒;进一步确定MS2噬菌体作为病毒核酸检测的过程质控品,最适添加量可为7.13×108 ~7.13×107 pfu/mL。根据ISO/TS 1526-2,2013(E)[5]方法评价MS2噬菌体添加对阳性样品检测结果的影响,表明病毒扩增效率未受到MS2噬菌体添加的影响,添加和未添加MS2噬菌体的阳性样品均被荧光RT-PCR检出。因此MS2噬菌体可作为贝类中食源性病毒qRT-PCR检测的过程质控品,是监控假阴性结果的一种简便有效的方法。
| [1] | Vermehren J, Kau A, Gärtner BC, et al. Differences between two real-time PCR-based hepatitis C virus(HCV)assays(RealTime HCV and Cobas AmpliPrep/Cobas TaqMan)and one signal amplification assay(Versant HCV RNA 3.0)for RNA detection and quantification[J]. J Clin Microbiol, 2008, 46(121) : 3880–3891. |
| [2] | Mikel P, Vasickova P, Kralik P. Methods for preparation of MS2 phage-like particles and their utilization as process control viruses in RT-PCR and qRT-PCR detection of RNA viruses from food matrices and clinical specimens[J]. Food Environ Virol, 2015, 7(2) : 96–111. DOI:10.1007/s12560-015-9188-2 |
| [3] | 凌振静, 张朝武. MS2噬菌体宿主范围及其相关特性的初步研究[J]. 现代预防医学, 2009, 36(14) : 2725–2727. |
| [4] | 中华人民共和国卫生部.消毒技术规范(2002年版)[S].北京:中华人民共和国卫生部,2002. |
| [5] | International Organization for Standardization.ISO/TS 1526-2,2013.Horizontal method for determination of hepatitis A virus and norovirus in food using real-time RT-PCR part 2:Method for quanlitative detection.First edtion,corrected version[S].Geneva:International Organization for Standardization,2013. |
| [6] | 中华人民共和国国家质量监督检验检疫总局.SN/T 2519-2010贝类中星状病毒检测方法普通PCR和实时荧光PCR方法[S].北京:中华人民共和国国家质量监督检验检疫总局,2010. |
| [7] | Scallan E, Hoekstra RM, Angulo FJ, et al. Foodborne illness acquired in the United States-major pathogens[J]. Emerg Infect Dis, 2011, 17(1) : 7–15. DOI:10.3201/eid1701.P11101 |
| [8] | 龚智翔.上海地区儿童病毒性腹泻分子流行病学研究[D].上海:第二军医大学博士学位论文,2010. |
| [9] | Parashar UD, Burton A, Lanata C, et al. Global mortality associated with rotavirus disease among children in 2004[J]. J Infect Dis, 2009, 200(Suppl 1) : S9–15. |
| [10] | Naghipour M, Nakagomi T, Nakagomi O. Issues with reducing the rotavirus-associated mortality by vaccination in developing countries[J]. Vaccine, 2008, 26(26) : 3236–3241. DOI:10.1016/j.vaccine.2008.04.004 |
| [11] | Blanton LH, Adams SM, Beard RS, et al. Molecular and epidemiologic trends of caliciviruses associated with outbreaks of acute gastroenteritis in the United States,2000-2004[J]. J Infect Dis, 2006, 193(3) : 413–421. DOI:10.1086/jid.2006.193.issue-3 |
| [12] | Pativada M, Nataraju SM, Ganesh B, et al. Emerging trends in the epidemiology of human astrovirus infection among infants,children and adults hospitalized with acute watery diarrhea in Kolkata,India[J]. Infect Genet Evol, 2012, 12(8) : 1685–1693. DOI:10.1016/j.meegid.2012.07.018 |
| [13] | International Organization for Standardization.ISO/TS 1526-1,2013.Micorobiology of food and animal feed-horizontal method for determination of hepatitis A cirus and norovirus in food using real-time RT-PCR part 1:Method for quantification.First edition,corrected version[S].Geneva:International Organization for Standardization,2013. |
| [14] | Costafreda MI, Bosch A, Pintó RM. Development,evaluation,and standardization of a real-time TaqMan reverse transcription-PCR assay for quantification of hepatitis A virus in clinical and shellfish samples[J]. Appl Environ Microbiol, 2006, 72(6) : 3846–3855. DOI:10.1128/AEM.02660-05 |
| [15] | Le Guyader FS, Parnaudeau S, Schaeffer J, et al. Detection and quantification of noroviruses in shellfish[J]. Appl Environ Microbiol, 2009, 75(3) : 618–624. DOI:10.1128/AEM.01507-08 |
| [16] | Butot S, Zuber S, Baert L. Sample preparation prior to molecular amplification:complexities and opportunities[J]. Curr Opin Virol, 2014, 4 : 66–70. DOI:10.1016/j.coviro.2013.12.004 |
| [17] | Martin LR, Duke GM, Osorio JE. Mutational analysis of the mengovirus poly(C)tract and surrounding heteropolymeric sequences[J]. J Virol, 1996, 70(3) : 2027–2031. |
| [18] | Coudray C, Merle G, Martin-Latil S, et al. Comparison of two extraction methods for the detection of hepatitis A virus in lettuces using the murine norovirus as a process control[J]. J Virol Methods, 2013, 193(1) : 96–102. DOI:10.1016/j.jviromet.2013.05.003 |
| [19] | Hennechart-Collette C, Martin-Latil S, Guillier L, et al. Multiplex real-time RT-qPCR for the detection of norovirus in bottled and tap water using murine norovirus as a process control[J]. J Appl Microbiol, 2014, 116(1) : 179–190. DOI:10.1111/jam.2013.116.issue-1 |
| [20] | Martin-Latil S, Hennechart-Collette C, Guillier L, et al. Duplex RT-qPCR for the detection of hepatitis E virus in water,using a process control[J]. Int J Food Microbiol, 2012, 157(2) : 167–173. DOI:10.1016/j.ijfoodmicro.2012.05.001 |
| [21] | Di Pasquale S, Paniconi M, Auricchio B, et al. Comparison of different concentration methods for the detection of hepatitis A virus and calicivirus from bottled natural mineral waters[J]. J Virol Methods, 2010, 165(1) : 57–63. DOI:10.1016/j.jviromet.2010.01.003 |
| [22] | Mattison K, Brassard J, Gagné MJ, et al. The feline calicivirus as a sample process control for the detection of food and waterborne RNA viruses[J]. Int J Food Microbiol, 2009, 132(1) : 73–77. DOI:10.1016/j.ijfoodmicro.2009.04.002 |
| [23] | Coyne KP, Christley RM, Pybus OG, et al. Large-scale spatial and temporal genetic diversity of feline calicivirus[J]. J Virol, 2012, 86(20) : 11356–11367. DOI:10.1128/JVI.00701-12 |
| [24] | 孙士鹏, 刘贵建. MS2噬菌体衣壳蛋白与包装位点结合特异性及其生物学应用进展[J]. 生物技术通讯, 2014, 25(2) : 259–262. |
| [25] | Blaise-Boisseau S, Hennechart-Collette C, Guillier L, et al. Duplex real-time qRT-PCR for the detection of hepatitis A virus in water and raspberries using the MS2 bacteriophage as a process control[J]. J Virol Methods, 2010, 166(1-2) : 48–53. DOI:10.1016/j.jviromet.2010.02.017 |
| [26] | Rolfe KJ, Parmar S, Mururi D, et al. An internally controlled,one-step,real-time RT-PCR assay for norovirus detection and genogrouping[J]. J Clin Virol, 2007, 39(4) : 318–321. DOI:10.1016/j.jcv.2007.05.005 |
| [27] | Shulman LM, Hindiyeh M, Muhsen K, et al. Evaluation of four different systems for extraction of RNA from stool suspensions using MS-2 coliphage as an exogenous control for RT-PCR inhibition[J]. PLoS One, 2012, 7(7) : e39455. DOI:10.1371/journal.pone.0039455 |
 2016, Vol. 32
2016, Vol. 32


