2. 东莞市环境医学重点实验室, 广东 东莞 523808
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是一种患者无过量饮酒史,以肝实质细胞脂肪变性和脂质贮积为主要特征的临床病理综合征,病程包括单纯性脂肪肝、脂肪性肝炎(non-alcoholic steatohepatitis,NASH)、脂肪性肝纤维化和肝硬化。其中,肝纤维化是NAFLD发展成为肝硬化的关键环节。近年来,随着病理学和分子生物学的不断发展,研究者普遍认为NAFLD纤维化是慢性肝损伤过程中多种细胞密切联系、相互作用的结果;其中肝星状细胞(hepatic stellate cells,HSC)在组织炎症部位的活化过程是核心环节,并明确提出调控HSC活化可逆转肝纤维化的新观点[1]。虾青素(astaxanthin,AST),化学名称3,3′-二羟基-4,4′-二酮基-β,β′-胡萝卜素,是一种非维生素A原的类胡萝卜素,广泛分布于雨生红球藻、虾、蟹和三文鱼等生物体内[2-4]。研究表明,虾青素具有抗氧化、抗炎、预防心血管疾病和保护肝脏等多种生物活性[5-8]。本研究通过观察磷脂酰肌醇3-激酶/蛋白激酶B(phosphatidylinositol 3-kinase/protein kinase B,PI3K/Akt)信号通路在虾青素调节人肝星状细胞(LX-2细胞)活化中的作用,旨在探讨虾青素抗NAFLD纤维化的效应与机制,结果报告如下。
1 材料与方法 1.1 主要试剂与仪器虾青素(纯度≥95%,德国Dr.Ehrenstorfer公司);LX-2细胞(中南大学湘雅中心实验室细胞库);Dulbecco′s modified Eagle medium(DMEM)高糖培养基、胎牛血清、0.25%胰蛋白酶-ethylene diamine tetraacetic acid(EDTA)溶液(美国Gibco公司);噻唑兰、二甲基亚砜、Trizol(美国Sigma公司);LY294002(PI3K特异性抑制剂)、BCA蛋白浓度测定试剂盒(江苏碧云天生物技术研究所);PCR引物(上海生工公司);逆转录及荧光定量PCR试剂盒(日本TaKaRa公司);兔抗人Akt及p-Akt抗体(美国CST公司)。细胞培养箱(美国Thermo公司);全自动细胞计数仪(美国Beckman公司);实时荧光定量PCR仪(美国ABI公司);电泳仪(美国Bio-Rad公司)。
1.2 细胞培养将LX-2细胞用含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的DMEM高糖培养基,置于37 ℃、5%CO2培养箱中培养,当细胞处于对数生长期时,用0.25%胰蛋白酶-EDTA溶液消化,然后接种至6孔板培养,每孔1.0×105个细胞。
1.3 分组与处理(1)待细胞生长融合至70%左右,换无血清培养基培养过夜,实验设对照组和虾青素低、中、高剂量组(虾青素终浓度分别为5、10、20 μmol/L),继续培养48 h后收集细胞,检测细胞活性、细胞内α-smooth muscle actin(α-SMA)和col1a1 mRNA表达水平;每组设3个复孔。(2)将细胞随机分为对照组、抑制剂组(25 μmol/L LY294002)、抑制剂+虾青素组(25 μmol/L LY294002+20 μmol/L虾青素)、虾青素组(20 μmol/L),培养48 h后,检测各组细胞Akt及其磷酸化水平、α-平滑肌肌动蛋白(α-SMA)和Ⅰ型胶原(collagenⅠ,col1a1)mRNA表达水平;每组设3个复孔。
1.4 指标与方法 1.4.1 细胞活性测定LX-2细胞以1.0×104个/孔接种96孔板培养24 h,加入低、中、高剂量虾青素继续培养24 h。弃上清,每孔加180 μL DMEM培养基和20 μL噻唑兰溶液(5 mg/mL)培养4 h;弃上清,每孔加200 μL二甲基亚砜,充分溶解测定570 nm吸光度值。
1.4.2 LX-2细胞中α-SMA、col1a1 mRNA表达检测采用荧光定量PCR法,Trizol法提取总RNA,cDNA第一链合成参照试剂盒说明书进行;采用Primers 5.0软件设计引物序列,引物由上海生工公司合成,β-actin为内参(编号PHS02),α-SMA上游引物:5′-GAG TTA CGA GTT GCC TGA TGG-3′,下游引物:5′-GAT GCT GTT GTA GGT GGT TTC A-3′;col1a1上游引物:5′-CCT GGA AAG AAT GGA GAT GAT G-3′,下游引物:5′-CCA AAC CAC TGA AAC CTC TGT-3′。反应条件:95 ℃ 10 min;95 ℃ 15 s,60 ℃ 1 min,共40个循环;熔解曲线温度60 ℃;以β-actin为内参基因,根据2-△△Ct法计算基因表达的相对量。
1.4.3 LX-2细胞中Akt与p-Akt蛋白表达检测采用蛋白印迹(Western blot,WB)法,按照试剂盒说明书提取LX-2细胞总蛋白,调整浓度并取40 μg蛋白聚丙烯酰胺凝胶电泳和转膜后,5%脱脂牛奶室温封闭2 h;用兔抗人Akt(1:1 000)和p-Akt抗体(1:1 000)4 ℃孵育过夜,加入辣根过氧化物酶标记的山羊抗兔抗体(1:2 000)室温孵育1 h;对条带进行曝光,采用Quantity One软件对条带灰度值进行分析。
1.5 统计分析数据以x±s表示,采用SPSS 19.0软件建立数据库并进行统计分析,组间比较采用单因素方差分析,组间两两比较采用最小显著差法,P<0.05表示差异有统计学意义。
2 结 果 2.1 虾青素对LX-2细胞活性影响结果显示,对照组、虾青素低、中、高剂量组LX-2细胞活性(吸光度值)分别为(1.117±0.021)、(1.142±0.031)、(1.089±0.024)、(1.065±0.032);与对照组比较,虾青素各剂量组LX-2细胞活性无明显变化(P>0.05)。
2.2 虾青素对LX-2细胞α-SMA和col1a1mRNA表达影响(表 1) 与对照组比较,各剂量虾青素组LX-2细胞中α-SMA mRNA表达水平均明显下降(P<0.05);与对照组比较,10、20 μmol/L虾青素组LX-2细胞中col1a1 mRNA表达水平均明显下降(P<0.05)。
| 表 1 虾青素对LX-2细胞α-SMA和col1a1 mRNA表达影响(x±s=3) |
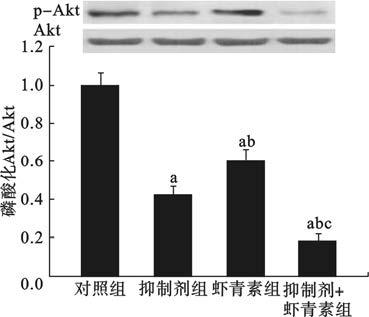
2.3 虾青素对LX-2细胞PI3K/Akt信号通路影响(图 1)
结果显示,对照组、抑制剂组、虾青素组、抑制剂+虾青素组LX-2细胞p-Akt表达水平分别为(1.00±0.06)、(0.42±0.05)、(0.60±0.07)、(0.18±0.04);与对照组比较,抑制剂组、虾青素组、抑制剂+虾青素组LX-2细胞p-Akt表达水平均明显降低(P<0.05);与抑制剂组比较,抑制剂+虾青素组LX-2细胞p-Akt表达水平明显降低(P<0.05)。
|
注:与对照组比较,a P<0.05;与抑制剂组比较,b P<0.05;与虾青素组比较,c P<0.05。 图 1 虾青素对PI3K/Akt信号通路影响 |
2.4 虾青素与抑制剂对LX-2细胞α-SMA和col1a1 mRNA表达影响(表 2)
结果显示,与对照组比较,抑制剂组、虾青素组、抑制剂+虾青素组LX-2细胞中α-SMA和col1a1 mRNA表达水平均明显下降(P<0.05);与抑制剂组比较,抑制剂+虾青素组LX-2细胞中α-SMA和col1a1 mRNA表达水平均明显下降(P<0.05)。
| 表 2 虾青素与抑制剂对LX-2细胞α-SMA和col1a1 mRNA表达影响(x±s=3) |
3 讨 论
HSC是肝间质细胞中兼有肌细胞、成纤维细胞及脂肪细胞性质的一种细胞,约占肝细胞总数5%~8%;位于肝血窦内皮细胞与肝细胞之间的Disse间隙内,包绕于肝窦外,突起与内皮细胞和肝细胞表面接触,胞质内富含维生素A脂滴。当肝脏受到化学毒害、氧化应激或炎症因子等因素刺激时,HSC增殖并激活,以胞体增大、胞突伸长、维生素A脂滴减少或消失、粗面内质网增加、高尔基体发达、转化为肌成纤维细胞(myofibrbolast,MFB)、表达α-SMA、合成大量细胞外基质(extracellular matrix,ECM)等为特征[1]。因此,α-SMA和col1a1是HSC活化的标志物。Yang等[9]研究发现,虾青素可抑制转化生长因子β1(transforming growth factor β1,TGFβ1)诱导的HSC分泌α-SMA、col1a1和TGFβ1,并呈剂量和时间依赖关系。本研究结果显示,5、10、20 μmol/L虾青素均可降低α-SMA和col1a1 mRNA表达水平,抑制LX-2细胞的活化进程。
PI3K/Akt信号通路是近年来研究较多的一个生长因子信号传导途径,越来越多证据表明Akt与细胞的生长、凋亡等密切相关。当细胞受到外来信号刺激后,PI3K活化生成3位磷酸化的磷脂产物,该产物引起Akt与膜结合,在磷脂酰肌醇依赖的蛋白激酶(phosphatidylinositol-dependent protein kinase,PDK)作用下Akt发生磷酸化,活化的Akt离开细胞膜进入细胞质和细胞核,使其下游分子发生磷酸化,从而调节细胞的生长与代谢[10]。研究发现,PI3K/Akt信号通路在HSC的活化、增殖和胶原合成中发挥重要作用[11]。该通路一旦被激活,活化的Akt使叉头转录因子O1(forkhead box O1,FoxO1)的3个保守磷酸化位点发生磷酸化,从而促使FoxO1由细胞核转运至细胞质,导致其转录活性下调,从而抑制FoxO1所调控的下游基因表达[12],而FoxO1的转录活性决定了HSC由静止性表型向肌原性表型的转化[13]。LY294002是一种常用的PI3K抑制剂,能够阻断PI3K/Akt细胞信号传导通路[14]。本研究结果显示,经LY294002处理后,LX-2细胞Akt磷酸化、α-SMA和col1a1的mRNA表达均明显降低;虾青素干预后,LX-2细胞Akt磷酸化水平降低,且α-SMA和col1a1 mRNA表达进一步下降。这与已有研究结果基本一致[15]。提示,虾青素可通过PI3K/Akt信号通路抑制HSC细胞活化,进而发挥抗非酒精性脂肪肝纤维化作用。
| [1] | Kisseleva T, Brenner DA. Role of hepatic stellate cells in fibrogenesis and the reversal of fibrosis[J]. J Gastroenterol Hepatol, 2007, 22(Suppl 1) : S73–78. |
| [2] | Zou TB, Jia Q, Li HW, et al. Response surface methodology for ultrasound-assisted extraction of astaxanthin from Haematococcus pluvialis[J]. Mar Drugs, 2013, 11(5) : 1644–1655. DOI:10.3390/md11051644 |
| [3] | Alesci A, Salvo A, Lauriano ER, et al. Production and extraction of astaxanthin from Phaffia rhodozyma and its biological effect on alcohol-induced renal hypoxia in Carassius auratus[J]. Nat Prod Res, 2015, 29(12) : 1122–1126. DOI:10.1080/14786419.2014.979417 |
| [4] | Ambati RR, Phang SM, Ravi S, et al. Astaxanthin:sources,extraction,stability,biological activities and its commercial applications-a review[J]. Mar Drugs, 2014, 12(1) : 128–152. DOI:10.3390/md12010128 |
| [5] | Park JS, Chyun JH, Kim YK, et al. Astaxanthin decreased oxidative stress and inflammation and enhanced immune response in humans[J]. Nutr Metab, 2010, 7 : 18. DOI:10.1186/1743-7075-7-18 |
| [6] | Fassett RG, Coombes JS. Astaxanthin:a potential therapeutic agent in cardiovascular disease[J]. Mar Drugs, 2011, 9(3) : 447–465. |
| [7] | Turkez H, Geyikoglu F, Yousef MI. Beneficial effect of astaxanthin on 2,3,7,8-tetrachlorodibenzo-p-dioxin-induced liver injury in rats[J]. Toxicol Ind Health, 2013, 29(7) : 591–599. DOI:10.1177/0748233711434959 |
| [8] | 邹堂斌, 黄明元, 冼叶明, 等. 虾青素抑制MCD饮食诱导的小鼠非酒精性脂肪肝纤维化[J]. 现代预防医学, 2016, 43(4) : 700–703. |
| [9] | Yang Y, Kim B, Park YK, et al. Astaxanthin prevents TGFβ1-induced pro-fibrogenic gene expression by inhibiting Smad3 activation in hepatic stellate cells[J]. Biochim Biophys Acta, 2015, 1850(1) : 178–185. DOI:10.1016/j.bbagen.2014.10.014 |
| [10] | Piguet AC, Dufour JF. PI(3)K/PTEN/AKT pathway[J]. J Hepatol, 2011, 54(6) : 1317–1319. DOI:10.1016/j.jhep.2010.12.013 |
| [11] | Uyama N, Iimuro Y, Kawada N, et al. Fascin,a novel marker of human hepatic stellate cells,may regulate their proliferation,migration,and collagen gene expression through the FAK-PI3K-Akt pathway[J]. Lab Invest, 2012, 92(1) : 57–71. DOI:10.1038/labinvest.2011.150 |
| [12] | Kim DH, Kim JM, Lee EK, et al. Modulation of FoxO1 phosphorylation/acetylation by baicalin during aging[J]. J Nutr Biochem, 2012, 23(10) : 1277–1284. DOI:10.1016/j.jnutbio.2011.07.008 |
| [13] | Adachi M, Osawa Y, Uchinami H, et al. The forkhead transcription factor FoxO1 regulates proliferation and transdifferentiation of hepatic stellate cells[J]. Gastroenterology, 2007, 132(4) : 1434–1446. DOI:10.1053/j.gastro.2007.01.033 |
| [14] | Tong Y, Zhu W, Huang X, et al. PI3K inhibitor LY294002 inhibits activation of the Akt/mTOR pathway induced by an oncolytic adenovirus expressing TRAIL and sensitizes multiple myeloma cells to the oncolytic virus[J]. Oncol Rep, 2014, 31(4) : 1581–1588. |
| [15] | Jia YY, Wu CY, Kim JY, et al. Astaxanthin reduces hepatic lipid accumulations in high-fat-fed C57BL/6J mice via activation of peroxisome proliferator-activated receptor(PPAR)alpha and inhibition of PPAR gamma and Akt[J]. J Nutr Biochem, 2016, 28 : 9–18. DOI:10.1016/j.jnutbio.2015.09.015 |
 2016, Vol. 32
2016, Vol. 32


