诺如病毒(novovirus,NV)是全世界范围内引起人类急性胃肠炎的最重要的病原之一[1],据统计在2000年7月—2004年6月美国发生的急性胃肠炎爆发疫情中,约80%与诺如病毒有关[2]。目前对于NV的重要传播途径环境水体研究投入不足,主要是因为环境水体中病毒粒子量极低,不通过对水体中病毒粒子的浓缩,无法直接检测到病毒。能否从大量水体中极其微量,但却足以使人发病的病毒粒子进行有效的浓缩,成为水体病毒检测的主要工作。本研究尝试采用微生物纯化膜过滤系统吸附待检测水体中病毒粒子,后结合PEG6000 2次浓缩初步建立一套具有快速、高灵敏度的检测方法。现将结果报告如下。
1 材料与方法 1.1 材料 1.1.1 阳性粪便标本诺如病毒便样标本(国家病毒性腹泻网络实验室哈尔滨疾病预防控制中心病毒科提供)[经reverse transcription(RT)-PCR和测序鉴定为阳性]用pH7.2 phosphate buffered saline(PBS)稀释成10%的病毒悬液后,1000 r/min离心,上清分装每管1 mL,-70 ℃保存备用。
1.1.2 主要仪器与试剂7 500荧光定量PCR仪(美国ABI公司)、微生物纯化系统(上海华旦公司)、RNA提取试剂盒、OneStepRT-PCR Kit、QuantiTectprobe RT-PCR Kit(美国Qiagen公司)、载体pMD18-T、感受态DH5α(大连TaKaRa公司)、PEG6000、PBS(北京索莱宝公司)。
1.1.3 引物根据GII NV保守序列设计标准品质粒引物,上游引物(NV-SF),F:5′-CAA GAG CCA ATG TTC AGA TGG ATG-3′、下游引物(NV-SR),F:5′-CCA CCT GCA TAA CCA TTG TAC AT-3′。荧光PCR引物Cog-2F/ Cog-2R及探针根据Kageyama[3]报道合成,引物及探针由大连TaKaRa公司合成。
1.2 方法 1.2.1 病毒RNA提取及标准品质粒的构建取200 μL病毒悬液参照Qiagen RNA提取试剂盒进行病毒总RNA的提取。RNA经一步法反转录PCR进行目的片段的扩增,反应体系为:Onestep5×buffer 5 μL,dNTP mixture 1 μL,NV-SF、NV-SR(10 mmol)引物各1 μL,OneStep RT-PCR enzyme 1 μL,RNase inhibitor 0.5 μL,模板 2 μL,去RNA酶纯水调至总体积25 μL。PCR条件:50 ℃反转录30 min,95 ℃预变性15 min,94 ℃变性1 min,55 ℃退火30 s,72 ℃延伸1 min,30个循环后72 ℃延伸10 min。PCR产物经1%凝胶琼脂鉴定后,切胶纯化目的片段,纯化后的目的片段与pMD18-T载体连接,连接产物转化感受态DH5α。挑取白色单个菌落,碱裂解法提取质粒,质粒命名为T-NVS,-20 ℃保存备用。
1.2.2 绝对定量realtime-PCR条件优化和标准曲线的制作紫外分光光度计测量质粒T-NVS吸光值和浓度,根据质粒分子量及阿伏伽德罗常数计算出拷贝数。按照拷贝数量级,将T-NVS进行倍比稀释,稀释9个梯度,分别以10-1~10-9 copies/μL作为模板。将不同稀释度的质粒进行荧光定量PCR,制备标准曲线,反应体系为:Master mix 12.5 μL,Cog-2F/Cog-2R(10 mmol)各1 μL,探针0.5 μL(5 mmol),enzyme mix 0.25 μL,模板2.5 μL,去RNA酶纯水调至总体积25 μL。PCR条件:50 ℃ 20 min,95 ℃ 15 min,(94 ℃ 45 s,60 ℃ 45 s),40个循环反应,60 ℃收集荧光信号。反应结束后,根据CT值调整基线,绘制扩增曲线和标准曲线。
1.2.3 水体的浓缩富集与回收使用ABI7500 System SDS 软件分析检测结果并计算出病毒浓度。病毒回收率计算参照公式[4]:病毒回收率=回收后病毒拷贝数/回收前病毒拷贝数×100%=(浓缩后水的体积×病毒浓度)/(浓缩前水的体积×病毒浓度)。取1 mL10%病毒悬液原液,加入纯净水,10倍梯度稀释10-1~10-5倍,水样中加入1 mol/L的盐酸调节pH至3.5,再加入1 mol/L的MgCl2溶液配置成模拟染毒水样。将稀释后的水匀速通过装有混合醋酸纤维膜的微生物抽滤装置系统,过滤后将膜放入5 mL含0.05 mol/L甘氨酸的1.5%牛肉膏洗脱液(pH9.0) 洗脱30 min,收集洗脱液加入含量20%PEG 6000,搅拌溶解4 ℃过夜,离心机4 ℃ 10 000 rpm 离心30 min,弃上清,沉淀用0.5 mL pH7.2 PBS混匀溶解。
1.2.4 荧光定量RT-PCR检测取300 μL沉淀溶解液,Qiagen RNA提取试剂盒进行病毒总RNA的提取,用条件优化的荧光定量RT-PCR 检测病毒。
2 结果 2.1 构建质粒目的基因的扩增(图 1)RT-PCR 反应后,经1%凝胶琼脂检测,得到大小为387 bp的片段,与预期结果相符。
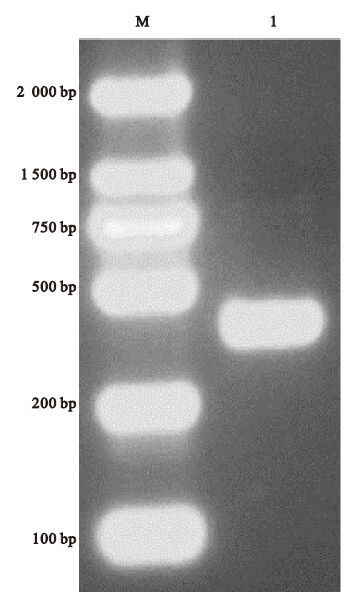
|
注:M:marker DL 2000, 1:目的片段 图 1 RT-PCR 扩增结果 |
2.2 绝对定量realtime-PCR条件优化和标准曲线的制作
根据阿伏伽德罗常数计算出质粒拷贝数,计算参照公式拷贝数(copies/μL)=6.02×1023×质粒浓度(ng/μL)/碱基长度×660。梯度稀释的T-NVS质粒标准品经ABI7500荧光PCR扩增后,呈现良好的S型扩增曲线。荧光信号分析显示,CT值与核酸浓度之间呈现良好的线性关系,标准曲线线性相关系数98%,浓度10 copies/μL的质粒没有S型扩增,故经条件优化后realtime RT-PCR 最低检测灵敏度为100 copies/μL。
2.3 富集水样realtime-PCR检测不同倍数稀释的模拟水样经2次富集浓缩后,提取病毒核酸,经realtime PCR检测,结果显示10-1~10-3这3个稀释度扩增出良好的S型曲线可以检测到病毒存在,10-4、10-5稀释度无扩增曲线。
2.4 病毒浓缩的回收率(表 1)随着模拟水样病毒稀释度的增加,病毒浓度的下降,回收率呈下降趋势,当样品稀释到10-4即病毒浓度为10 copies/μL,不能检测出病毒的存在,符合最低检测灵敏度。
| 表 1 模拟水样病毒回收率 |
3 讨论
水是人类生活及健康和生态系统的生命,是各国发展的基本需求,但近年来,国内外已有大量报道从饮用水、地表水及各级污水中检出肠道病毒诺、诺如病毒和轮状病毒[5-6]。对诺如病毒引起的胃肠炎流行病事件的原因进行分析表明,在中国诺如病毒胃肠炎爆发事件中,食品占38.9%,水源污染占22.2%,生活接触占16.7%,可见水体中病毒检测的重要性与紧迫性[7]。尽管诺如病毒已经发现30多年,但目前尚不能进行诺如病毒的体外培养,也缺乏相应的动物模型,暂时无理想的浓缩水中病毒的方法。通常对水环境中病毒进行浓缩的方法有膜过滤洗脱法、絮凝沉淀法、免疫法和超滤法等。寇小霞等[8]利用三氯化铝沉淀法和正电荷膜法浓缩回收自来水和污水两种不同的水体环境中病毒,结果认为该方法在两种水体中的回收率均较高,最高回收率可达到96%和92%。叶晓艳等[9]利用新型正电NanoCeram滤芯首次在国内将此滤芯应用于实际水样病毒的浓缩,并且取得良好的效果。但正电荷的过滤膜价格昂贵,在常规病毒监测中如果一次性使用会成本太高,限制它的使用[10]。本实验设计采用混合纤维素膜,其价格成本不高,易于购买,采用纤维素膜对水样病毒浓缩的研究也较多,与其它病毒浓缩方法进行了比较,发现其对肠道病毒的浓缩效果较好[11-12]。但由于膜的孔径较小,浊度和混合杂物会影响病毒的回收效率。梁莎等[13]发现采用便样悬浮液直接接种水体后,病毒丢失严重,认为其原因是病毒粒子结成团块所致,导致病毒回收率不稳定,所以本实验选择将粪便标本低速离心,选择病毒上清液,这样会一定程度减少水样浊度并提高病毒回收率及稳定性。目前文献报道的混合纤维素膜的病毒回收率差异较大,可从7%跨越到100%[12]。本方法经2次病毒富集后,检测发现病毒回收率为5.75%~23.47%,与文献报道存在差异,这是由于病毒的浓度、水样体积及质量、pH值、洗脱液种类、实验室的方法不同等都可以影响水中病毒的回收率。
| [1] | 王毅谦, 石晶, 吴福平, 等. GI和GII型诺如病毒双重荧光RT-PCR法监测[J]. 中国公共卫生 , 2013, 29 (4) : 599–602. |
| [2] | Blanton LH, Adams SM, Beard RS, et al. Molecular and epidemiologic trends of caliciviruses associated with outbreaks of acute gastroenteritis in the United States 2000-2004[J]. J Infect Dis , 2006, 193 (3) : 413–421. DOI:10.1086/jid.2006.193.issue-3 |
| [3] | Kageyama T, Shigeyuki K, Shinohara M. Broadly reactive and-highly sensitive assay for norwalk-like viruses based on real-time quantitative reverse transcription-PCR[J]. J Clin Microbiol , 2003, 41 (3) : 1548–1557. |
| [4] | 周晓红, 李晖, 杨杏芳, 等. 水中诺如病毒富集及定量检测研究[J]. 热带医学杂志 , 2010, 10 (2) : 137–140. |
| [5] | Karim MR, Pontius FW, LeChevallier MW. Detection of noroviruses in water-summary of an international workshop[J]. J Infect D is , 2004, 189 (1) : 21–28. DOI:10.1086/jid.2004.189.issue-1 |
| [6] | 肖锦晖, 雷蕾, 余光请, 等. 水及水产品诺如病毒快速检测技术研究[J]. 中国卫生检验杂志 , 2010, 20 (6) : 1324–1328. |
| [7] | 寇晓霞, 吴清平, 薛亮. 水源性诺如病毒[J]. 微生物学通报 , 2012, 39 (4) : 536–543. |
| [8] | 寇晓霞, 吴清平, 姚琳, 等. 水体中病毒浓缩方法及其条件优化[J]. 微生物学通报 , 2009, 36 (1) : 25–30. |
| [9] | 叶晓艳.引用水中病毒浓缩及检测方法的研究和应用[D].武汉:华中科技大学,2012. |
| [10] | 杨振兴. 水样中病毒浓缩和回收[J]. 现代预防医学 , 2011, 38 (22) : 4732–4739. |
| [11] | Haramoto E, Katayama H, Utagawa E. Recovery of human norovirus from water by virus concentration methods[J]. J Virol Methods , 2009, 160 (1-2) : 206–209. DOI:10.1016/j.jviromet.2009.05.002 |
| [12] | Hsu BM, Chen CH, Kung CM, et al. Evaluation of entervirus recovery in surface water by different adsorption and elution procedures[J]. Chemosphere , 2007, 66 (5) : 964–969. DOI:10.1016/j.chemosphere.2006.06.054 |
| [13] | 梁莎, 谢广成, 徐子乾, 等. 环境水体中GII型诺如病毒浓缩研究[J]. 病毒学报 , 2011, 27 (1) : 58–63. |
 2016, Vol. 32
2016, Vol. 32


