妊娠作为一种特殊的生理状态,可导致生理变化和血流动力学的改变,据报道,妊娠期静脉血栓的发生率为非妊娠者的4~5倍,而目前对妊娠期静脉血栓病因研究尚未引起足够的重视[1-2]。肺腺癌转移相关转录本1(metastasis-associated lung adenocarcinoma transcript 1,MALAT1),全长6.7kb,为长链非编码RNA( long non-coding RNA,lncRNA)的重要成员,普遍表达于人类和鼠组织细胞中,尤其在神经系统突出[3]。有研究表明,抑制食管鳞状细胞癌细胞MALAT1的表达可有效抑制其增殖并诱导凋亡[4]。内皮细胞的凋亡,可以促进血小板的粘附和血栓的形成,这可能是引起静脉血栓的一个重要原因,因此MALAT1可能会通过促进内皮细胞增殖和凋亡参与妊娠期静脉血栓的形成。本研究通过观察lncRNA MALAT1对人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)增殖和凋亡的影响,旨在为妊娠期静脉血栓的诊治提供理论依据。
1 材料与方法 1.1 主要试剂与仪器Roswell Park Memorial Institute medium (RPMI)培养基(美国Hyclone公司);Lipofectamine 2000转染试剂(美国Invitrogen公司);CCK8试剂盒和annexin Ⅴ-fluorescein isothiocyanate/propidium iodide (FITC/PI)双染凋亡试剂盒(中国凯基公司);RNA提取试剂盒、反转录试剂盒和SYBR实时荧光定量PCR(qRT-PCR)试剂盒(日本TAKARA公司;(型号:TP950 96孔实时荧光定量PCR仪)。Thermo Multiskan FC酶联免疫检测仪(美国Thermo公司);FACSCalibur流式细胞仪(美国BD公司)。
1.2 HUVEC细胞培养与转染人脐静脉内皮细胞系(HUVEC)购自中国科学院上海生命科学研究院细胞资源中心,置于37 ℃、5% CO2培养,培养液为含10%胎牛血清的RPMI 1640培养基,适时换液传代。由上海吉凯公司代为合成MALAT1-RNA interference (RNAi)质粒载体和阴性对照,按照Lipofectamine 2000操作说明进行转染HUVEC细胞,转染8 h后更换培养基继续培养至48 h。MALAT1-RNAi-a:GATCCCGGGCTTCTCTTAACATTT-ACTCGAGTAAATGTTAAGAGAAGCCCTTTTTG-GAT;MALAT1-RNAi-b:AGCTATCCAAAAAGGG-CTTCTCTTAACATTTACTCGAGTAAATGTTAAG-AGAAGCCCGG。
1.3 qRT-PCR法检测HUVEC细胞MALAT1表达收集各组细胞,根据Traziol法提取总mRNA。反转录条件是:37 ℃ 15 min;85 ℃ 5 s。按说明书要求扩增体系为:SYBR Premix EaqTMII(2×) 为12.5 μL;PCR 正向引物(10 μmol)为 1 μL;PCR 反向引物(10 μmol) 为1μL;模板cDNA为 2 μL;加灭菌蒸馏水调整至总体积为25 μL。实时定量PCR扩增反应条件为:95 ℃ 30 s 1个循环,95 ℃ 5 s、60 ℃ 30 s,40个循环;95 ℃ 15 s、60 ℃ 30 s,1个循环。MALAT1上游引物为5′-CAAGGTCGGGCAGGAAGAG-3′,下游引物为5′-TAATACGACTCACTATAGGG-3′。
1.4 CCK8法检测HUVEC细胞增殖能力调整各组HUVEC细胞浓度为1×104/mL,接种于96孔板,100 μL/孔;继续于37 ℃、5%CO2孵育箱中培养,培养24、48、72 h后应用CCK8法检测HUVEC细胞的增殖能力,再加入10 μL CCK8继续培养4 h后,用酶联免疫检测仪测定波长为490 nm吸光度(A)值。
1.5 Annexin Ⅴ-FITC/PI双染流式细胞术检测HUVEC细胞凋亡收集细胞后,调整各组细胞浓度到1×106/mL,再用冷磷酸盐缓冲液吹打并离心,缓冲液重悬后取细胞悬液500 μL,加入annexin Ⅴ-FITC 5 μL和PI 5 μL,4 ℃避光孵育30 min,应用流式细胞仪进行检测。
1.6 统计分析应用SPSS 13.0软件进行统计分析,计量资料多组件比较采用房产分析,两两比较采用t检验,以P<0.05为差异有统计学意义。
2 结果 2.1 不同组别HUVEC中MALAT1表达量比较qRT-PCR法检测结果显示,空白细胞对照组人脐静脉内皮细胞HUVEC中MALAT1的表达量为相对值1,阴性对照组相对表达量为(1.03±0.05),MALAT1-RNAi转染组相对表达量为(0.51±0.03)。不同组别比较,MALAT1-RNAi转染组MALAT1相对表达量均低于空白细胞对照组和阴性对照组,差异均有统计学意义(均P<0.01);阴性对照组与空白细胞对照组差异无统计学意义(P>0.05)。
2.2 MALAT1对人脐静脉内皮细胞HUVEC增殖的影响(表 1)CCK8检测结果显示,空白细胞对照组、阴性对照组和MALAT1-RNAi转染组培养24 h,3组吸光度(A)值差异无统计学意义(P>0.05);MALAT1-RNAi转染组培养48和72 h 的吸光度(A)值均低于空白细胞对照组和阴性对照 组,差异均有统计学意义(均P<0.05),而阴性对照组与空白细胞对照组差异均无统计学意义(均P>0.05)。
| 表 1 不同组别不同培养时间人脐静脉内皮细胞HUVEC吸光度(A)值比较 |
2.3 MALAT1对人脐静脉内皮细胞HUVEC凋亡的影响(图 1)
Annexin Ⅴ-FITC/PI双染流式细胞术检测结果显示,空白细胞对照组、阴性对照组和MALAT1-RNAi转染组细胞凋亡率分别为(2.93±0.19)%、(3.19±0.20)%和(14.08±1.05)%;不同组别比较,MALAT1-RNAi转染组 MALAT1相对表达量均低于空白细胞对照组和阴性对照组,差异均有统计学意义(均P<0.01);阴性对照组与空白细胞对照组差异无统计学意义(P>0.05)。
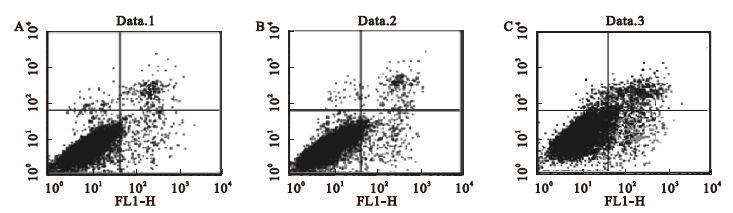
|
注:A:空白细胞对照组; B:阴性对照组; C:MALAT1-RNAi转染组。 图 1 不同组别人脐静脉内皮细胞(HUVEC)凋亡率(%) |
3 讨论
静脉血栓在临床上有“高危、多发而少见”的特点,与肿瘤、心血管疾病并称三大高危疾病[5]。静脉血栓形成的三要素包括:血流瘀滞、血管内皮细胞受损和血小板粘附、聚集和释放[6]。随着孕周的增长,子宫也随之增大,进而压迫髂静脉及下腔静脉,导致静脉回流发生障碍,使血流瘀滞,引起了血管内皮细胞受损,血管壁发生改变,从而易导致妊娠期静脉血栓的发生。
血管腔内面覆盖着的单层扁平细胞是血管内皮细胞,血管自身正常结构和功能的维持借助于血管内皮细胞增殖和凋亡的平衡,血管内皮细胞的凋亡可促进血小板的粘附和血栓的形成,这可能是引起静脉血栓形成的一个重要原因。lncRNA是长度超过200 nt的RNA分子,本身并不编码蛋白质,而以RNA形式在多种层面上调控基因的表达水平[7-8]。MALAT1作为lncRNA家族的重要成员之一,其长度大约为8 700 bp,定位于人类染色体11q13,有研究表明,MALAT1与肿瘤的增殖和凋亡有关[9],但MALAT1是否对人脐静脉内皮细胞有调控增殖和凋亡的作用尚未见文献报道。微小RNA(micro-RNA,miRNA)是一类长约为21~23 个核苷酸的非编码单链小分RNA,在生命活动中普遍存在并发挥着重要作用,一般miRNA以沉默复合体的方式抑制靶基因的表达和功能[10]。本研究构建的MALAT1-RNAi,使人脐静脉内皮细胞(HUVEC)中MALAT1的相对表达量下降到(0.51±0.03),说明其转染是有效的。娄振凯等[11]研究表明,PI3-K/Akt和MAPKs信号通路通过诱导人脐静脉内皮细胞凋亡可促进静脉血栓的形成。吴胜春等[12]研究结果显示,HIF-1α通过调控人脐静脉内皮细胞EVC304的增殖和凋亡参与静脉血栓的发病。本研究结果显示,MALAT1-RNAi转染组培养48和72 h 的吸光度(A)值分别为(0.072±0.087)和(1.115±0.077),均低于空白细胞对照组和阴性对照组(均P<0.05);MALAT1-RNAi转染组HUVEC细胞凋亡率为(14.08±1.05)%,均高于空白细胞对照组和阴性对照组(均P<0.01)。提示下调MALAT1表达量可抑制HUVEC细胞的增殖能力,并促进其凋亡。这可能是妊娠期静脉血栓形成的重要调控基因,有可能成为诊治妊娠期静脉血栓的靶点之一。但MALAT1影响内皮细胞的功能是通过何途径、何基因的变化来完成的尚有待于进一步研究。
| [1] | 李娜, 曾万江. 产科血栓性疾病溶栓治疗的研究进展[J]. 中华产科急救电子杂志 , 2014, 3 (2) : 132–135. |
| [2] | 雷森, 李梦来, 蒲鹏, 等. 妊娠期合并静脉血栓栓塞性疾病的发病特点及治疗分析[J]. 中国妇幼保健 , 2015, 30 (6) : 848–850. |
| [3] | Bernard D, Prasanth KV, Tripathi V, et al. A long nuclear-retained non-coding RNA regulates synaptogenesis by modulating gene expression[J]. EMBO J , 2010, 29 (18) : 3082–3093. DOI:10.1038/emboj.2010.199 |
| [4] | Hu L, Wu Y, Tan D, et al. Up-regulation of long noncoding RNA MALAT1 contributes to proliferation and metastasis in esophageal squamous cell carcinoma[J]. J Exp Clin Cancer Res , 2015, 34 : 7–19. DOI:10.1186/s13046-015-0123-z |
| [5] | Bates SM, Greer IA, Pabinger I, et al. Venous thromboembolism,thrombophilia,antithrombotic therapy,and pregnanc11:American College of Chest Physicians evidence based clinical practice guidelines(8th edition)[J]. Chest , 2008, 133 (Supp1) : 844–866. |
| [6] | 谢露, 貉静, 胡世凤. 海带半纤维素对老龄大鼠血栓形成的影响[J]. 中国公共卫生 , 2004, 20 (4) : 446–447. |
| [7] | Haemmerle M, Gutschner T. Long non-coding RNAs in cancer and development:where do we go?[J]. Int J Mol Sci , 2015, 16 : 1395–1405. DOI:10.3390/ijms16011395 |
| [8] | Quinodoz S, Guttman M. Long noncoding RNAs:an emerging link between gene regulation and nuclear organization[J]. Trends Cell Biol , 2014, 24 : 651–663. DOI:10.1016/j.tcb.2014.08.009 |
| [9] | Liu S, Song L, Zeng S, et al. MALAT1-miR-124-RBG2 axis is involved in growth and invasion of HR-HPV-positive cervical cancer cells[J]. Tumour Biol , 2016, 37 (1) : 633–640. DOI:10.1007/s13277-015-3732-4 |
| [10] | 周世权, 张艳炜, 董秋实, 等. miRNA与心脑血管病研究进展[J]. 中国公共卫生 , 2014, 30 (3) : 378–380. |
| [11] | 娄振凯, 李兴国, 张福厚, 等. PI3-K/Akt和MAPKs信号通路在氧化应激诱导人脐静脉内皮细胞凋亡中的作用[J]. 中国急救医学 , 2016, 36 (1) : 78–82. |
| [12] | 吴胜春, 石晓明, 唐雷, 等. HIF-1α对缺氧条件下人脐静脉内皮细胞EVC34增殖和凋亡的影响[J]. 第二军医大学学报 , 2013, 34 (7) : 808–811. |
 2016, Vol. 32
2016, Vol. 32


