铬(chromium,Cr)在生产和应用过程中可对环境带来严重污染,其中六价铬 可通过消化道、呼吸道、皮肤及粘膜侵入人体,损伤肝肾等器官,同时具有较强的遗传毒性、生殖毒性和致癌作用,严重危害人体健康[1-2]。因此,将Cr(Ⅵ)还原为低毒的Cr(Ⅲ)具有重要的实际意义。Cr(Ⅵ)还原目前已知的方法主要有化学还原和离子交换法。前者会产生大量污泥,后者在其他重金属离子存在时缺乏特异性[3]。近年来,随着生物修复技术的发展,用细菌还原六价铬的方法引起了重视[4]。本研究于2014年3月从湖北省某铬盐厂污水处理站含Cr(Ⅵ)的活性污泥中,通过驯化培养,筛选获得1株还原Cr(Ⅵ)的蜡样芽孢杆菌Cr4-1。现将环境因素、碳源和电子供体对细菌生长和Cr(Ⅵ)还原效果的影响报告如下。
1 材料和方法 1.1 主要试剂与仪器LB培养液:胰蛋白胨10 g/L,酵母提取5 g/L,氯化钠10 g/L; 无机盐培养液:1.013 g/L 氯化铵,0.62 g/L磷酸二氢钠,2.5 g/L磷酸氢二钾,0.010 3 g/L硫酸镁,0.004 25 g/L氯化钙,氯化铁0.000 85 g/L[5-6]。本研究中所用试剂纯度均为分析纯。722N分光光度计(上海菁华科技有限公司);150-A数显生化培养箱(常州国华电器有限公司);TH2-103B恒温培养摇床 (上海一恒科技有限公司);Neofuge 23R台式高速冷冻离心机(香港力康发展有限公司);HFsafe 1200/C生物安全柜(深圳力康发展有限公司)、Tecnai G212透射电子显微镜(荷兰FEI公司)。
1.2 Cr(Ⅵ)还原菌株于2014年3月采集湖北省某铬盐厂污水处理站活性污泥进行驯化、分离和纯化,获得1株高效Cr(Ⅵ)还原的蜡样芽孢杆菌株,命名为Cr4-1。该菌即为后续Cr(Ⅵ)还原特性研究的菌种[7]。
1.3 Cr4-1生长和还原较优条件筛选(表 1)采用4因素3水平的正交试验设计(表 1)[8]筛选Cr4-1生长和还原Cr(Ⅵ)的较优条件。以细菌生长百分比和还原率作为评价指标。其中细菌生长百分比是指还原试验进行12 h之后的细菌密度和初始细菌密度的比值;还原率是还原实验进行12 h之后,被还原的Cr(Ⅵ)浓度和初始Cr(Ⅵ)浓度的比值。
| 表 1 正交设计因素 |
1.4 不同碳源和电子供体对Cr4-1生长和还原的影响
取0.1 mL Cr4-1菌液接种到装有50 mL LB培养液的锥形瓶中过夜富集培养,将细菌在6 000 r/min条件下离心5 min,用pH值为7.0的磷酸缓冲盐溶液(phosphate buffered saline,PBS)溶液清洗2次,接种至装有70 mL无机盐培养液的锥形瓶中,在30 ℃、150 r/min条件下培养。培养液初始Cr(Ⅵ)浓度30 mg/L,分别加入不同碳源,检测细菌600 nm处吸光度值和剩余Cr(Ⅵ)浓度。所选择的碳源包括乳酸钠、 葡萄糖、乙醇、甘油、丙酮酸钠、柠檬酸钠、琥珀酸钠、醋酸钠和甲酸钠等。采用不加碳源但接种细菌的无机盐培养液作为对照。每个样品进行3个平行试验。
1.5 Cr(Ⅵ)对菌株Cr4-1的损伤将Cr4-1接种在初始Cr(Ⅵ)浓度为30 mg/L和60 mg/L的培养液中,培养24 h。取0.5 mL的Cr4-1菌液,6 000 r/min离心5 min,弃去上清液,用2.5%戊二醛固定细菌2 h,然后用0.1 mol/L的PBS清洗2次,每次20 min,用1%的锇酸固定30~120 min,再次用0.1 mol/L的PBS清洗,按50%乙醇、70%乙醇、90%乙醇丙酮、90%丙酮、100%丙酮(2次)各 5 min 梯度脱水,丙酮和环氧树脂1∶ 1,混合浸透2 h,纯环氧树脂包埋剂浸透2 h,开始包埋,在80 ℃恒温箱内聚合10 h,修块,用德国LEICA ULTRACUT UCT超薄切片机切片,醋酸双氧铀、枸橼酸铅双重染色各10 min,最后在透射电子显微镜下观察并拍照记。对照为不加Cr(Ⅵ),接种相同浓度和体积的Cr4-1 菌液。
1.6 分析方法Cr(Ⅵ)测定采用二苯基碳酰二肼分光光度法[9]。细菌浓度的测定采用600 nm处吸光度值。
1.7 统计分析正交实验中,采用极差分析法,计算K值和R值。K值为不同因素不同水平的均值,R值为极差,即各因素中最大K值和最小K值的差值。因此,K值用来确定不同因素的最佳水平。R值反映不同因素对于实验结果的影响程度。采用SPSS 18.0软件进行统计分析。
2 结 果 2.1 细菌生长和还原较优条件(表 2)比较细菌生长百分比(%)和Cr(Ⅵ)还原率(%)各因素的R值大小可知,细菌生长的影响程度依次为:转速>pH值>初始Cr(Ⅵ)浓度>温度;各因素对Cr(Ⅵ)还原的影响依次为:Cr(Ⅵ)浓度>温度>pH值>转速。 比较各因素的K值大小可知,细菌生长的最佳条件为25 ℃、pH为8、初始Cr(Ⅵ)浓度30 mg/L、摇床转速150 r/min;Cr(Ⅵ)还原的最佳条件为:35 ℃、pH为9、初始Cr(Ⅵ)浓度30 mg/L、摇床转速75 r/min。由此可见,影响细菌生长最主要的因素是摇床转速和pH值,影响Cr(Ⅵ)还原最主要的因素是初始Cr(Ⅵ)浓度和温度。 当温度为35 ℃、pH值为9、初始C浓度30 mg/L、转速150 r/min时,细菌生长百分比最高达到123.1%,还原率达到100%。
| 表 2 菌株Cr4-1生长和还原的正交试验结果 |
2.2 碳源和电子供体筛选结果(图 1、2)
乳酸钠是细菌生长代谢过程中的一种常见碳源和电子供体,为获得适于Cr4-1生长的碳含量和碳氮比,首先选用不同浓度乳酸钠进行细菌生长和Cr(Ⅵ)还原试验。从图 1A可以看出,当乳酸钠浓度较低时,由于碳源浓度无法满足细菌生长的需求,细菌光密度(optical density,OD)值呈下降趋势,随着乳酸钠浓度的增加,细菌浓度逐渐增大,当乳酸钠浓度达到12 g/L时,细菌浓度达到最大。乳酸钠浓度为48 g/L时,可能由于碳源和氮源比例的影响,细菌生长被抑制。图 1B显示,当乳酸钠浓度为12 g/L时,细菌Cr4-1对Cr(Ⅵ)还原效果最好,可以在48 h内将30 mg/L的Cr(Ⅵ)还原至5 mg/L,还原率达到83.33%。乳酸钠浓度过高或过低,还原均会受到抑制。因此,细菌生长和还原所需的最佳乳酸钠浓度为12 g/L,此时碳含量为3.84 g/L,培养液碳氮比为14∶ 1。为便于比较,本研究选择的9种碳源,其碳含量均为3.84 g/L,碳氮比为14∶ 1,实验结果如图 2所示。从图 2A可以看出,与未加碳源对照相比,甘油、醋酸钠、琥珀酸钠、柠檬酸钠可维持细菌的生长,而乳酸钠和丙酮酸钠则可促进细菌的生长。细菌Cr4-1的较好碳源依次为乳酸钠>丙酮酸钠>葡萄糖≈甘油>琥珀酸钠>柠檬酸钠。不同碳源对Cr(Ⅵ)还原的影响如图 2B所示。有利于Cr(Ⅵ)还原的碳源依次为:乳酸钠>丙酮酸钠>葡萄糖>甘油>琥珀酸钠。可见,乳酸钠是细菌生长和Cr(Ⅵ)还原的较好碳源,其次是丙酮酸钠。葡萄糖、甘油、琥珀酸钠虽然可促进细菌生长,但对Cr(Ⅵ)还原的效果较差。
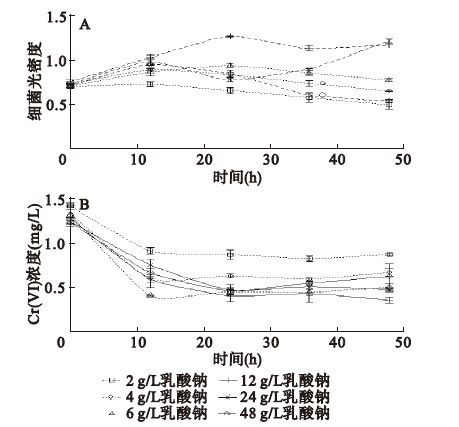
|
图 1 不同乳酸钠浓度对菌株Cr4-1生长和Cr(Ⅵ)还原的影响 |
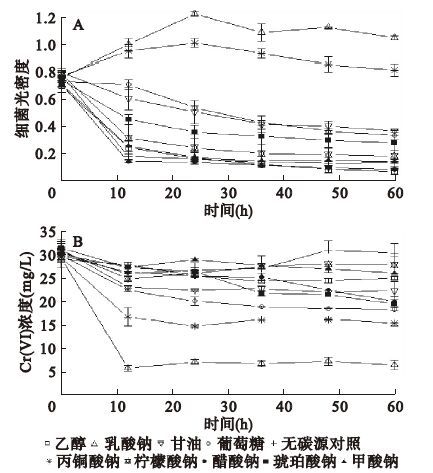
|
图 2 不同碳源对细菌生长和Cr(Ⅵ)还原的影响 |
2.3 Cr(Ⅵ)对细菌损伤(图 3~5)
采用透射电子显微镜对Cr(Ⅵ)还原前后的细菌形态变化进行了观察。图 3是正常细菌生长24 h后的镜下形态。从图 3a上可以清楚的观察到细菌的细胞壁、细胞膜和细胞内部的微细结构。图 3b和图 3c是正常细菌不同切面的形态,细胞结构完整、形态正常,没有观察到损伤破坏。细菌在含有Cr(Ⅵ)30 mg/L和60 mg/L的LB培养液中生长24 h后,采用透射电镜观察,结果如图 4和图 5所示。可以看出,由于Cr(Ⅵ)的影响,细菌形态明显改变,出现萎缩变形,甚至溶解坏死。有些细胞破碎之后,镜下仅存留完整的细胞壁结构,部分细胞的细胞壁也被破坏。且Cr(Ⅵ)浓度为60 mg/L时,细胞溶解坏死比Cr(Ⅵ)浓度为30 mg/L时严重。以上结果表明,细菌在还原Cr(Ⅵ)的同时,Cr(Ⅵ)对细菌产生一定的毒性,且浓度越高,毒性越大。
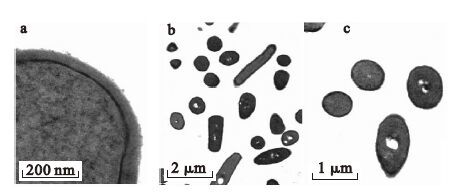
|
图 3 正常细菌生长24 h后的透射电镜照片 |
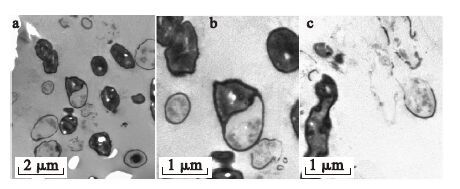
|
图 4 还原初始Cr(Ⅵ)浓度30 mg/L 24 h后的细菌透射电镜照片 |
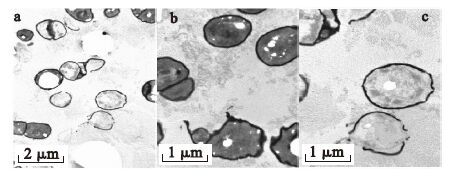
|
图 5 还原初始Cr(Ⅵ)浓度60 mg/L 24 h后的细菌透射电镜照片 |
3 讨 论
正交试验的优点是试验次数少、效果好、方法简单、使用方便、效率高。本研究通过4因素3水平9次试验的正交试验设计,探讨蜡样芽孢杆菌Cr4-1生长和还原Cr(Ⅵ)的影响因素,得出菌株Cr4-1生长和对Cr(Ⅵ)还原的较优条件为:35 ℃、pH值为9、初始铬浓度30 mg/L、转速150 r/min。目前,筛选Cr(Ⅵ)还原菌及其还原Cr(Ⅵ)影响因素的研究中,由于筛选的方法不同、得到的菌种不同、环境因素的差异,得到的结果存在差异[10-12]。本研究发现乳酸钠和丙酮酸钠是细菌生长和Cr(Ⅵ)还原的较好碳源,同时发现葡萄糖、甘油、琥珀酸钠对菌株Cr4-1的生长与还原也有较好的促进效果,这与魏斐等[13]研究结果相似,加之所选择的碳源价格便宜,容易获得,在废水中比较常见,比如葡萄糖常见于食品加工废水[14],故它们作为菌株Cr4-1的碳源和电子供体可行且经济实用。
细菌还原六价铬的机制一般认为有直接还原和间接还原2种。直接还原是利用细菌分泌的铬还原酶催化还原Cr(Ⅵ),这种酶可能位于胞外、胞内或者胞膜上,是细菌的一种主动防御机制[15]。间接还原是细菌在代谢过程中产生一些还原性物质,如硫化氢等,可直接与Cr(Ⅵ)反应,达到解毒目的,间接还原的细菌一般为自养型细菌。蜡样芽孢杆菌Cr4-1为异养型细菌,而且在还原试验的过程中,并未发现硫化氢等还原性物质的产生。因此,可以初步推测,细菌Cr4-1对Cr(Ⅵ)的还原为酶介导反应。有文献表明,细菌溶解在六价铬还原过程中起到重要的作用,细菌溶解所释放的构酶可以在胞内或者胞外催化Cr(Ⅵ)[16-17]。蜡样芽孢杆菌Cr4-1也可能具有类似的还原机制。由于Cr(Ⅵ)的毒性作用,细菌发生溶解坏死,释放出Cr(Ⅵ)还原酶还原Cr(Ⅵ)。但Cr(Ⅵ)如何介导细菌的溶解尚有待进一步研究。
| [1] | 周宜开. 环境流行病学基础与实践[M]. 北京: 人民卫生出版社, 2013 : 249 -252. |
| [2] | 周梦芝, 王华锋, 郑月慧, 等. 常见重金属污染与男(雄)性不育[J]. 中国公共卫生 , 2013, 29 (5) : 769–772. |
| [3] | Kanmani P, Aravind J, Preston D. Remediation of chromium contaminants using bacteria[J]. International Journal of Environmental Science and Technology , 2012, 9 (1) : 183–193. DOI:10.1007/s13762-011-0013-7 |
| [4] | Dhal B, Thatoi HN, Das NN, et al. Chemical and microbial remediation of hexavalent chromium from contaminated soil and mining/metallurgical solid waste:a review[J]. J Hazard Mater , 2013, 250 (2) : 272–291. |
| [5] | Chirwa EN, Wang YT. Simultaneous chromium(Ⅵ)reduction and phenol degradation in an anaerobic consortium of bacteria[J]. Water Research , 2000, 34 (8) : 2376–2384. DOI:10.1016/S0043-1354(99)00363-2 |
| [6] | Molokwanne PE, Chirwa EMN. Biological Cr(Ⅵ)reduction in indigenous sludge cultures from Gauteng,South africa[J]. Water Science and Technology A Journal of the International Association on Water Pollution Research , 2006, 54 (10) : 177–184. DOI:10.2166/wst.2006.880 |
| [7] | 朱培蕾, 焦仕林, 姜朴, 等. 六价铬还原菌Cr4-1的鉴定和还原影响因素的优化[J]. 卫生研究 , 2015, 44 (2) : 201–205. |
| [8] | 明星, 范允舟, 叶晓艳, 等. 水中大肠埃希菌f2噬菌体反冲超滤装置浓缩效果评价[J]. 中国公共卫生 , 2013, 29 (9) : 1387–1388. |
| [9] | Gilcreas FW. Standard methods for the examination of water and wastewater[J]. American Journal of Public Health and the Nations Health , 2012, 56 (3) : 113. |
| [10] | Wani R, Kodam K, Gawai K, et al. Chromate reduction by Burkholderia cepacia MCMB-821,isolated from the pristine habitat of alkaline crater lake[J]. Applied Microbiology and Biotechnology , 2007, 75 (3) : 627–632. DOI:10.1007/s00253-007-0862-7 |
| [11] | Opperman D, Van HE. Aerobic Cr(Ⅵ)reduction by Thermus scotoductus strain SA-01[J]. Journal of Applied Microbiology , 2007, 103 (5) : 1907–1913. DOI:10.1111/j.1365-2672.2007.03429.x |
| [12] | Cheung KH, Gu JD. Chromate reduction by Bacillus megaterium TKW3 isolated from marine sediments[J]. World Journal of Microbiology and Biotechnology , 2005, 21 (3) : 213–219. DOI:10.1007/s11274-004-3619-9 |
| [13] | 魏斐, 杨丽荣, 薛保国, 等. 还原六价铬细菌及其还原酶的研究[J]. 中国生物工程杂志 , 2012, 32 (4) : 53–59. |
| [14] | 邱俊.异VC钠生产废水处理研究与应用[D].南昌:南昌大学硕士学位论文,2009. http://cdmd.cnki.com.cn/article/cdmd-11902-2010076352.htm |
| [15] | Mclean J, Beveridge TJ. Chromate reduction by a pseudomonad isolated from a site contaminated with chromated copper arsenate[J]. Applied and Environmental Microbiology , 2001, 67 (3) : 1076–1084. DOI:10.1128/AEM.67.3.1076-1084.2001 |
| [16] | Priester JH, Olson SG, Webb SM, et al. Enhanced exopolymer production and chromium stabilization in Pseudomonas putida unsaturated biofilms[J]. Applied and Environmental Microbiology , 2006, 72 (3) : 1988–1996. DOI:10.1128/AEM.72.3.1988-1996.2006 |
| [17] | Dogan NM, Kantar C, Gulcan S, et al. Chromium(Ⅵ) bioremoval by pseudomonas bacteria:role of microbial exudates for natural attenuation and biotreatment of Cr(Ⅵ) contamination[J]. Environmental Science and Technology , 2011, 45 (6) : 2278–2285. DOI:10.1021/es102095t |
 2016, Vol. 32
2016, Vol. 32


