2. 上海医药工业研究院分析测试中心
熊果酸又名乌索酸、乌苏酸,属于α-香树脂醇型非极性的五环三萜类化合物,是女贞子、山楂、陆英等多种药用植物中的重要化学成分,具有抗糖尿病[1]、降脂[2]、抗炎[3]、免疫调节[4]、抗心血管疾病[5]等多种生物学效应,许多含有熊果酸的中药材在临床用于保肝、镇痛、强心等方面。近年来研究发现,熊果酸具有预防肿瘤形成、诱导肿瘤细胞凋亡、阻滞肿瘤细胞增殖周期、诱导肿瘤细胞分化、防止肿瘤细胞侵袭转移等作用[6-12]。但由于熊果酸具有强疏水性,其生物利用度很低;另外,含有羧基的药物对胃肠道刺激较大,而且羧基在人体中的代谢不稳定,限制其应用。研究表明,熊果酸3位羟基和17位羧基是熊果酸维持抗肿瘤活性的关键基团[13]。虽从熊果酸母体结构入手进行化学修饰和结构改造,设计合成了许多有效的熊果酸衍生物[14-17],但是这些衍生物并不能完全改善熊果酸在水中的溶解度。本研究利用赖氨酸与熊果酸成盐,观察在水中溶解度及对人肝癌Bel7402肿瘤细胞的体外抑制作用,旨在为熊果酸的进一步开发利用提供技术支持。
1 材料与方法 1.1 主要试剂与仪器人肝癌细胞株bel7402(中国医学科学院肿瘤医院);1640培养基(上海博耀生物科技有限公司);熊果酸(南京泽朗医药科技有限公司,纯度≥98.5%);赖氨酸(北京欣经科生物技术有限公司);熊果酸对照品(中国食品药品检定研究院,110742~201220);乙腈(色谱纯,美国 Fisher CHEMICAL 有限公司)。 Bruker D8 ADVANCE 粉末衍射仪(德国布鲁克有限公司);Nicolet 5700型傅里叶变换红外光谱仪(美国Thermo Nicolet公司);Angilent 1200 高效液相色谱仪(美国安捷伦有限公司),WD-2102A型酶标仪(北京六一仪器厂)。
1.2 赖氨熊果酸制备精密称取等摩尔比的熊果酸(2 283.50 mg)与赖氨酸(730.95 mg)混合均匀,于25 ℃置于球磨机中研磨12 h,收集产物,即得白色粉末状赖氨熊果酸(2 868.34 mg),得率为95.2%,经高效液相色谱(HPLC)检测其纯度为98.2%。
1.3 赖氨熊果酸表征 1.3.1 粉末X射线衍射分析(PXRD)X 射线衍射图谱的摄取采用粉末衍射仪,测定条件为vertical goniometer,Ni-filter单色器,Theta/Theta连续扫描,电压40 kV,电流40 mA,扫描速度8°/min,LynxEye 检测器,扫描范围3°~80°。
1.3.2 傅立叶红外光谱分析采用衰减全反射傅立叶变换红外光谱仪(attenuated total reflectance-fourier transform infrared spectroscopy,ATR-FTIR)测定,光谱范围4 000~650 cm-1,分辨率为4.000 cm-1,扫描次数16次,测定红外吸收光谱。
1.4 增溶作用分析HPLC色谱柱为Agilent Eclipse XDB C18(250×4.6 mm,5 μm);流动相为乙腈:水=90:10;流速为1.0 mL/min;柱温为30 ℃;进样量为10 μL;检测波长为210 nm。
1.4.1 标准曲线建立精密称取熊果酸对照品25.10 mg,移至25 mL容量瓶中,使用甲醇溶剂定容,配制成浓度为1 004.0 μg/mL储备液。精密吸取0.05、0.10、0.50、1.00、2.50、5.00 mL至10 mL容量瓶中,用流动相稀释至刻度,获得6种浓度样品,分别为5.00、10.04、50.20、100.40、251.00、502.00 μg/mL。分别精密吸取6种浓度溶液各10 μL 注入液相色谱仪,重复进样3次,记录色谱图及峰面积,以样品浓度数据为横坐标,以检测获得的峰面积为纵坐标,绘制标准曲线。
1.4.2 精密度测定精密量取浓度为251.00 μg/mL的熊果酸溶液 10 μL注入液相色谱仪,重复进样6次,记录色谱图及峰面积,计算样品平均峰面积相对标准偏差(relative standard deviation,RSD)。
1.4.3 稳定性测定精密量取熊果酸溶液,分别于0、1、2、4、8、12 h取10 μL注入液相色谱仪,每个样品平行进样3次。记录色谱图及峰面积,计算RSD值。
1.4.4 赖氨熊果酸溶解度测定分别称取过量熊果酸、赖氨熊果酸、赖氨酸-熊果酸物理混合物悬浮于20 mL水中,置于水平摇床中,在25 ℃下震摇8 h,分别于1、2、3、4、6、8 h取样,取样后以水补足溶液量,样品溶液经0.22 μm滤膜过滤后上HPLC检测。
1.5 肝癌bel7402细胞增殖抑制作用检测采用3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT)比色法[18-21],人肝癌细胞株bel7402,以含体积分数10%胎牛血清,100 U/mL青霉素、100 μg/mL链霉素的1640培养基,在37 ℃、5%CO2、饱和湿度下培养,24 h后细胞贴壁生长,每3~4 d传代1次,取对数生长期的bel7402细胞制成2×105个/mL的细胞悬液,加入96孔培养板中,每孔200 μL,待细胞贴壁生长后弃去培养液;二甲亚枫(DMSO)溶解,1640培养液分别稀释熊果酸、 赖氨熊果酸、5-氟尿嘧啶(5-FU,阳性对照)至终浓度为5、10、20、40、80 μmol/L,空白孔加入1640培养液,对照组加入0.1% dimethylsulphoxide (DMSO); 每个浓度设3个平行孔;采用酶标仪在490 nm处测定吸光度(A)值,空白孔调零,取平均值,计算细胞生长抑制率。
2 结 果 2.1 赖氨熊果酸表征 2.1.1 粉末X射线衍射分析(图 1)Powder X-ray diffraction (PXRD)图谱显示,熊果酸属晶态化合物,具有尖锐的特征衍射峰; 赖氨酸属于结晶度较差的晶态化合物,赖氨酸、熊果酸(1∶ 1)物理混合物的主要衍射峰含有熊果酸和赖氨酸的衍射峰,为2种成分衍射峰的物理叠加; 赖氨熊果酸为非晶态化合物,因而无明显尖锐衍射峰,表现为弥散衍射峰,表明通过研磨过程赖氨酸与熊果酸形成了新的物相赖氨熊果酸。
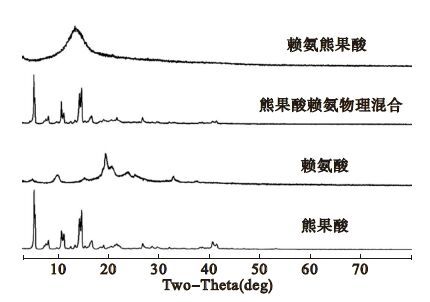
|
图 1 赖氨熊果酸粉末X射线衍射分析图谱 |
2.1.2 傅立叶红外光谱分析(图 2)
熊果酸具有乌苏烷型骨架,分子中存在特征的偕二甲基及羧基,这些结构在IR谱图上均可得到确认。波数1 383和1 375 cm-1处的特征双峰为C-4连接的偕二甲基的C-H面内弯曲振动吸收;1 710 cm-1附近为C-28羧基的υC=O吸收;在波数3 521和999 cm-1附近分别可见C-3羟基的伸缩振动吸收和面外弯曲振动吸收。赖氨酸在IR谱图上可见-NH3的弯曲振动吸收(1 573 cm-1)和-COO-的对称伸缩振动吸收(1 404 cm-1);赖氨酸与熊果酸物理混合物的红外光谱差别不大;赖氨熊果酸的IR谱图中C-28羧基的υC=O吸收减弱,1 029 cm-1附近出现强 υC-O-C 伸 缩振动峰。提示,成盐反应是通过熊果酸的C-28羧基与赖氨酸结构中氨基进行的。
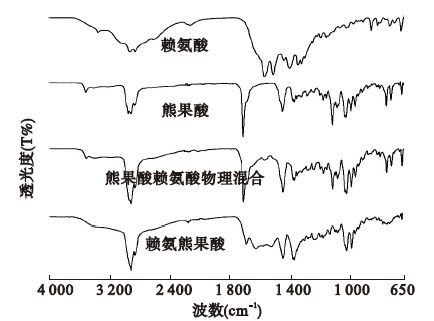
|
图 2 赖氨熊果酸傅立叶红外光谱分析图谱 |
2.2 赖氨熊果酸增溶作用分析 2.2.1 熊果酸与赖氨熊果酸high
performance liquid chromatography (HPLC)图谱(图 3) HPLC分析表明,熊果酸溶液在5.00 ~ 502.00 μg/mL浓度范围内,回归线性方程为Y=4.729X+5.732,相关系数R2=1.000(n=6),表明其线性关系良好;精密度测定结果表明,样品平均峰面积RSD为0.28%,稳定性测定结果表明,样品平均峰面积为0.86%,表明利用高效液相色谱法测定熊果酸含量方法稳定性良好。HPLC图谱显示,赖氨熊果酸与熊果酸具有相同的保留时间。提示,在溶液中赖氨熊果酸容易变回熊果酸,因此具有熊果酸的相应特性,可发挥相应的生物活性。
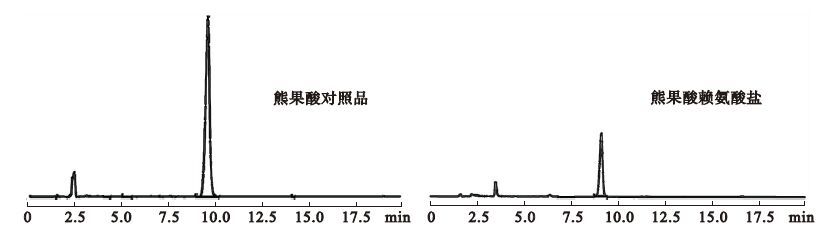
|
图 3 赖氨熊果酸HPLC分析图谱 |
2.2.2 赖氨熊果酸增溶作用
分别将熊果酸、赖氨熊果酸、赖氨酸-熊果酸物理混合物的饱和溶液取样10 μL进样,重复测定3次,取平均值,以峰面积计算熊果酸的含量。结果表明,熊果酸不溶于水,赖氨熊果酸在不同取样点的溶解度分别为48.99、49.70、49.69、49.68、49.68、49.69 μg/mL,其饱和溶解度为49.69 μg/mL,高于赖氨酸-熊果酸物理混合物在水中的溶解度1.87 μg/mL,赖氨熊果酸成盐后明显改善了熊果酸的水溶性。
2.3 赖氨熊果酸对肝癌Bel7402细胞增殖抑制作用(表 1)浓度在5~80 μmol/L范围内,赖氨熊果酸对肿瘤细胞具有明显抑制作用,呈剂量依赖性;当浓度为10、20 μmol/L时,与5-fluorouracil (5-FU)(阳性对照)比较,赖氨熊果酸对肿瘤细胞的抑制作用差异无统计学意义(P>0.05)。
| 表 1 赖氨熊果酸对肝癌bel7402细胞增殖抑制作用(%,x±s=3) |
3 讨 论
近年来,植物来源的药物倍受重视。中国植物资源丰富,中草药中含有大量的天然活性成分,许多具有生物活性的天然产物由于其水溶性差,限制了进一步开发和利用。赖氨酸同时具有羧基和氨基,容易形成兼性离子,可以利用羧基或氨基与极性基团及水分子形成氢键,从而带动熊果酸在水中溶解,增加熊果酸在水中的溶解度。熊果酸抗肿瘤作用的优势主要在于它在抑制肿瘤细胞的同时,不仅少见不良反应,还能在一定程度上提高机体免疫力,因此受到人们的广泛关注。本研究采用研磨法制备赖氨熊果酸,利用赖氨酸的水溶性,提高熊果酸的溶解度,结果显示,通过成盐反应,赖氨熊果酸的溶解度明显改善。本研究结果还表明,通过与赖氨酸成盐,熊果酸对肝癌bel7402细胞的抑制作用明显提高,其具体机制值得进一步探讨。
| [1] | 王琳, 王冠梁, 刘甲寒, 等. 熊果酸通过过氧化物酶增殖受体α和γ信号通路改善KKAy小鼠肝脏胰岛素抵抗的机制[J]. 中西医结合学报 , 2012, 10 (7) : 793–799. |
| [2] | 李迪, 王冠梁, 山梦雅, 等. 熊果酸对3T3-L1脂肪细胞胰岛素抵抗模型CAP表达的影响[J]. 中西医结合学报 , 2012, 10 (8) : 886–893. |
| [3] | 曾光, 陈芳, 熊新贵, 等. 熊果酸对CIA大鼠关节炎症及骨质破坏的影响[J]. 湖南中医药大学学报 , 2013, 33 (7) : 3–7. |
| [4] | 冯英杰, 任会勋, 袁育康, 等. 熊果酸免疫调节作用的初步研究[J]. 西安交通大学学报:医学版 , 2006, 27 (6) : 541–543. |
| [5] | 王杰军, 王兵, 郭静, 等. 熊果酸体外抑制血管形成的研究[J]. 第二军医大学学报 , 2002, 21 (11) : 1071–1073. |
| [6] | 刘蔷, 向谨逸, 桂军宏. 熊果酸对人胃癌细胞株MGC-803增殖的影响及机制[J]. 实用医学杂志 , 2007, 23 (21) : 3318–3320. |
| [7] | 陈国庆, 沈宜, 段红, 等. 熊果酸诱导人食管癌细胞Eca-109凋亡的作用及机制[J]. 中药新药与临床药理 , 2008, 19 (6) : 454–458. |
| [8] | 郭万松, 周悦, 孙任任, 等. 熊果酸对膀胱癌T-24细胞生长的影响[J]. 中国老年学杂志 , 2011, 31 (1) : 269–270. |
| [9] | 齐云秋, 刘宏建, 潘芦羚, 等. 熊果酸对人骨肉瘤MG63细胞的影响[J]. 中华实验外科杂志 , 2010, 27 (11) : 1651–1653. |
| [10] | 姚宏斌, 粱惠, 刘颖, 等. 熊果酸对小鼠H22移植瘤的抑制作用研究[J]. 癌变畸变突变 , 2013, 25 (1) : 1–6. |
| [11] | 唐丹, 李剑萍, 郑锡凤, 等. 熊果酸通过STAT3通路调控胃癌细胞增殖和凋亡[J]. 中国药理学通报 , 2012, 28 (2) : 179–184. |
| [12] | 赵洪昌, 王莹, 赵文静. 熊果酸诱导人白血病HL-60细胞凋亡作用[J]. 中国实验诊断学 , 2012, 16 (8) : 1383–1385. |
| [13] | 李彩莲, 冯锋援. 熊果酸衍生物构效关系研究进展[J]. 药学进展 , 2011, 35 (1) : 23–30. |
| [14] | 朱建勤, 陈晖, 王少戎, 等. 熊果酸半乳糖苷偶联物的合成及保肝活性[J]. 高等学校化学学报 , 2013, 34 (7) : 1660–1666. |
| [15] | 李霞, 白雪, 吴科, 等. 熊果酸-3'-取代丙醇酯衍生物的合成及抗肿瘤活性研究[J]. 有机化学 , 2012, 32 (4) : 703–708. |
| [16] | 李财虎, 杨聪玲, 张宽, 等. 新型熊果酸苯并咪(噻)唑连苯酯合成及抗炎活性测定[J]. 有机化学 , 2012, 32 (1) : 133–137. |
| [17] | 张文娟, 陈少鹏, 陆鑫, 等. 熊果酸衍生物的合成及抗肿瘤血管生成活性[J]. 高等学校化学学报 , 2010, 31 (11) : 2206–2217. |
| [18] | Ahmad S, Ahmad A, Schneider KB, et al. Cholesterol interferes with the MTT assay in human epithelial-like (A549) and endothelial (HLMVE and HCAE) cells[J]. Int J Toxicol , 2006, 25 (1) : 17–23. DOI:10.1080/10915810500488361 |
| [19] | Seidl K, Zinkernagel AS. The MTT assay is a rapid and reliable quantitative method to assess Staphylococcus aureus induced endothelial cell damage[J]. J Microbiol Methods , 2013, 92 (3) : 307–309. DOI:10.1016/j.mimet.2012.12.018 |
| [20] | 张幸, 梁梅花, 黄文君, 等. 芒柄花黄素诱导膀胱癌细胞凋亡作用[J]. 中国公共卫生 , 2015, 31 (3) : 314–317. |
| [21] | 王雷鸣, 梁冰, 李淑芳, 等. 漆姑草水提物对K562细胞凋亡及细胞周期影响[J]. 中国公共卫生 , 2014, 30 (12) : 1520–1522. |
 2016, Vol. 32
2016, Vol. 32
