引用本文

袁国海, 黄秋, 邵继红, 罗雅婕, 谢蒙蒙. 硒-甲基硒代半胱氨酸诱导乳腺癌细胞凋亡作用[J]. 中国公共卫生, 2016, 32(9): 1183-1185.

YUAN Guo-hai, HUANG Qiu, SHAO Ji-hong, et al . Inhibitory effect of Se-methylselenocysteine on human breast cancer cells[J]. Chinese Journal of Public Health, 2016, 32(9): 1183-1185.

硒-甲基硒代半胱氨酸诱导乳腺癌细胞凋亡作用
袁国海
, 黄秋
, 邵继红

, 罗雅婕
, 谢蒙蒙
徐州医学院公共卫生学院营养与食品卫生教研室, 江苏 徐州 221004
收稿日期: 2015-06-16; 数字出版日期: 2015-10-16 14:37
基金项目: 徐州市科技局基金(XZZD1220);江苏省普通高校研究生科研创新计划项目(CXZZ12_0998)
作者简介: 袁国海(1991-),男,江苏泰州人,硕士在读,研究方向:营养与慢性病预防和控制。
摘要:
目的
探讨硒-甲基硒代半胱氨酸(MSC)对人乳腺癌MDA-MB-231细胞的生长抑制作用。
方法
不同浓度MSC培养液(12.5、25.0、50.0、100.0、200.0 μmol/L)作用于MDA-MB-231细胞24、48 h,噻唑蓝法检测MSC对细胞增殖的抑制作用;Hoechst染色法观察细胞凋亡形态;试剂盒检测超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)活力变化。
结果
MSC对细胞增殖具有抑制作用,与对照组比较(100 ± 0.00%),200 μmol/L MSC处理24、48 h细胞生存率[分别为(64.15 ± 2.81)%、(42.57 ± 2.25)%]明显下降(P < 0.01),呈剂量和时间效应关系;Hoechst染色结果显示,高剂量MSC组细胞可见明显染色质凝聚现象;与对照组[SOD(82.47 ± 1.99)、GSH-Px(46.69 ± 0.55)U/mgprot、MDA(5.80 ± 0.11)μmol/mgprot]比较,200 μmol/L MSC处理组细胞24 h时,细胞内SOD、GSH-Px活力[分别为(20.99 ± 3.03)、(22.00 ± 0.75)U/mgprot]明显下降,MDA含量[(36.20 ± 0.25)μmol/mgprot]明显升高,差异有统计学意义(P < 0.01);相同剂量MSC作用MDA-MB-231细胞48 h时,细胞内氧化应激指标变化趋势与作用24 h时趋势相同。
结论
MSC能够抑制乳腺癌细胞MDA-MB-231的增殖,诱导其凋亡,其机制可能与细胞内氧化应激状态改变有关。
关键词:
硒-甲基硒代半胱氨酸(MSC)
乳腺癌MDA-MB-231细胞
凋亡
氧化应激
Inhibitory effect of Se-methylselenocysteine on human breast cancer cells
YUAN Guo-hai, HUANG Qiu, SHAO Ji-hong

, et al
Department of Nutrition and Food Hygiene, Xuzhou Medical College, Xuzhou, Jiangsu Province 221004, China
Abstract:
Objective
To observe restrictive impact of Se-methylselenocysteine (MSC) on the growth of human breast cancer cells (MDA-MB-231).
Methods
MDA-MB-231 cells were challenged with different concentrations of MSC (12.5, 25, 50, 100, and 200 μmol/L)for 24 and 48 hours, respectively.The inhibition rate of MDA-MB-231 cells was assayed with 3-(4, 5-dimethylthiazol-2-yl)-2, 5 diphenyltetrazolium bromide (MTT) assay.The cell apoptosis was observed with Hoechst stain.The activities of superoxide dismutase (SOD), malondialdehyde (MDA)and glutathione peroxidase (GSH-Px) in MDA-MB-231 cells were determined with test kit.
Results
MSC can inhibit proliferation of MDA-MB-231 cells.Compared with that of control group(100 ± 0.00%), the survival rate of MDA-MB-231 cells treated with 200 μmol/L MSC decreased remarkably at 24 (64.15 ± 2.81%)and 48 hours (42.57 ± 2.25%).MTT assay showed that MSC could inhibit the proliferation of MDA-MB-231 cells in dose-and time-dependent manner (P < 0.01).Hoechst stain demonstrated that there were obvious chromatin condensations in MDA-MB-231 cells of MSC pretreatment group.Compared with those in the control group, the activities of SOD (20.99 ± 3.03 vs.82.47 ± 1.99 U/mg protein) and GSH-Px (22.00 ± 0.75 vs.46.69 ± 0.55 U/mg protein)declined but the activity of MDA (36.20 ± 0.25 vs.5.80 ± 0.11 μmol/mg protein)increased obviously in the MDA-MB-231 cells treated with 200 μmol/L MSC for 24 hours and the variations were also observed in the cells with the same MSC treatment for 48 hours.
Conclusion
MSC can inhibit proliferation and induce apoptosis in human breast cancer cell line MDA-MB-231 in dose-and time-dependent manner; the mechanism of the inhibitive effect of MSC may related to the change in antioxidant activity.
Key words:
Se-methylselenocysteine
breast cancer cell MDA-MB-231
apoptosis
oxidative stress
硒是人体必需微量元素,2009年卫生部将甲基硒代半胱氨酸,即L-硒-甲基硒代半胱氨酸(L-Se-methylselenocysteine,MSC)列为新型食品营养强化剂。MSC是一种天然含硒氨基酸-硒代半胱氨酸的甲基化衍生物,具有防治癌症、抗氧化、抗衰老、治疗心脑血管疾病、拮抗重金属中毒等作用[1]。硒在机体最主要功能是抗氧化,此外还可促进机体免疫功能、调控基因表达、参与多种疾病的发生发展。本研究以人乳腺癌MDA-MB-231细胞为受试对象,探讨MSC对乳腺癌细胞的抑制作用及可能机制,结果报告如下。
1 材料与方法
1.1 主要试剂与仪器 人乳腺癌MDA-MB-231细胞株(徐州医学院肿瘤实验室);胎牛血清(杭州四季青公司);1640培养基(美国GIBCO公司);MSC(美国Sigma公司),将MSC配制为100 mmol/L的储存液,-20 ℃储存,使用前以1640完全培养基稀释成不同浓度溶液;噻唑兰(3-(4,5-dimethylthiozol-2-yl)-2, 5 diphenyltetrazolium bromide, MTT)(美国Amersco公司);细胞凋亡-Hoechst染色试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、丙二醛(malondialdehyde,MDA)检测试剂盒(上海碧云天公司)。酶标仪(美国Bio-Tek公司)。
1.2 指标与方法
1.2.1 细胞存活率检测 采用MTT法,接种细胞104个/孔至96孔板,至对数生长期时,给予200 μL不同浓度MSC溶液(12.5、25.0、50.0、100.0、200.0 μmol/L),对照组加入培养液,每组设5个复孔。分别培养24、48 h后弃去培养基,加入MTT混合液200 μL,继续孵育4 h,加入200 μL二甲基亚砜,采用酶标仪在490 nm测定吸光度absorbency(A)值。细胞存活率(%)=(MSC组A值-空白组A值)/(对照组A值-空白组A值)×100%,实验重复3次。
1.2.2 细胞凋亡检测 采用Hoechst染色法,细胞接种于6孔板上,分组与处理同1.2.1,分别培养24、48 h后吸尽培养液,加入0.5 mL固定液,固定10 min,去固定液,磷酸盐缓冲液(phosphate buffered saline)洗2遍;加入0.5 mL Hoechst染色液5 min,PBS洗2遍,吸尽液体;每孔滴1滴抗荧光淬灭封片液,盖上盖玻片;荧光显微镜检测呈蓝色的细胞核。
1.2.3 氧化应激指标检测 细胞接种于6孔板上,分组与处理同1.2.1,分别培养24、48 h,4 ℃PBS洗涤1~2遍,细胞裂解液裂解细胞,吸出裂解液至离心管,4 ℃离心取上清,用试剂盒分别检测SOD、MDA、GSH-Px水平,按试剂盒说明书操作。
1.3 统计分析 计量数据符合正态分布的用表示,采用SPSS 16.0软件进行统计分析,组间均数比较采用方差分析,资料满足方差齐性时,多实验组与同一对照组均数间两两比较采用Dunnett′s t检验,不满足方差齐性时,采用Dunnett′s T3检验;P < 0.05表示差异有统计学意义。
2 结果
2.1 MSC对MDA-MB-231增殖影响(表 1)
表 1

表 1 MSC对MDA-MB-231细胞存活率影响(%,x±s,n=5)
| 组别(μmol/L) |
培养时间(h) |
| 24 |
48 |
| 对照组 |
100.00±0.00 |
100.00±0.00 |
| MSC 12.5 |
95.71±0.98 |
95.41±1.27 |
| 25.0 |
89.08±1.86ab |
84.81±0.85ab |
| 50.0 |
85.18±1.65ab |
78.00±1.39ab |
| 100.0 |
80.41±3.01ab |
67.87±2.47ab |
| 200.0 |
64.15±2.81ab |
42.57±2.25ab
|
| 注:与对照组比较,a P < 0.01;与12.5 μmol/L组比较,b P < 0.01。 |
|
表 1 MSC对MDA-MB-231细胞存活率影响(%,x±s,n=5)
|
倒置显微镜下MDA-MB-231为梭状细胞,轮廓清楚,细胞间结构紧密,胞质透亮,生长旺盛。MSC处理组细胞缩小变圆,细胞间接触变松,颗粒样物质变多,折光性及贴壁能力减弱,增殖减慢。与对照组比较,MSC处理24、48 h时,≥ 25 μmol/L MSC组细胞存活率逐渐降低,差异均有统计学意义(F=1083.220,P < 0.01);与24 h相比,MSC作用48 h细胞存活率差异有统计学意义(F=287.538,P < 0.01)。
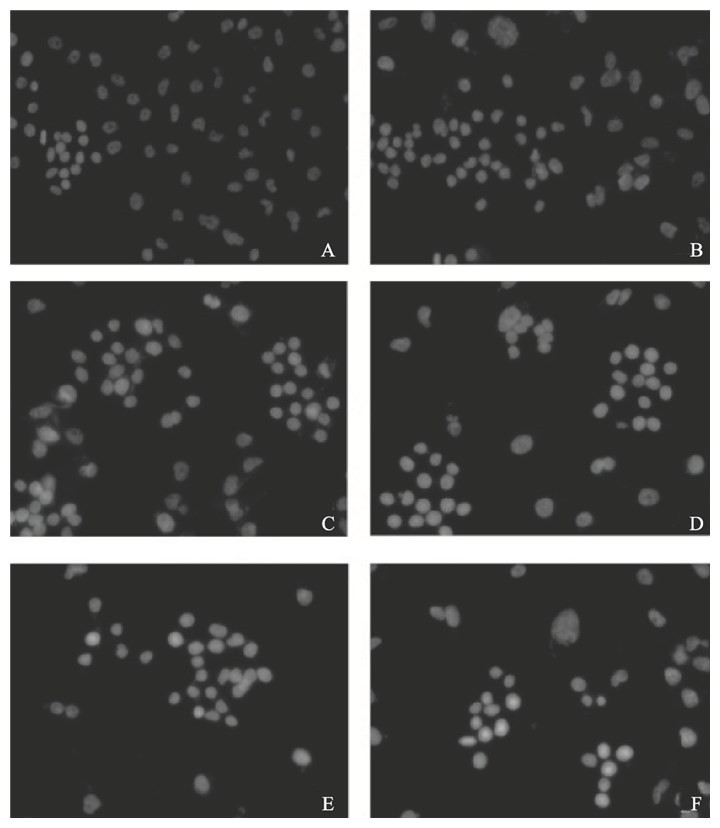
2.2 MSC对MDA-MB-231细胞凋亡影响(图 1)
染色质凝聚是细胞凋亡典型的形态学变化之一。荧光显微镜观察结果显示,对照组细胞核呈圆形或椭圆形,为弥散均匀的蓝色荧光,强度较弱;MSC处理细胞24 h时,随着浓度升高,部分细胞核呈不同程度致密浓染或碎块状致密浓染,出现核固缩,荧光强度增强,颜色发白;处理48 h时,各处理组细胞变化趋势与24 h时大致相同。
2.3 MSC对MDA-MB-231细胞内氧化应激指标影响(表 2)
表 2

表 2 MSC对MDA-MB-231细胞SOD、GSH-Px活力、MDA水平影响(x±s,n=3)
| 组别(μmol/L) |
SOD(U/mgprot) |
|
MDA(μmol/mgprot) |
|
GSH-Px(U/mgprot) |
| 24 h |
48 h |
|
24 h |
48 h |
|
24 h |
48 h |
| 对照组 |
82.47±1.99 |
36.57±0.76 |
|
5.80±0.11 |
6.06±0.16 |
|
46.69±0.55 |
47.08±0.54 |
| MSC 12.5 |
74.37±1.24 |
32.58±0.73 |
|
6.23±0.06 |
6.45±0.08 |
|
44.91±0.38 |
45.51±1.22 |
| 25.0 |
53.42±2.32ab |
29.92±1.64a |
|
9.78±0.26ab |
12.43±0.25ab |
|
40.43±0.84ab |
35.69±0.69ab |
| 50.0 |
50.25±2.08ab |
26.76±2.18ab |
|
12.13±0.27ab |
18.54±0.27 ab |
|
35.79±0.86ab |
28.82±0.42ab |
| 100.0 |
49.68±2.99ab |
17.80±3.56ab |
|
19.37±0.22ab |
33.22±0.22 ab |
|
30.54±0.94ab |
21.97±0.68ab |
| 200.0 |
20.99±3.03ab |
6.27±1.52ab |
|
36.20±0.25ab |
53.13±0.25 ab |
|
22.00±0.75ab |
15.13±0.28ab |
| 注:与对照组比较,a P < 0.01;与12.5 μmol/L组比较,b P < 0.01。 |
|
表 2 MSC对MDA-MB-231细胞SOD、GSH-Px活力、MDA水平影响(x±s,n=3)
|
与对照组比较,≥ 25 μmol/L MSC处理细胞24、48 h时,细胞内SOD、GSH-Px活力降低,MDA水平升高,差异有统计学意义(F=144.507、29 479.461、1 336.564,均 P < 0.01),呈剂量效应关系;随MSC作用时间延长,细胞内SOD、GSH-Px活力逐渐降低,MDA水平逐渐升高(F=727.304、8 954.261、376.145,均 P < 0.01),呈时间效应关系。
3 讨论 硒具有广泛的生物学活性,可增强人体免疫力,对部分重金属中毒有拮抗作用,而硒的抗肿瘤作用已成为目前研究热点[2-4]。硒通过甲基化代谢可以降低硒的毒性,硒甲基化后具有很强的抗肿瘤作用[5-6]。本研究结果表明MSC能够抑制乳腺癌MDA-MB-231细胞的增殖,存在时间-剂量依赖性。超氧化物歧化酶(SOD)能够清除生物氧化过程中产生的超氧化物自由基,是生物抗氧化系统的重要酶类之一[7]。谷胱甘肽过氧化物酶(GSH-Px)是机体内广泛存在的一种重要的含硒过氧化物分解的酶,能特异地催化还原型谷胱甘肽(GSH)对氢过氧化物的还原反应。而MDA通过酶系统和非酶系统产生氧自由基,后者能攻击生物膜中的多不饱和脂肪酸引发脂质过氧化作用,并由此形成脂质过氧化物,使组织细胞受损伤。本研究结果显示,MSC能降低MDA-MB-231细胞内SOD和GSH-Px活力,升高MDA水平,呈剂量-时间效应。提示MSC可通过降低细胞内SOD、GSH-Px活性,升高MDA水平,造成MDA-MB-231细胞内的氧化应激状态,引起细胞氧化损伤,从而诱导细胞凋亡。这与目前已有的肿瘤细胞凋亡的氧化应激调控机制研究结果相符[8-10]。
参考文献
| [1] |
刘建群, 赵元, 张锐, 等.
新型营养强化剂L-硒-甲基硒代半胱氨酸的研究进展[J]. 中国食品添加剂 , 2011, 2 (19) : 152–156.
|
| [2] |
刘玲, 卓滋泽, 马文军.
硒与肿瘤的关系研究[J]. 环境与健康杂志 , 2013, 30 (9) : 844–848.
|
| [3] |
段鹏, 陈晋, 杨波, 等.
硒拮抗氟致大鼠肝细胞氧化应激和DNA损伤作用[J]. 中国公共卫生 , 2013, 29 (11) : 1626–1629.
|
| [4] |
Lin TT, Ding ZY, Li N, et al.
Seleno-cyclodextrin sensitises human breast cancer cells to trail-induced apoptosis through DR5 induction and NF-κB suppression[J]. Eur J Cancer , 2011, 47 : 1890–1907.
DOI:10.1016/j.ejca.2011.04.004 |
| [5] |
邱万寿, 唐勇, 刘威, 等.
甲基硒酸对人三阴性乳腺癌细胞化疗增敏作用的机制探讨[J]. 中国病理生理杂志 , 2013, 29 (11) : 1990–1993.
|
| [6] |
王慧.亚硒酸钠对胃癌细胞株SGC-7901增殖、凋亡及hTERT表达的作用及其机理研究[D].泰安:泰山医学院硕士学位论文, 2010.
|
| [7] |
张志清, 丛军, 林虹, 等.
麦苗中超氧化物歧化酶抗氧化活性研究[J]. 中国粮油学报 , 2014, 29 (7) : 12–17.
|
| [8] |
喻晓静, 邵晓梅, 方剑乔.
细胞凋亡信号传导通路研究进展[J]. 实用中医药杂志 , 2011, 27 (1) : 71–72.
|
| [9] |
马时岭, 东方, 季宇彬, 等.
海藻硒多糖抗肿瘤作用机制的研究[J]. 黑龙江医药 , 2013, 26 (4) : 594–596.
|
| [10] |
熊珊珊, 石英英, 石汉平.
活性氧与肿瘤研究进展[J]. 中华肿瘤防治杂志 , 2014, 21 (13) : 1045–1048.
|
 2016, Vol. 32
2016, Vol. 32

