2. 温州医科大学基础医学院
多氯联苯类化合物(polychlorinated biphenyls,PCBs)是一种稳定、高亲脂性、环境中分布广泛的化合物,对人体有明显的毒性作用[1-2]。研究表明,PCBs可由细胞色素代谢激活,导致氧化应激[3-5],使骨骼肌细胞对葡萄糖的摄取障碍[6-8];葡萄糖转运蛋4(glucose transporter 4, GLUT-4)是与骨骼肌细胞葡萄糖储存相关的重要葡萄糖转运体[9-14];大蒜素(allicin)能够有效清除体内自由基,具有较强抗氧化活性[15]。本研究通过观察大蒜素对PCBs诱导小鼠骨骼肌细胞氧化应激与GLUT-4表达的影响,探讨多氯联苯类化合物对机体毒性作用机制,结果报告如下。
1 材料与方法 1.1 主要试剂与仪器PCBs,分子量:328.4,纯度为98%(江苏启东宇林化工厂),大蒜素软胶囊,纯度为95%(美国Herbalife公司),丙二醛(maleic dialdehyde,MDA)、总超氧化物歧化酶(total superoxide dismutase,T-SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和考马斯亮兰蛋白测定试剂盒(南京建成生物研究所),GLUT-4抗体(北京方程生物科技有限公司)。Thermo Scientific Fluoroskan Ascen酶标仪(荷兰帕纳科公司)。
1.2 分组与处理健康雄性ICR小鼠50只,体重(25.68±3.26)g[浙江省医学科学院实验动物中心提供,许可证号:SCXK(浙)2010-5234],小鼠按体重随机分为对照组、多氯联苯组、大蒜素(30、40、60 mg/kg)组,每组10只;多氯联苯组小鼠于腹腔注射多氯联苯(2 mg/kg,注射前先溶于0.1 mL玉米油中),大蒜素组小鼠腹腔注射多氯联苯,同时灌胃1 mL不同剂量大蒜素,对照组灌胃等剂量玉米油,连续30 d。实验期间小鼠自由饮食饮水,温度22~25 ℃,相对湿度60%~70%,末次给药后,小鼠麻醉,立刻取肱三头肌和股薄肌-80 ℃保存待测,另取部分骨骼肌组织用4%多聚甲醛固定,石蜡包埋,用于免疫组织化学观察。
1.3 指标与方法 1.3.1 动物生长发育状况观察实验期间每天观察动物一般性状和表现,实验结束时称量动物体重。
1.3.2 骨骼肌形态结构观察小鼠麻醉后立刻取其肱三头肌和股薄肌置于4%多聚甲醛中固定,常规石蜡切片,厚度3 μm。组织切片复水后常规苏木素-伊红染色(HE),显微镜下观察骨骼肌形态结构变化。
1.3.3 生化指标测定将骨骼肌组织9倍稀释成10%匀浆液,1 200 g离心10 min,取上清,按照蛋白测定试剂盒说明书,测定各组织中蛋白含量;比色法测定骨骼肌组织中MDA含量;骨骼肌组织中T-SOD、GSH-Px和CAT酶活性严格按照试剂盒说明书进行操作。
1.3.4 GLUT-4表达测定切片经脱腊,消除过氧化物酶活性,抗原修复后加入兔抗小鼠GLUT-4(1:100),孵育过夜,滴加生物素化二抗,二氨基联苯胺显色,苏木精复染后观察并拍照,随机选择3个视野计数,GLUT-4表达以细胞质呈棕黄色或出现棕黄色颗粒为表达阳性。
1.4 统计分析实验数据用x±s表示,采用SPSS 17.0软件进行统计分析,计量资料符合正态分布,多个样本均数间的比较采用单因素方差分析,两两比较采用最小显著差法,检验水准为α=0.05。
2 结果 2.1 大蒜素对小鼠体重及一般状态影响对照组小鼠生长发育状况良好;与对照组比较,多氯联苯组小鼠体重明显下降(P < 0.05);与多氯联苯组比较,60 mg/kg大蒜素组小鼠体重明显升高(P < 0.05)。
2.2 大蒜素对小鼠骨骼肌形态结构影响(图 1)
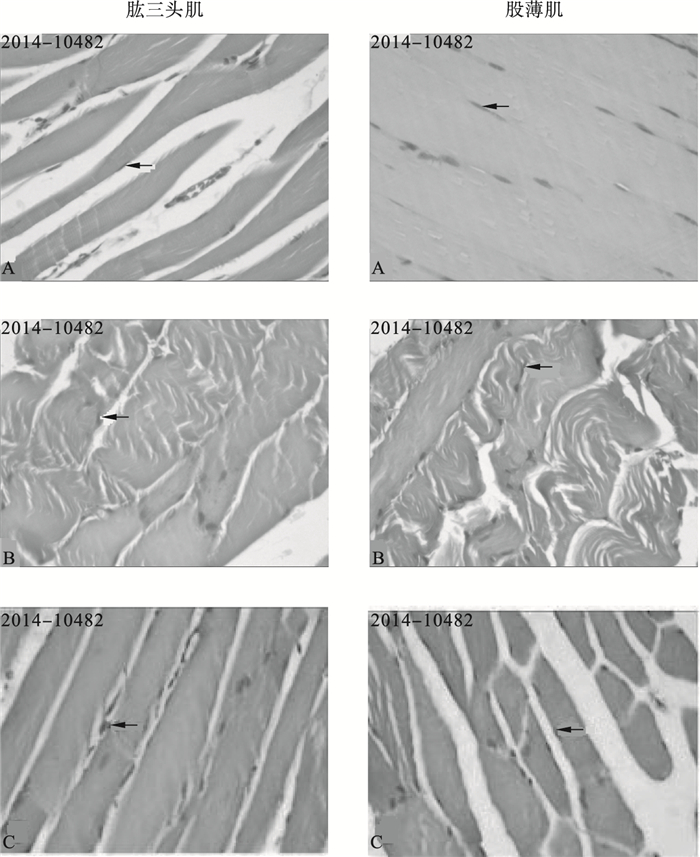
|
注:A:对照组;B:多氯联苯组;C:大蒜素(40 mg/kg)组;→:骨骼肌细胞核。 图 1 大蒜素对小鼠骨骼肌形态结构影响(HE,×200) |
对照组小鼠肱三头肌和股薄肌肌纤维呈带状,横纹清晰,细胞核长卵圆形,位于肌纤维的周边(图 1A);多氯联苯组小鼠骨骼肌纤维排列紊乱,肌细胞肿胀,横纹大多消失(图 1B);与多氯联苯组比较,大蒜素组小鼠骨骼肌组织形态明显改善,横纹可见,但肌纤维仍稍肿胀(图 1C)。
2.3 大蒜素对小鼠骨骼肌GLUT-4表达影响对照组小鼠骨骼肌组织中GLUT-4表达(57.25±4.32)呈强阳性,而多氯联苯组小鼠骨骼肌GLUT-4表达(16.56±1.86)呈阴性或较弱阳性,30、40和60 mg/kg大蒜素组小鼠骨骼肌GLUT-4表达[分别为(28.12±1.76)、(34.40±2.52)和(30.44±2.90)]均呈弱阳性。
2.4 大蒜素对小鼠氧化应激指标影响(表 1、2)| 表 1 大蒜素对多氯联苯诱导肱三头肌细胞氧化应激指标影响(x±s,n=10) |
| 表 2 大蒜素对多氯联苯诱导股薄肌细胞氧化应激指标影响(x±s,n=10) |
与对照组比较,多氯联苯组小鼠肱三头肌和股薄肌组织中T-SOD、GSH-Px、CAT酶活力明显下降(P < 0.05),MDA含量明显升高(P < 0.05);与多氯联苯组比较,各大蒜素组小鼠骨骼肌中MDA含量下降(P < 0.05),40、60 mg/kg大蒜素组小鼠骨骼肌组织中GSH-Px、CAT酶活力升高(P < 0.05)。
3 讨论骨骼肌是胰岛素敏感的主要组织之一,参与80%胰岛素诱导的糖摄取,而胰岛素抵抗使GLUT-4蛋白表达减少,糖摄取功能减退[16-18],从而导致机体血糖代谢紊乱,容易引发高糖血症。因此,抗氧化应激成为抑制多氯联苯造成GLUT-4表达下降的重要措施。大蒜素是从大蒜中提取的有效成分,具有较强的抗氧化能力,其抗氧化活性的部位在烯丙基位碳-氢键[19],可以保护组织细胞免受氧化应激损伤。本研究结果显示,对照组小鼠骨骼肌纤维形态正常,而多氯联苯组小鼠骨骼肌纤维排列紊乱,肌细胞肿胀,横纹基本消失,给予大蒜素干预后的小鼠骨骼肌纤维形态明显改善;免疫组化结果显示,对照组小鼠GLUT-4阳性细胞丰富,且细胞体着色较均匀,多氯联苯组小鼠骨骼肌GLUT-4阳性细胞数明显减少,大蒜素组小鼠GLUT-4阳性细胞数减少不明显。本研究结果还显示,PCBs暴露可以导致机体抗氧化酶如SOD、CAT、GSH-Px等活性下降,造成骨骼肌组织损伤,而给予大蒜素干预后的小鼠骨骼肌组织抗氧化酶活力明显升高。提示,PCBs破坏了机体氧化和抗氧化系统的平衡,进一步诱导产生炎症因子,直接损伤骨骼肌组织细胞造成GLUT-4表达下降;大蒜素可明显改善多氯联苯造成的小鼠骨骼肌组织细胞形态结构改变,可明显升高机体抗氧化能力,对多氯联苯所致小鼠骨骼肌中GLUT-4表达下降具有一定拮抗作用。其具体机制值得进一步探讨。
| [1] | 胡文兰. 多氯联苯测定方法的研究进展[J]. 中国卫生检验杂志 , 2012, 22 (9) : 2262–2266. |
| [2] | 宋鹏. 多氯联苯分子遗传毒性和流行病学研究进展[J]. 国际流行病学传染病学杂志 , 2011, 38 (6) : 429–432. |
| [3] | Kandaswamy S, Senthamilselvan B. Protective role of quercetin on PCBs-induced oxidative stress and apoptosis in hippocampus of adult rats[J]. Neurochem Res , 2012, 37 : 708–721. DOI:10.1007/s11064-011-0661-5 |
| [4] | Song EQ, Ma XY, Tian XG. The effect of the structure of polychlorinated biphenyls on their hydroxylation, oxidation, and glutathionyl conjugation reactions[J]. Biomed Environ Sci , 2013, 26 (2) : 138–147. |
| [5] | Oakley GG, Devanboyina US, Robertson LW. Oxidative DNA damage induced by activation of polychlorinated biphenyls (PCBs):implications for PCB-induced oxidative stress in breast cancer[J]. Chem Res Toxicol , 1996, 9 : 1285–1292. DOI:10.1021/tx960103o |
| [6] | Li LF, Li J. Link between oxidative stress and insulin resistance[J]. Chin Med Sci J , 2007, 22 (4) : 254–259. |
| [7] | Matsuzawa-Nagata N, Takamura T, Ando H. Increased oxidative stress precedes the onset of high-fat diet-induced insulin resistance and obesity[J]. Metabolism Obesity , 2008, 57 (8) : 1071–1077. |
| [8] | Rebolledo OR, Marra CA, Raschia A. Abdominal adipose tissue:early metabolic dysfunction associated to insulin resistance and oxidative stress induced by an unbalanced diet[J]. Horm Metab Res , 2008, 40 (11) : 794–800. DOI:10.1055/s-2008-1081502 |
| [9] | David E, James R, Brown J, et al. Insunlin-regulatable tissues express a unique insulin-sensitive glucose transport protein[J]. Nature , 1988, 333 : 183–185. DOI:10.1038/333183a0 |
| [10] | Marialice K, James AW, Jacqueline MS. Jacqueline MS.Insulin responsiveness in skeletal muscle is determined by glucose transporter (Glut4) protein level[J]. Biochem , 270 : 397–400. |
| [11] | Huang S, Czech MP. The GLUT4 glucose transporter[J]. Cell Metab , 2007, 5 : 237–252. DOI:10.1016/j.cmet.2007.03.006 |
| [12] | Klip A, Paquet MR. Glucose transport and glucose transporters in muscle and their metabolic regulation[J]. Diabetes Care , 1990, 13 : 228–243. DOI:10.2337/diacare.13.3.228 |
| [13] | Saltiel AR, Kahn CR. Insulin signalling and the regulation of glucose and lipid metabolism[J]. Nature , 2001, 414 : 799–806. DOI:10.1038/414799a |
| [14] | 王玉勤, 于晓婷, 吴晓岚, 等. 六黄合剂对胰岛素抵抗大鼠氧化应激水平影响[J]. 中国公共卫生 , 2014, 30 (5) : 625–626. |
| [15] | Kailash P, Victor AL, Ming Y. Antioxidant activity of allicin, an active principle in garlic[J]. Mol Cell Bioche , 1995, 148 : 183–189. DOI:10.1007/BF00928155 |
| [16] | Debnath D, Mandal TK. Study of quinalphos formulation-induced damage of the testicular tissues and antioxidant defense systems in Sprague-Dawley albino rats[J]. Appl Toxicol , 2000, 20 : 197–204. DOI:10.1002/(ISSN)1099-1263 |
| [17] | 潘奇正, 侯雪, 时佳宏. 氧化乐果对大鼠体内氧化应激和脂代谢水平的影响[J]. 中国老年学杂志 , 2013, 33 : 3695–3697. |
| [18] | Stenbit AE, Tsao TS, Li J, et al. GLUT4 heterozygous knockout mice develop muscle insulin resistance and diabetes[J]. Nat Med , 1997, 3 : 1096–1101. DOI:10.1038/nm1097-1096 |
| [19] | Kern M, Wells JA, Stephens JM, et al. Insulin responsiveness in skeletal muscle is determined by glucose transporter (Glut4) protein level[J]. Biochem.J , 1990, 270 : 397–400. |
 2016, Vol. 32
2016, Vol. 32


