肝脏是机体重要的代谢器官,极易受各种因素影响而导致损伤,常见原因有病毒性感染、创伤及化学中毒等。四氯化碳(CCl4)是一种典型的肝脏毒剂,由CCl4诱导的小鼠肝损伤是用于研究化学性肝损伤的常用模型[1]。转化生长因子β1(transforming growth factorβ1,TGF-β1)属于TGF-β家族,具有广泛的生物学作用[2-3]。大量研究显示,在慢性肝脏疾病,如病毒性肝炎、肝纤维化、肝癌及肝功能衰竭等疾病发生发展过程中均有TGF-β1表达异常[4-6],TGF-β1具有抑制肝细胞增殖及促进细胞外基质(extracellular matrix, ECM)产生作用[7-8],是诱导肝、肺纤维化的关键分子[9]。但是,在CCl4诱导的小鼠急性化学性肝损伤中是否存在TGF-β1蛋白表达异常仍不清楚。因此,本研究通过检测TGF-β1及其信号分子Smad2、3的表达水平变化,探讨TGF-β1是否参与了CCl4诱导的小鼠急性肝损伤过程。
1 材料与方法 1.1 试剂血清转氨酶alanine aminotransferase(ALT)及aspartate aminotransferase (AST)检测试剂盒由南京建成生物提供。TGF-β1的enzyme-linkde immunosorbent assay(ELISA)检测试剂盒购自eBioscience。橄榄油由北京可丽佩翠橄榄油开发中心提供。CCl4购自北京化工厂。
1.2 CCl4诱导小鼠急性肝损伤模型制备Balb/c纯系小鼠,雄性18~20g,specific pathogen-free(SPF)级(华阜康科技有限公司,北京),适应性喂养7天后随机分为橄榄油对照组及CCl4组。橄榄油对照组小鼠腹腔注射10 mL橄榄油/kg体重;CCl4组小鼠腹腔注射0.5 mL CCl4+9.5 mL橄榄油/kg体重,即CCl4与橄榄油的比例为1:19;分别于给药后1 d、3 d、5 d处死小鼠,分离血清用于转氨酶及TGF-β1检测;生理盐水心脏灌流,收获肝脏组织,部分肝脏组织经40 g/L多聚甲醛固定,用于组织病理学检测。
1.3 血清转氨酶ALT及AST测定取小鼠血清,按试剂盒操作说明书(南京建成生物)检测血清转氨酶ALT及AST,510 nm波长处测光吸收值,根据标准曲线计算样品浓度(U/L)。
1.4 肝脏病理学分析取小鼠肝左叶组织标本,经4%多聚甲醛固定24小时,常规石蜡包埋,组织病理切片厚度为3~5μm,苏木素-伊红(hematoxylin-eosin, HE)染色,显微镜下观察肝组织的病理损伤程度。
1.5 肝组织中TGF-β1等相关基因检测(表 1)| 表 1 PCR所用特异性引物及其序列 |
采用reverse transcriptase PCR(RT-PCR)取小鼠肝组织20 mg,1mL Trizol(invitrogen)研磨肝组织获取RNA,取1μg抽提总RNA进行逆转录,1μL逆转录产物进行RT-PCR,反应条件:Stage 1:95℃5 min,1 cycle;Stage 2:94℃30s,56℃30s, 72℃1 min,30~35 cycles; Stage 3:72℃10 min。琼脂糖凝胶电泳分离PCR产物,PCR所用特异性引物及其序列见table 1。
1.6 小鼠血清中TGF-β1水平检测采样ELISA法,小鼠血清用样本稀释液4倍稀释,按照说明书操作,检测小鼠血清中TGF-β1水平。
1.7 统计分析所有数据均采用SPSS17.0软件进行统计学处理,P < 0.05为差异有统计学意义。
2 结果 2.1 CCl4诱导小鼠急性肝损伤(图 1、2)

|
注:●橄榄油对照鼠;■CCl4处理鼠;与橄榄油对照组比较,a P<0.05,b P<0.01。 图 1 小鼠外周血ALT及AST水平变化 |
结果显示,CCl4处理后1 d、3 d模型鼠血清ALT及AST水平明显升高,与对照组比较差异有统计学意义(P < 0.01)。肝组织病理学结果显示,CCl4处理1 d的模型鼠肝门脉及汇管区周围有大面积环状坏死病灶,3 d时肝门脉及汇管区周围坏死面积减小,有大量炎症细胞浸润;5d时可见肝小叶门脉损伤区明显修复(图 2)。上述结果表明CCl4成功诱导了小鼠急性肝损伤。
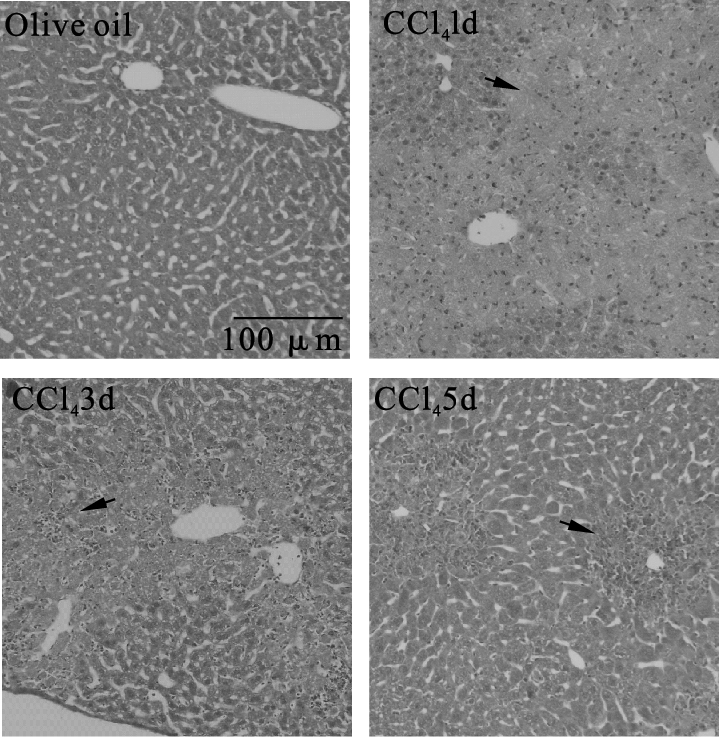
|
注:箭头表示肝损伤区域 图 2 HE染色观察小鼠肝组织病理学变化 |
2.2 CCl4诱导急性肝损伤小鼠TGF-β1水平变化(图 3、4)
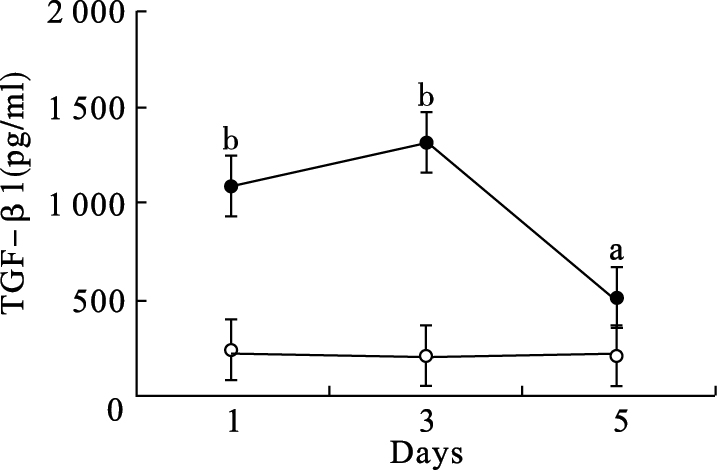
|
注:○橄榄油对照鼠;●CCl4处理鼠;与橄榄油对照组比较,a P<0.05,b P<0.01。 图 3 小鼠外周血TGF-β1水平变化 |
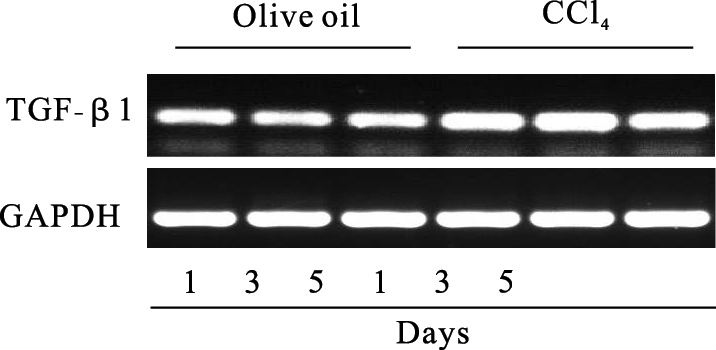
|
图 4 小鼠肝组织TGF-β1 mRNA表达变化 |
结果显示,1 d及3 d的CCl4模型组小鼠血清TGF-β1水平明显升高,5 d开始下降。RT-PCR结果显示,CCl4模型鼠肝组织中TGF-β1 mRNA表达水平也明显高于对照组。
2.3 CCl4处理小鼠肝组织TβIIR及Smads表达(图 5)

|
图 5 小鼠肝组织TβIIR及Smad2、3 mRNA表达变化 |
Smad2、3参与了TGF-β信号传导,因此,进一步检测小鼠肝组织中TGF-βII型受体(TβIIR)及Smad2、3 mRNA表达变化。结果显示,CCl4诱导小鼠肝损伤时TβIIR及Smad2、3 mRNA表达均明显高于对照组。提示CCl4诱导小鼠急性肝损伤时TGF-β的Smads信号传导途径被活化。
3 讨论TGF-β家族由TGF-β1、TGF-β2及TGF-β3等组成,其中TGF-β1在组织中表达最丰富,并在多种生理病理过程中扮演着重要角色[10-11]。TGF-β受体属于丝氨酸/苏氨酸激酶型受体,TGF-β首先与TβIIR结合,再招募和活化TGF-βI型受体(TβIR),从而激活哺乳动物果蝇Mad基因类似基因(mammalian homologs of the Drosophila Madgene,Smad)传导信号[12]。根据Smad蛋白在信号转导中的作用,可将其分为三类:膜受体激活的Smads,包括Smad 1、2、3、5和8;通用Smad,目前发现的只有Smad4;抑制性Smad,包括Smad6、7。其中Smad 1、5、8负责骨形成蛋白(bone morphogenetic protein, BMP)信号传导,Smad2、3则是TGF-β信号传导途径的重要分子,并在肝星状细胞(hepatic stellate cell, HSC)的激活及其激活后产生ECM中均发挥重要[13-14]。
大量研究表明,TGF-β1/Smads信号通路参与了多种疾病的发生发展进程,如TGF-β1可通过Smad2/3信号途径促进卵巢癌的迁移[15];在肾脏纤维化过程中TGF-β1/Smad3信号传导通路具有重要意义[16];在慢性肝脏疾病及肝纤维中TGF-β1/Smad3信号通路亦发挥重要作用[17]。但TGF-β1蛋白在CCl4诱导急性肝损伤时的表达以及Smads信号传导通路活化情况仍不明确。因此,本实验通过建立CCl4诱导的小鼠肝损伤模型,探讨了TGF-β1及Smad2、3在CCl4诱导的急性肝损伤过程中的表达变化。研究显示,CCl4诱导小鼠急性肝损伤时,血清转氨酶ALT及AST水平明显高于对照小鼠,肝组织HE染色病理分析也显示,CCl4模型鼠肝组织出现大面积坏死,并有炎细胞浸润,表明实验成功建立了CCl4诱导的小鼠急性肝损伤模型。进一步研究发现,CCl4诱导小鼠急性肝损伤时,不仅血清TGF-β1水平升高,肝组织TGF-β1 mRNA表达水平也升高;研究同时显示,CCl4诱导的急性肝损伤小鼠肝组织中TβIIR及Smad2、3 mRNA表达水平亦明显高于对照组,提示CCl4诱导小鼠急性肝损伤时不仅TGF-β1蛋白水平升高,其下游信号传导Smads途径也被激活。
综上所述,CCl4诱导小鼠急性肝损伤时TGF-β1表达水平升高,下游信号蛋白Smad2、3表达亦增加,由于TGF-β1具有抑制肝细胞增殖等作用,因此,本研究认为TGF-β1参与了CCl4诱导小鼠急性肝损伤过程。
| [1] | Yao Q, Lin Y, Li X, et al. Curcumin ameliorates intrahepatic angiogenesis and capillarization of the sinusoids in carbon tetrachloride-induced rat liver fibrosis[J]. Toxicology Letters, 2013, 222 (1) :72–82 . |
| [2] | Cheng JC, Chang HM, Fang L, et al. TGF-beta1 up-regulates connexin 43 expression:a potential mechanism for human trophoblast cell differentiation[J]. Journal of Cellular Physiology, 2015, 230 (7) :1558–1566 . |
| [3] | Suzuki E, Ochiai-Shino H, Aoki H, et al. Akt activation is required for TGF-β1-induced osteoblast differentiation of MC3T3-E1 pre-osteoblasts[J]. PLoS One, 2014, 9 (12) :e112566. |
| [4] | Akhmetshina A, Palumbo K, Dees C, et al. Activation of canonical Wnt signalling is required for TGF-β-mediated fibrosis[J]. Nature Communications, 2012, 3 :735. |
| [5] | Li T, Zhao S, Song B, et al. Effects of transforming growth factorβ-1 infected human bone marrow mesenchymal stem cells on high-and low-metastatic potential hepatocellular carcinoma[J]. European Journal of Medical Research, 2015, 20 :56. |
| [6] | Porowski D, Wirkowska A, Hryniewiecka E, et al. Liver failure impairs the intrahepatic elimination of interleukin-6, tumor necrosis factor-alpha, hepatocyte growth factor, and transforming growth factor-beta[J]. BioMed Research International, 2015, 2015 :934065. |
| [7] | Ozaki I, Hamajima H, Matsuhashi S, et al. Regulation of TGF-β1-induced pro-apoptotic signaling by growth factor receptors and extracellular matrix receptor integrins in the liver[J]. Frontiers in Physiology, 2011, 2 :78. |
| [8] | Muñoz-Félix JM, Perretta-Tejedor N, Eleno N, et al. ALK1 heterozygosity increases extracellular matrix protein expression, proliferation and migration in fibroblasts[J]. Biochimica et Biophysica Acta-Molecular Cell Research, 2014, 1843 :1111–1122 . |
| [9] | Park SA, Kim MJ, Park SY, et al. EW-7197 inhibits hepatic, renal, and pulmonary fibrosis by blocking TGF-β/Smad and ROS signaling[J]. Cellular and Molecular Life Sciences, 2015, 72 :2023–2039 . |
| [10] | Dooley S, Ten Dijke P. TGF-βin progression of liver disease[J]. Cell and Tissue Research, 2012, 347 :245–256 . |
| [11] | Shukla SK, KhatoonJ, Prasad KN, et al. Transforming growth factor beta 1(TGF-β1)modulates Epstein-Barr virus reactivation in absence of Helicobacter pylori infection in patients with gastric cancer[J]. Cytokine, 2016, 77 :176–179 . |
| [12] | Feng XH, Derynck R. Specificity and versatility in TGF-βsignaling through Smads[J]. Annual Review of Cell and Developmental Biology, 2005, 21 :659–693 . |
| [13] | Khimji AK, Shao R, Rockey DC. Divergent transforming growth factor-βsignaling in hepatic stellate cells after liver injury:functional effects on ECE-1 regulation[J]. American Journal of Pathology, 2008, 173 :716–727 . |
| [14] | Schnabl B, Kweon YO, Frederick JP, et al. The role of Smad3 in mediating mouse hepatic stellate cell activation[J]. Hepatology, 2001, 34 :89–100 . |
| [15] | Qiu X, Cheng JC, Zhao J, et al. Transforming growth factor-βstimulates human ovarian cancer cell migration by up-regulating connexin43 expression via Smad2/3 signaling[J]. Cellular Signalling, 2015, 27 :1956–1962 . |
| [16] | Meng XM, Tang PM, Li J, et al. TGF-β/Smad signaling in renal fibrosis[J]. Frontiers in Physiology, 2015, 6 :82. |
| [17] | Matsuzaki K, Seki T, Okazaki K. TGF-βsignal shifting between tumor suppression and fibro-carcinogenesis in human chronic liver diseases[J]. Journal of Gastroenterology, 2014, 49 :971–981 . |
 2016, Vol. 32
2016, Vol. 32


