2. 中南大学代谢内分泌研究所
非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)是指除酒精及其他明确肝损害因素所致的,以弥漫性肝细胞大泡性脂肪变为主要特征的临床病理综合征。其发病受年龄、性别、肥胖程度以及绝经等因素影响。流行病学调查显示,与绝经前女性相比,绝经后女性NAFLD发病率迅速增加,非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)进展亦明显加速[1-3],而雌激素替代治疗对绝经后女性NAFLD发生具有保护作用[4],但具体机制尚不清楚。本研究以去卵巢大鼠为研究对象,观察雌激素干预后去卵巢大鼠肝脂肪变、肝组织炎症状况,检测雌激素干预后肝组织炎性细胞因子,如肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)、白介素-6(interleukin-6,IL-6)和单核细胞趋化蛋白-1(monocyte chiotactic protein 1,MCP-1)水平变化,旨在探讨雌激素对去卵巢大鼠肝保护作用及机制。结果报告如下。
1 材料与方法 1.1 主要试剂与仪器补佳乐(法国DELPHARM LilleS.A.S公司),每片含1 mg戊酸雌二醇。大鼠TNF-ɑ、IL-6、MCP-1 ELISA试剂盒(武汉伊莱瑞特生物科技有限公司),空腹血糖(fasting blood sugar, FBS)、总胆固醇(total chodesterol, TC)、甘油三酯(triglycenide, TG)、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)试剂盒(北京利德曼生物技术有限公司)。贝克曼AU5400全自动生化分析仪(美国Beckman公司),Leica EG1150H包埋机、Leica RM2235切片机(德国Leica公司),雷杜RT6000酶标仪(深圳雷杜生命科学股份有限公司)。
1.2 实验动物6周Sprgue-Dawley(SD)雌性大鼠45只,体重(200±20)g,由青岛药品研究所实验动物中心提供,生产许可证号:SCXK(鲁)2014-0001。分笼饲养,室温23~25℃,相对湿度50%~70%,清洁环境饲养,自由摄水,摄入普通饲料。
1.3 分组与处理大鼠适应性喂养1周后,随机分为3组(每组15只):假手术组、手术组和雌二醇组,手术组与雌二醇组大鼠行双侧卵巢切除术,术后1周美蓝染色观察阴道上皮细胞,如无动情周期变化则确定去势成功,术后1周,雌二醇组大鼠每天灌胃戊酸雌二醇水溶液,剂量为1 mg/kg,其他组大鼠给予相应体积的蒸馏水,连续12周,每周称重1次,按体重调整药量。给药结束后,大鼠禁食12 h后,称量体重,腹腔注射10%水合氯醛溶液麻醉,把大鼠固定于手术台上,腹主动脉取血,以4 000 r/min离心10 min分离血清,-20℃保存;打开腹腔,完整剥离肝脏,冰盐水冲洗,滤纸吸干,电子天平称重,并完整剥离内脏脂肪,称重。在冰浴条件下,切取肝右叶约100 mg置于多聚甲醛固定液中,用于肝脏病理学检查;再切取肝右叶约200 mg保存清洁干燥的微量离心管中,于-80℃冰箱保存备用。
1.4 指标与方法 1.4.1 胰岛素耐量试验大鼠禁食12 h,将0.05 U/kg人工合成胰岛素注入麻醉大鼠腹腔内,分别于注射前、注射后每3 min尾静脉取血,葡萄糖氧化酶法测定血糖值,共6次,计算葡萄糖利用常数(glucose disposal constant ki,KITT),KITT为下降血糖值的自然对数与对应时间值的直线回归系数乘以100。
1.4.2 肝脏组织病理学检查肝组织置于4%多聚甲醛固定液中,固定后常规石蜡包埋,5μm厚连续切片,常规苏木素-伊红(hiatoxylin and eosin,HE)染色,于200倍光镜下观察各组大鼠肝脏组织形态学改变,并根据2010年《非酒精性脂肪性肝病诊疗指南》[5]对肝组织进行NAFLD程度分级:(1)肝细胞脂肪变性分级:0:< 5%;1:5%~33%;2:33%~66%;3:> 66%;(2)小叶内炎症分级(20倍镜计数坏死灶):0:0个/视野;1:< 2个/视野;2:2~4个/视野;3:> 4个/视野。
1.4.3 血清生化指标检测氧化酶法测定大鼠血清中总胆固醇含量,甘油氧化酶法测定大鼠血清中甘油三酯含量;应用全自动生化分析仪酶法测定血清中ALT、AST水平,严格按照试剂盒说明书进行操作。
1.4.4 肝组织炎性因子TNF-α、IL-6和MCP-1含量测定取部分肝组织,称重后剪碎,将剪碎的组织与磷酸缓冲盐溶液(phosphate buffer saline,PBS)按1:9的重量体积比,超声破碎制成匀浆,5 000 g离心10 min,取上清采用ELISA法检测肝组织TNF-α、IL-6和MCP-1含量。每孔中分别加入标准品和上清液100μL,37℃孵育90 min,倒去孔内液体,加入100μL生物素化抗体工作液,37℃孵育60 min,洗涤后加入100μL酶结合物工作液,37℃孵育30 min,洗涤后加入90μL底物溶液,37℃孵育15 min加入50μL终止液,立即在450 nm波长处测量吸光度(A)值。
1.5 统计分析采用SPSS 17.0软件进行统计分析,计量资料以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用最小显著差法检验;计数资料比较采用χ2检验,P < 0.05为差异有统计学意义。
2 结果 2.1 雌激素对大鼠体重等生长发育指标影响(表 1)| 表 1 雌激素对大鼠体重等生长发育指标影响(g,x±s,n=15) |
与假手术组比较,手术组大鼠体重、肝重、内脏脂肪重量明显升高,差异有统计学意义(P < 0.05);与手术组比较,雌二醇组大鼠体重、肝重、内脏脂肪重量明显下降,差异有统计学意义(P < 0.05)。
2.2 雌激素对大鼠血液生化指标影响(表 2)| 表 2 雌激素对大鼠血液生化指标影响(x±s,n=15) |
与假手术组比较,手术组大鼠血清ALT、AST水平明显升、KITT明显降低,差异有统计学意义(P < 0.05);与手术组比较,雌二醇组大鼠血清ALT、AST水平明显降低、KITT明显升高,差异有统计学意义(P < 0.05)。
2.3 雌激素对大鼠肝脏组织学影响(图 1)
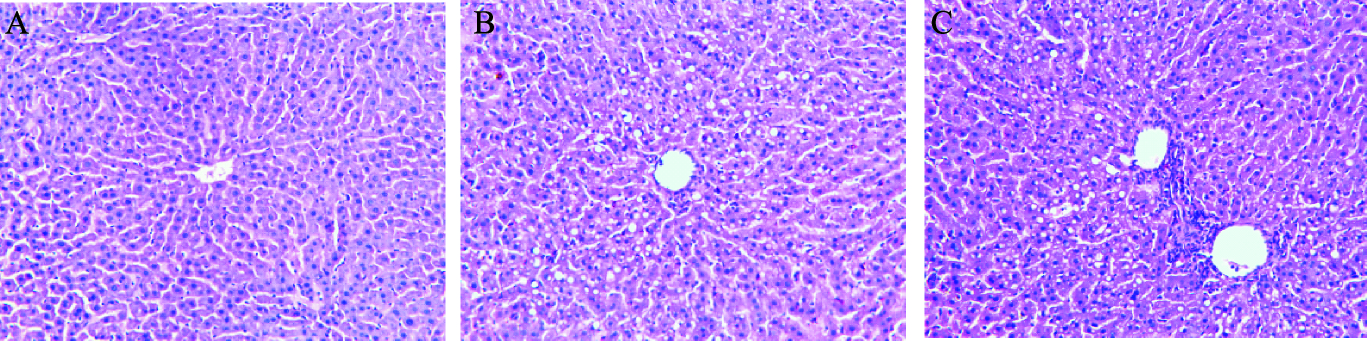
|
注:A:假手术组;B:手术组;C:雌二醇组。 图 1 雌激素对大鼠肝脏形态学影响(HE,×200) |
假手术组大鼠肝小叶结构清晰,细胞排列呈条索状,小叶及汇管区无炎症细胞浸润(图 1A);手术组大鼠肝小叶结构模糊,肝索排列紊乱,有广泛的脂滴形成,部分融合成较大脂滴,小叶内及汇管区可见炎症细胞浸润(图 1B);雌二醇组大鼠肝组织学病变明显改善,肝小叶结构仍欠清晰,脂滴明显减少,且脂滴形态明显变小(图 1C)。与假手术组比较,手术组大鼠肝脂肪变程度及小叶内炎症程度均明显增加;与手术组比较,雌二醇组大鼠肝脂肪变程度及小叶内炎症程度均明显减轻。
2.4 雌激素对大鼠肝组织炎性细胞因子含量影响(表 3)| 表 3 雌激素对大鼠肝组织炎性细胞因子含量影响(pg/mL,x±s,n=15) |
与假手术组比较,手术组大鼠肝组织匀浆中TNF-α、IL-6、MCP-1含量明显升高(P < 0.05);与手术组比较,雌二醇组大鼠肝组织中TNF-α、IL-6、MCP-1含量明显降低(P < 0.05)。
3 讨论研究证实,雌激素与雌激素受体α(estrogen receptorα,ERα)结合后,可激活miR-125b表达,而miR-125b可抑制HepG2细胞和原代小鼠肝细胞脂质积聚[6]。无论是人类还是去势啮齿类动物,ERα基因突变或敲除,亦或芳香化酶缺乏所致的雌激素信号通路完全阻断均可促进肝脏脂肪积聚和肝脏脂肪浸润[7-8]。ERα受体基因多态性与脂肪组织的堆积,尤其是内脏脂肪组织的堆积密切相关[9-10]。雌激素缺乏可导致体重增加和体内脂肪的再分配,特别是内脏脂肪的蓄积,进而影响NAFLD的发生和发展[11-12]。本研究结果显示,去卵巢大鼠体重、肝重、内脏脂肪重量均明显增加,肝脏存在明显的脂肪变性和炎症细胞浸润,血清中ALT和AST水平明显升高,雌激素干预后上述各指标均明显改善。这与Liao等[13]研究结果相似。提示,雌激素对去卵巢大鼠肝脂肪变及其所致的肝损害具有一定保护作用。
胰岛素抵抗是导致肝脂肪变性的始动环节,主要通过脂解作用和高胰岛素血症2种机制导致肝细胞脂质沉积。本研究结果显示,手术组大鼠KITT较假手术组明显降低。提示,去卵巢所致雌激素缺乏可导致胰岛素敏感性下降。这与已有研究结果一致[14]。炎性细胞因子参与NAFLD的发生和发展。胰岛素抵抗、线粒体功能障碍等原因导致的氧化应激可激活核转录因子-κB(nuclear factor kappa B, NF-κB)和c-Jun氨基末端激酶炎症通路,促进TNF-α、IL-6、IL-1β等炎性因子的产生,过量炎症因子进一步刺激细胞产生大量活性氧(reactive oxygen species, ROS),ROS进一步刺激NF-κB产生大量的炎症因子,形成恶性循环,引起肝细胞脂肪变性、炎症和坏死。de Medeiros等[15]研究发现,去卵巢大鼠血清IL-6和TNF-α水平明显增加,而雌激素替代治疗后血清IL-6和TNF-α水平下降。雌激素可通过不同机制发挥抗炎作用[16-19]。外源性雌激素可通过髓样分化因子88依赖IL-6信号通路,减轻蛋氨酸-胆碱缺乏饮食诱导的C57/BL6小鼠肝脏炎症程度及血清ALT和AST水平[16],还可通过抑制p38丝裂原活化蛋白激酶磷酸化和阻断NF-κB的激活,抑制脂多糖诱导的巨噬细胞IL-6的合成[18]。本研究结果显示,手术组大鼠肝组织炎性因子TNF-α、IL-6和MCP-1水平明显高于假手术组,雌二醇组大鼠肝组织炎性因子水平则明显低于手术组。提示,雌激素可通过下调炎性因子表达,发挥改善肝细胞脂肪变性和抑制肝内炎症作用。
| [1] | Hamaguchi M, Kojima T, Ohbora A, et al. Aging is a risk factor of nonalcoholic fatty liver disease in premenopausal women[J]. World J Gastroenterol, 2012, 8 (3) :237–243 . |
| [2] | Ryu S, Suh BS, Chang Y, et al. Menopausal stages and non-alcoholic fatty liver disease in middle-aged women[J]. Eur J Obstet Gynecol Reprod Biol, 2015, 190 :65–70 . |
| [3] | Yang JD, Abdelmalek MF, Pang H, et al. Gender and menopause impact severity of fibrosis among patients with nonalcoholic steatohepatitis[J]. Hepatology, 2014, 59 (4) :1406–1414 . |
| [4] | McKenzie J, Fisher BM, Jaap AJ, et al. Effects of HRT on liver enzyme levels in women with type 2 diabetes:a randomized placebo-controlled trial[J]. Clin.Endocrinol, 2006, 65 :40–44 . |
| [5] | 中华医学会肝病学分会脂肪肝和酒精性肝病学组. 非酒精性脂肪性肝病诊疗指南(2010年修订版)[J]. 中华肝脏病杂志,2010,18 (03) :163–166. |
| [6] | Zhang ZC, Liu Y, Xiao LL, et al. Upregulation of miR-125b by estrogen protects against non-alcoholic fatty liver in female mice[J]. J Hepatol, 2015, 63 (6) :1466–1475 . |
| [7] | Ribas V, Nguyen MT, Henstridge DC, et al. Impaired oxidative metabolism and inflammation are associated with insulin resistance in ER alpha deficient mice[J]. Am J Physiol Endocrinol Metab, 2010, 298 :E304–E319 . |
| [8] | Bryzgalova G, Gao H, Ahren B, et al. Evidence that oestrogen receptor alpha plays an important role in the regulation of glucose homeostasis in mice:insulin sensitivity in the liver[J]. Diabetologia, 2006, 49 :588–597 . |
| [9] | Nilsson M, Dahlman I, Rydén M, et al. Oestrogen receptorαgene expression levels are reduced in obese compared to normal weight females[J]. Int J Obes(Lond), 2007, 31 (6) :900–907 . |
| [10] | Okura T, Koda M, Ando F, et al. Association of polymorphisms in the estrogen receptor alpha gene with body fat distribution[J]. Int J Obes Relat Metab Disord, 2003, 27 (9) :1020–1027 . |
| [11] | Mittendorfer B, Patterson BW, Klein S. Effect of sex and obesity on basal VLDL-triacylglycerol kinetics[J]. Am J Clin Nutr, 2003, 77 :573–579 . |
| [12] | 吴俊霞, 崔睿, 王益君, 等. 雌激素对大鼠体重及水-甘油通道蛋白表达影响[J]. 中国公共卫生,2014,30 (10) :1276–1278. |
| [13] | Liao CC, Chiu YS, Chiu WC, et al. Proteomics analysis to identify and characterize the molecular signatures of hepatic steatosis in ovariectomized rats as a model of postmenopausal status[J]. Nutrients, 2015, 7 (10) :8752–8766 . |
| [14] | 袁涛, 李娟, 赵维纲, 等. 雌激素对小鼠胰岛素敏感性及脂肪因子的影响[J]. 中国医学科学院学报,2015,37 (03) :269–273. |
| [15] | de Medeiros AR, Lamas AZ, Caliman IF, et al. Tibolone has anti-inflammatory effects in estrogen-deficient female rats on the natriuretic peptide system and TNF-alpha[J]. Regul Pept, 2012, 179 (1-3) :55–60 . |
| [16] | Pratap UP, Sharma HR, Mohanty A, et al. Estrogen upregulates inflammatory signals through NF-κB, IFN-γ, and nitric oxide via Akt/mTOR pathway in the lymph node lymphocytes of middle-aged female rats[J]. Int Immunopharmacol, 2015, 29 (2) :591–598 . |
| [17] | Ganesan K1, Balachandran C, Manohar BM, et al. Effects of testosterone, estrogen and progesterone on TNF-αmediated cellular damage in rat arthritic synovial fibroblasts[J]. Rheumatol Int, 2012, 32 (10) :3181–3188 . |
| [18] | Xin G, Qin S, Wang S, et al. Sex hormone affects the severity of non-alcoholic steatohepatitis through the MyD88-dependent IL-6 signaling pathway[J]. Exp Biol Med(Maywood), 2015, 240 (10) :1279–1286 . |
| [19] | Liu L, Zhao Y, Xie K, et al. Estrogen inhibits LPS-induced IL-6 production in macrophages partially via the nongenomic pathway[J]. Immunol Invest, 2014, 43 (7) :693–704 . |
 2016, Vol. 32
2016, Vol. 32


