近年来,苦参的临床应用研究十分活跃。研究表明苦参具有抗肿瘤、抗氧化、抗心律失常、杀菌、抗血栓等药理作用和生物活性[1-2]。苦参有效成分是苦参碱(matrine, Mat),Mat能诱导人慢性粒细胞白血病K562细胞、人早幼粒白血病细胞HL-60细胞等白血病细胞凋亡[3-5]。本研究通过观察Mat对急性早幼粒细胞白血病(acute promyelocytic leukiia,APL)细胞株NB4细胞凋亡影响并探讨可能机制,旨在为寻找白血病治疗新靶点及基因治疗手段提供依据,结果报告如下。
1 材料与方法 1.1 主要试剂与仪器Mat(黑龙江中医药大学馈赠),纯度为92%;NB4细胞(黑龙江省血液研究所);1640培养基(美国Gibco公司, 批号:1146563);噻唑蓝[3-(4, 5-dimethyl-2-thiazolyl)-2, 5-diphenyl-2-H-tetrazolium bromide,MTT]、碘化丙啶(propidium iodide, PI)(北京索莱宝科技有限公司);Hoechst33258、核糖核酸酶A(rnase A)溶液、caspase-3、8酶检测试剂盒(江苏碧云天生物技术研究所);细胞凋亡试剂盒(美国BD公司, 批号:3352555)。CO2恒温培养箱(上海Heal Force公司);倒置显微镜、荧光显微镜(日本Olympus公司);多功能酶标仪(美国BioTek公司);流式细胞仪(美国BD公司)。
1.2 细胞培养NB4细胞在含有10%胎牛血清的1640培养液中,在37℃、5%的CO2的恒温培养箱中培养,每隔2~3 d换液、传代,收集对数生长期细胞用于实验。
1.3 指标与方法 1.3.1 细胞增殖检测采用MTT法,取对数生长期NB4细胞接种于96孔板,3×104个/孔,分别加入0.00(对照)、0.25、0.50、1.00 mg/mL Mat100μL,每组3个副孔;各组细胞置于CO2培养箱内分别培养24、48、72 h时,加入MTT 20μL,继续培养4 h;弃上清,加入二甲基亚砜100μL,摇床低速震荡20 min,使用全自动酶标仪于490 nm处测定吸光度(A)值。细胞增殖抑制率(%)=(1-实验组A值/对照组A值)×100%。
1.3.2 细胞形态学观察采用Hoechst 33258染色法,NB4细胞(1×106个/mL接种于6孔板,2 mL/孔,按1.3.1处理细胞;收集细胞于离心管中静置30 min,待细胞沉淀在离心管底部,吸取20μL细胞于载玻片上,吸取20μL Hoechst 33258染色液与细胞混匀,荧光显微镜下观察、拍照;在不同视野下计数200个细胞,每组设3个平行片,计算细胞凋亡率。
1.3.3 细胞周期检测采用流式细胞术(Flow Cytometcy Method, FCM),取对数生长期NB4细胞接种于6孔板,每孔1.5×106个细胞,分别加入0.00(对照)、0.50、1.00 mg/mL苦参碱2 mL培养48 h,每组3个副孔,500 g离心10 min收集细胞,磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗涤1次; 用300μL PBS重悬细胞,加700μL冷无水乙醇,-20℃固定24 h, 收集细胞,PBS洗涤1次,450μL PBS重悬细胞,加50μL rnaseA(2.5 mg/mL),4℃孵育30 min;取50μL PI加入细胞悬液,4℃避光孵育30 min,流式细胞仪检测。
1.3.4 细胞凋亡检测采用FCM,按1.3.3处理对数生长期细胞48 h,用冷PBS洗涤;缓冲液调整细胞密度为1×106个/mL;取100μL细胞悬液置于5 mL离心管,分别加入5μL FITC/PI;避光置15 min(25℃);加入400μL缓冲液,流式细胞仪检测。
1.3.5 caspase-3、8活性检测采用分光光度法,按1.3.3处理对数生长期细胞24 h,取出细胞600 g 4℃离心5 min, 弃上清,PBS洗涤1次;裂解液重悬细胞,使其细胞数为2×106个/100μL,4℃冰浴裂解15 min;20 000 g 4℃离心15 min,取上清于冰浴预冷的离心管中,按检测试剂盒说明书操作,测得吸光度(A)值,根据测定的pNA标准曲线,计算各组细胞产生的pNA, 以此反应caspase-3和caspase-8酶活性。
1.4 统计分析计量数据以x±s表示,采用SAS 9.13和SPSS 19.0软件进行统计分析,多组间比较采用方差分析,相关性采用Spearman分析,P < 0.05为差异有统计学意义;采用GraphPad Prism 5软件作图。
2 结果 2.1 Mat对NB4细胞增殖影响(表 1)| 表 1 苦参碱对NB4细胞增殖抑制率影响(%) |
与对照组比较,各剂量Mat组NB4细胞增殖明显受到抑制,呈剂量、时间-效应关系(P < 0.05)。
2.2 Mat对NB4细胞形态影响(图 1)
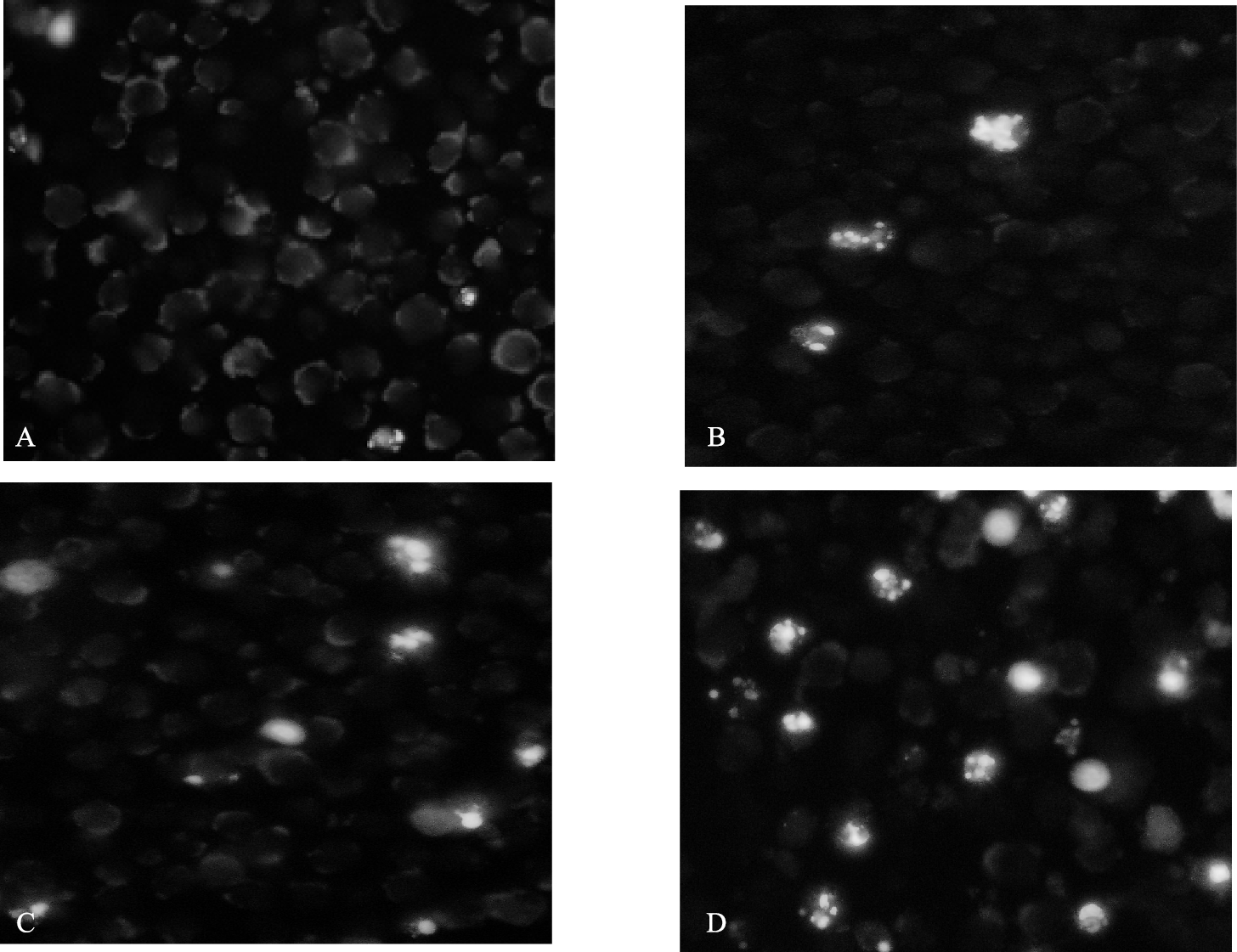
|
注:A:对照组;B、C、D:苦参碱0.25、0.50、1.00 mg/mL组。 图 1 Mat对NB4细胞形态影响(48 h) |
Mat处理NB4细胞24 h时,与对照组比较,1.0 mg/mL组细胞体积缩小,核固缩,细胞核呈现致密浓染或呈碎块状致密浓染,荧光聚集,细胞凋亡增加(P < 0.05);Mat处理NB4细胞48 h时,与对照组比较,0.5、1.0 mg/mL Mat组凋亡细胞明显增多(P < 0.05);Mat处理NB4细胞72 h时,各剂量Mat组细胞凋亡均明显增加(P < 0.05)。
2.3 Mat对NB4细胞周期影响对照组、Mat 0.50、1.00 mg/mL组NB4细胞G0/G1期细胞百分率分别为43.93%、57.91%、83%,S期细胞百分率分别为53.77%、40.95%、16.10%;与对照组比较,Mat 0.50、1.00 mg/mL组NB 4细胞G0/G1期细胞比例明显增加、S期减少(P < 0.05),提示NB4细胞发生G0/G1期阻滞。
2.4 Mat对NB4细胞凋亡影响结果显示,Mat 0.5、1.0 mg/mL作用NB4细胞48 h,细胞凋亡率分别为37.3%、46.08%,明显高于对照组的8.30%,差异有统计学意义(P < 0.05)。
2.5 Mat对NB4细胞内caspase酶活性影响(表 2)| 表 2 Mat对NB4细胞内caspase活性影响(x±s) |
结果显示,与对照组比较,随着Mat浓度升高,NB4细胞内caspase-3和caspase-8酶活性增强,差异有统计学意义(P < 0.05)。
3 讨论研究表明,Mat可使HL-60细胞、K562细胞、急性T淋巴母细胞白血病细胞株JM细胞周期发生阻滞,从而抑制细胞增殖并促进细胞凋亡[4-6],发挥抑制肿瘤细胞增殖、转移,诱导细胞分化、凋亡等作用[7-10],其机制与下调细胞增殖基因,启动Fas/FasL系统,影响DNA甲基化等途径有关[11-12]。临床研究表明,Mat与抗肿瘤药物长春新碱,白细胞介素-2以及强的松等的联合使用,治疗白血病也获得了较好效果[13-15]。本研究结果显示,Mat对NB4细胞的生长抑制呈时间和剂量依赖关系,在不同浓度、不同时间处理下,细胞体积缩小,核固缩等典型的凋亡细胞逐渐增多;随Mat浓度升高,G0/G1期细胞比例明显增加,S期细胞比例减少。提示Mat通过抑制NB4细胞内DNA合成,阻断细胞有丝分裂,从而起到抑制细胞增殖作用。
参与细胞凋亡的Caspase家族分为三大类:一类为启动酶,包括caspase-8、caspase-9、caspase-2等,在细胞凋亡的上游发挥作用;一类为效应酶,包括capsase-3、capsase-7等,其中caspase-3可以被多种因素活化,在细胞凋亡中起着不可替代的作用,参与调控细胞凋亡的下游;一类主要参与细胞因子介导炎症反应并在死亡受体介导的细胞凋亡中起辅助作用,包括capsase-1,caspase-4等。capsase酶在正常细胞内以无活性状态存在,当细胞发生凋亡时激活,通过活化capsase-8,进而激活caspase-3从而启动capsase级联反应[16]。本研究结果表明,Mat可使caspase-3和caspase-8活性增强,其活性随着Mat浓度增加逐渐增强。与有关文献结果一致[17]。
综上所述,Mat具有抑制NB4细胞增殖并诱导细胞凋亡作用,其机制可能与Mat使细胞发生G0/G1期阻滞,启动caspase-3和caspase-8的凋亡途径有关。
| [1] | 何礼, 尚剑. 苦参抗肿瘤机制的研究进展[J]. 中医药信息,2012,29 (4) :175–176. |
| [2] | 王长中, 程惠娟, 官妍, 等. 苦参碱对体外白念珠菌生物膜抑制作用[J]. 中国公共卫生,2008,24 (12) :1491–1492. |
| [3] | 向秋, 王建红, 黄艳红, 等. 苦参碱抗急性髓性白血病[J]. 华夏医学,2004,17 (1) :10–11. |
| [4] | 吕晓霞, 蒋丽佳, 范静, 等. 苦参碱抑制慢性粒细胞白血病K562细胞生长和诱导凋亡作用的研究[J]. 现代中西医结合杂志,2010,19 (2) :147–150. |
| [5] | 李玉红, 许浪, 晏丹, 等. 苦参碱对HL-60细胞增殖与分化影响的实验研究[J]. 时珍国医国药,2010,21 (9) :2385–2386. |
| [6] | Feng JL, Huang GS, Zhang YQ, et al. Matrine effects on JM cells by inhibiting proliferation and inducing apoptosis[J]. Zhongguo Zhong Yao Za Zhi, 2003, 28 (5) :437–442 . |
| [7] | Zhang LP, Jiang JK, Tam JW, et al. Effects of matrine on proliferation and differentiation in K-562 cells[J]. Leukemia Research, 2001, 25 (9) :793–800 . |
| [8] | Zhou H, Lutterodt H, Cheng Z, et al. Anti-inflammatory and anti-proliferative activities of trifolirhizin, a flavonoid from Sophora flavescens roots[J]. J Agric Food Chem, 2009, 57 (11) :4580–4585 . |
| [9] | 刘北忠, 蒋纪恺, 何於娟, 等. 苦参碱诱导K562细胞磷脂酶A2活性与表达的改变[J]. 实用癌症杂志,2002,17 (5) :460–462. |
| [10] | 徐广伟, 满世军, 王志生, 等. 氧化苦参碱对荷瘤小鼠免疫功能的影响[J]. 中国肿瘤临床与康复,2001,8 (5) :9–10. |
| [11] | 张永清, 黄高昇, 刘红娟, 等. 苦参碱诱导K562细胞分化方向的研究[J]. 肿瘤学杂志,2004,10 (1) :25–27. |
| [12] | 朱宁希, 罗文纪, 吕庆华, 等. 苦参碱对白血病细胞诱导分化作用和机理研究[J]. 上海中医药大学学报,2001,15 (1) :43–44. |
| [13] | 邢玉. DOLP方案联合苦参碱治疗成人急性淋巴细胞白血病[J]. 药物与临床,2009,16 (5) :41–42. |
| [14] | 费新红, 许小平, 陈莉, 等. 白细胞介素-2和苦参碱对小鼠微小残留白血病的治疗作用[J]. 白血病·淋巴瘤,2006,15 (1) :4–6. |
| [15] | 苏永忠, 谢建英, 朱文捷, 等. 苦参碱联合化疗治疗急性淋巴细胞白血病疗效分析[J]. 临床和实验医学杂志,2008,7 (7) :7–8. |
| [16] | 赵瑞杰, 李引乾, 王会, 等. Caspase家族与细胞凋亡的关系[J]. 中国畜牧杂志,2010,46 (17) :73–78. |
| [17] | 岳磊.Caspase-3, 8, 9在莱菔硫烷诱导人腺样囊性癌细胞系ACC-M凋亡中的作用[D].河北, 河北医科大学硕士论文, 2012:1-47. |
 2016, Vol. 32
2016, Vol. 32


