2. 南昌大学公共卫生学院
研究表明人体早年发育时期和晚年防御代偿减退时期是大脑最易受损的2个阶段,且这2个时期存在关联性,即早年发育时期受到的损伤到晚年之后开始变得明显[1-3]。研究发现环境铅可对早年神经发育产生影响,导致学习认知障碍和智力下降;在晚年发病率增高的神经退行性疾病(neurodegenerative diseases,NDs)如阿尔茨海默病(Alzheimer's disease,AD),其主要症状也是记忆力进行性减退伴有不同程度的认知、语言和人格方面异常,且病变部位与铅致幼年智力损伤部位均以海马为主[4-7]。目前人们对环境中铅暴露致幼年脑损伤已有较详细研究,而对于铅致晚年老化大脑的研究则较少。本研究旨在观察长期铅暴露致大鼠海马神经退行性改变相关的淀粉样前体蛋白(amyloid precursor protein,APP)和tau基因及蛋白表达影响,探讨铅暴露与神经退行性疾病关系。结果报告如下。
1 材料与方法 1.1 主要仪器与试剂Mastercycler personal PCR扩增仪(德国Eppendorf公司),7500实时荧光定量PCR仪(美国ABI公司),MULTISKAN MK3酶标仪(美国Thermo公司),电泳仪、电泳槽及转膜槽(北京六一仪器厂),OPT MA 5300DV仪(美国PerkinElmer公司),SmartSpec plus核酸蛋白测定仪(美国BIO-RAD公司)。三水合乙酸铅(分析纯,天津基准化学品试剂有限公司),铅标准物质(GSB04-1712-2007,国家标准物质研究中心);逆转录试剂盒(DRR037A)、real time PCR试剂盒(DRR041)、APP引物(上游5'-CCCTGATCAGTGGGTGTCTAGGA-3'、下游5'-GGCATCGCTTACAAACTCACCA-3'),tau引物(上游5'-CCTGAGCAAGGTGACCTCCAA-3'、下游5'-GGGACATGGGTGATGTTATCCAA-3'),β-actin引物(上游5'-GGAGATTACTGCCCTGGCTCCTA-3 '、下游5'-GACTCATCGTACTCCTGCTTGCTG-3')(大连宝生物有限公司);硝酸纤维素膜(0.45μm,美国Amersham Biosciences公司);ECL发光试剂盒(美国Thermo公司)。
1.2 动物分组与处理性成熟SPF级SD雌性大鼠40只和雄性大鼠20只,购自上海西普尔-必凯实验动物有限公司,许可证号SCXK(沪)2013-0016,合格证编号2008001600571,体重220~250 g;饲养室温为20~25℃,明暗比为12 h/12 h,实验期间,动物可自由摄食饮水。将雌性大鼠随机分为3组,分别为对照组,低、高剂量铅组,对照组大鼠饮用去离子水,低、高剂量铅组大鼠分别饮用800、1500 mg/L乙酸铅溶液10 d,雄性大鼠不染毒。雌、雄性大鼠按2:1合笼,雌鼠观察到阴栓后21 d仔鼠降生并选择雄性仔鼠母乳喂养至断乳,雄性仔鼠随机分为对照组、低、高剂量铅组,每组60只,分别饮用去离子水、300、900 mg/L乙酸铅溶液。仔鼠分别饲养至断乳期[出生后3周(postnatal week 3, PNW3)]、中年期(PNW41)、老年期(PNW70),取材检测各指标。
1.3 指标与方法 1.3.1 大鼠血液及海马组织中铅含量测定每组仔鼠11只,取股静脉血1 mL于含有2.5 mL 10%硝酸的驱铅塑料试管中,4℃消化3 d,离心取上清液,采用电感耦合等离子体发射光谱(inductively coupled plasma atomic iission spectrometry, ICP-AES)检测血中铅元素含量。分离脑组织,取海马0.2 g加入65%硝酸3 mL冷消化3 d,加1 mL 30%过氧化氢冷消化4 h,置于电热板上热消化,直至样品变为白色沉淀后,用2%硝酸溶解沉淀后,采用ICP-AES检测组织中铅元素含量。
1.3.2 仔鼠海马APP与tau mRNA水平检测每组仔鼠7只,用手术剪剪开大鼠头部皮肤(呈T字型切口),持骨钳快速开取大鼠颅骨,分离脑组织,大脑置于驱铅平皿中,分离出双侧海马,右侧海马用Trizol法提取细胞总RNA,用紫外分光光度法测RNA浓度及纯度,按逆转录PCR(reverse transcriptase-PCR,RT-PCR)试剂盒说明书逆转录合成cDNA,PCR反应95℃30 s,95℃5 s,60℃34 s,40个循环;溶解曲线95℃15 s,60℃60 s,95℃15 s。通过ABI 7500软件导出Ct值,计算相对表达量。
1.3.3 仔鼠海马APP与tau蛋白表达水平检测每组仔鼠7只,分离左侧海马,按试剂盒说明书提取细胞总蛋白,离心取上清,二喹啉甲酸(bicinchoninic acid, BCA)法蛋白定量后,加5×蛋白上样缓冲液,煮沸5 min,-20℃保存。采用蛋白印迹(Western blot,WB),经电泳分离蛋白,电转移至硝酸纤维素膜上,5%脱脂奶粉室温封闭1 h;分别孵育一抗[APP1∶5 000,tau 1∶2 000,磷酸化tau(phospho S396)1∶5 000,β-actin 1∶5 000],4℃冰箱过夜,室温二抗(羊抗兔1∶10 000,羊抗鼠1∶5 000)孵育2 h,ECL试剂室温孵育1~20 min,扫描胶片分析,用IPP图像分析软件分析目的条带和内参条带积分光密度值。
1.4 统计分析数据以x±s表示,采用SPSS 13.0软件进行统计分析,组间比较采用方差分析,组间两两比较时,方差齐采用最小显著性差异法,方差不齐用Tamhane's T2检验,检验水准为α=0.05。
2 结果 2.1 铅暴露对仔鼠血液及海马组织铅含量影响(表 1)| 表 1 铅暴露对仔鼠血液及海马组织中铅含量影响(x±s) |
与对照组比较,各年龄仔鼠血液与海马铅含量均明显升高,差异有统计学意义(P < 0.05);呈剂量-反应关系;与PNW3比较,PNW41与PNW70海马铅含量均升高,差异有统计学意义(P < 0.05)。
2.2 铅暴露对大鼠海马APP及tau mRNA表达影响(表 2)| 表 2 铅暴露对大鼠海马APP及tau mRNA表达影响(x±s,n=7) |
与对照组比较,PNW70低、高剂量铅组仔鼠海马APP mRNA表达水明显升高,差异有统计学意义(P < 0.05);与对照组比较,PNW70高剂量铅组仔鼠海马tau mRNA表达水平有增加趋势(P=0.073)。
2.3 铅暴露对大鼠海马APP及tau蛋白表达影响(图 1、表 3)
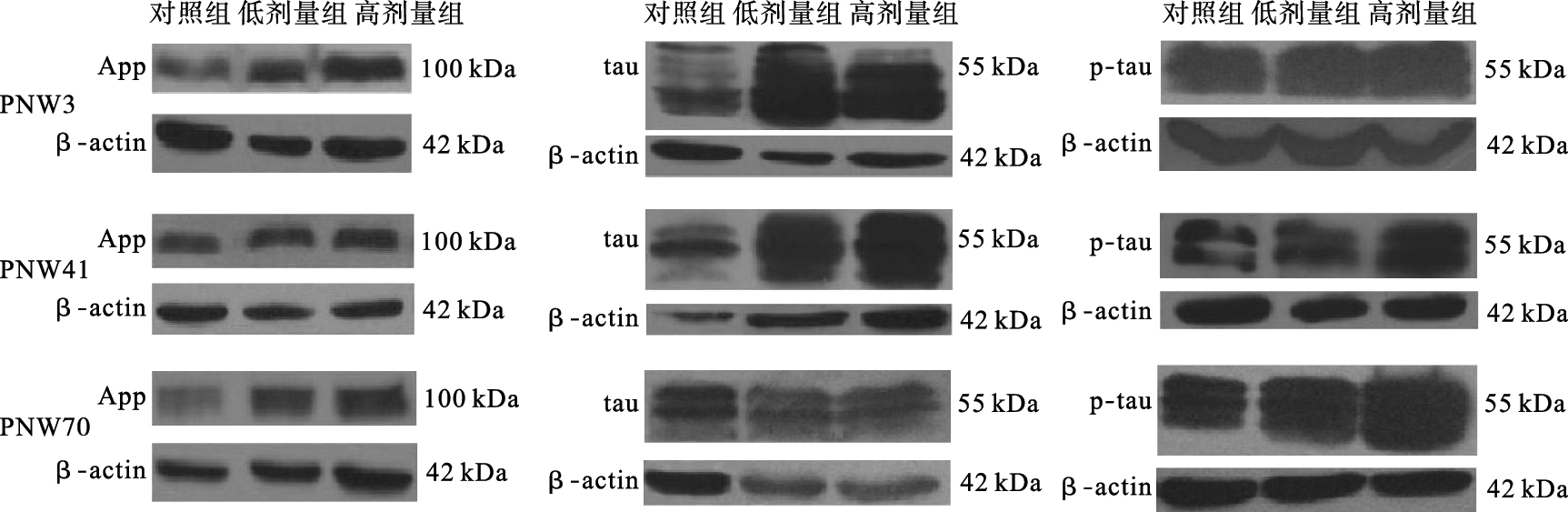
|
图 1 铅暴露对大鼠海马APP、tau、磷酸化tau(Ser396)影响 |
| 表 3 铅暴露对大鼠海马APP及tau蛋白表达影响(x±s,n=7) |
与对照组比较,高剂量铅组PNW3仔鼠海马APP蛋白表达升高(P < 0.05),低、高剂量铅组PNW3仔鼠海马tau蛋白表达升高,差异有统计学意义(P < 0.01);与对照组比较,高剂量铅组PNW70仔鼠海马APP蛋白及磷酸化tau蛋白(Ser396)表达水平明显升高,差异有统计学意义(P < 0.05)。
3 讨论铅是一种亲神经毒素,对生长发育儿童造成危害,尤其是对神经行为功能影响明显大于其他人群。研究表明,铅对儿童神经系统影响可能存在性别差异,男性更为敏感[8]。铅对儿童神经系统毒性早在出生前胎儿期暴露就开始了, 母体铅可通过胎盘进入胎儿体内,造成出生前宫内铅暴露,目前认为出生前铅暴露对儿童早期智力和行为发育影响更大[9-10]。本研究结果显示,铅暴露组仔鼠血铅含量未随着年龄增加(暴露量)而增加,可能与本研究中仔鼠一直处于铅环境下,血铅含量始终趋于平稳状态有关;中年期与老年期铅暴露组仔鼠海马铅水平明显高于断乳期,表明铅在脑组织中存在一定蓄积作用。提示铅具有很强的神经毒性,可在神经组织中蓄积,引起神经系统功能的长期损害[11];但与中年期比较,老年期仔鼠海马铅水平无明显增加,表明脑组织铅也可趋于稳定,这可能与铅最终会以难溶的磷酸铅较稳定地蓄积于骨骼中有关[12]。
阿尔茨海默病主要病理改变是老年斑和神经元纤维缠结[13],老年斑块的形成是由于β-淀粉样蛋白(amyloidβ-protein,Aβ)沉积所致,而Aβ是由淀粉样前体蛋白(APP)经β、γ分泌酶剪切得到[14-15],而神经元纤维缠结的产生是由于tau蛋白失去微管组装能力,异常的磷酸化影响tau蛋白的功能,失去微管结合能力,从而形成不溶性聚合[16]。Wu等[17]研究发现早期铅暴露老年猴子APP表达和它的转录因子Sp1增加,而李宁等[18]研究发现,母体孕哺期铅暴露可引起仔鼠海马组织中APP分解产物Aβ40表达增加。本研究结果显示,铅暴露组中仔鼠海马APP mRNA水平在老年期明显上升,同时APP蛋白表达量在老年期也随着染铅剂量增加而增加。提示,铅暴露可通过增加APP转录和翻译过程增加APP表达,APP增加总是伴随着剪切体Aβ增加,为老年斑的形成提供物质基础[19]。本研究结果显示,铅暴露组仔鼠海马tau蛋白和磷酸化tau(Ser396)蛋白在断乳期和老年期均呈上升趋势,表明tau蛋白增加可以为tau磷酸化提供原材料,可能是磷酸化增多重要原因。这与Rahman等[20]研究结果相符。APP和tau是AD的特征性基因,2者表达增加提示铅暴露仔鼠出现了神经退行性改变。
| [1] | Lahiri DK, Zawia NH, Greig NH, et al. Early-life events may trigger biochemical pathways for Alzheimer's disease:the“LEARN”model[J]. Biogerontology, 2008, 9 (6) :375–379 . |
| [2] | Bihaqi SW, Bahmani A, Subaiea GM, et al. Infantile exposure to lead and late-age cognitive decline:relevance to AD[J]. Alzheimers Dement, 2014, 10 (2) :187–195 . |
| [3] | Barone JRS, Stanton ME, Mundy WR, et al. Neurotoxic effects of neonatal triethyltin(TET)exposure are exacerbated with aging[J]. NeurobiolAging, 1999, 16 (1) :723–735 . |
| [4] | White LD, Cory-Slechta DA, Gilbert ME. New and evolving concepts in the neurotoxicology of lead[J]. Toxicol Appl Pharmacol, 2007, 225 (1) :1–27 . |
| [5] | Toscano CD, Guilarte TR. Lead neurotoxicity:from exposure to molecular effects[J]. Brain Res Brain Res Rev, 2005, 49 (3) :529–554 . |
| [6] | De Toledo-Morrell L, Dickerson B, Sullivan MP, et al. Hemispheric differences in hippocampalvolume predict verbal and spatial memory performance in patients with Alzheimer's disease[J]. Hippocampus, 2000, 10 (2) :136–142 . |
| [7] | Alzheimer's Association. 2008 Alzheimer's disease facts and figures[J]. Alzheimers Dement, 2008, 4 (2) :110–133 . |
| [8] | 毋嫘, 叶知新, 张炯理, 等. 铅污染对儿童行为与神经功能的影响[J]. 中国妇幼保健,2012,27 (10) :1582–1586. |
| [9] | Schnaas L, Rothenberg SJ, Flores MF, et al. Reduced intellectual development in children with prenatal lead exposure[J]. Environ Health perspect, 2006, 114 (5) :791–797 . |
| [10] | 韩松, 梁多宏, 张莹, 等. 宫内低水平铅暴露对新生儿神经行为及体格发育影响[J]. 中国公共卫生,2013,29 (9) :1283–1285. |
| [11] | Sun L, Zhao Z, Hu J, et al. Potential association of lead exposure during early development of mice with alteration of hippocampus nitric oxide levels and learning memory[J]. Biomedical and Environmental Sciences, 2005, 18 (6) :375–378 . |
| [12] | 金泰廙. 职业卫生与职业医学[M].6版. 北京: 人民卫生出版社, 2008 : 84 . |
| [13] | Ball MJ, Lo P. Granulovacuolar degeneration in the ageing brain and in dementia[J]. J Neuropathol Exp Neurol, 1977, 36 (3) :474–487 . |
| [14] | Esler WP, Wolfe MS. A portrait of Alzheimer secretases-new features and familiar faces[J]. Science, 2001, 293 (5534) :1449–1454 . |
| [15] | Haass C, De Strooper B. The presenilins in Alzheimer's disease-proteolysis holds the key[J]. Science, 1999, 286 (5441) :916–919 . |
| [16] | Hitomi J, Katayama T, Eguchi Y, et al. Involvement of caspase-4 in endoplasmic reticulum stress-induced apoptosis and Abeta-induced cell death[J]. J Cell Biol, 2004, 165 (3) :347–356 . |
| [17] | Wu J, Basha MR, Brock B, et al. Alzheimer's disease(AD)-like pathology in aged monkeys after infantile exposure to environmental metal lead(Pb):evidence for a developmental origin and environmental link for AD[J]. J Neurosci, 2008, 28 (1) :3–9 . |
| [18] | 李宁, 宋莲军, 张平安, 等. 铅暴露对仔鼠海马中β淀粉样蛋白40表达影响[J]. 中国公共卫生,2012,28 (9) :1205–1206. |
| [19] | Basha MR, Wei W, Bakheet SA, et al. The fetal basis of amyloidogenesis:exposure to lead and latent overexpression of amyloid precursor protein and beta-amyloid in the aging brain[J]. J Neurosci, 2005, 25 (4) :823–829 . |
| [20] | Rahman A, Khan KM, Al-Khaledi G, et al. Early postnatal lead exposure induces tau phosphorylation in the brain of young rats[J]. Acta Biol Hung, 2012, 63 (4) :411–425 . |
 2016, Vol. 32
2016, Vol. 32


