2. 内蒙古医学院
Homer蛋白属一类新的突触后致密物质(post-synaptic-density,PSD)蛋白家族成员,是一类联系突触内细胞骨架蛋白、信号蛋白的重要物质,主要分布在中枢神经系统,该蛋白对代谢型谷氨酸受体(metabotropic glutamate receptors,mGluR)在神经元细胞内转运、信号转导过程发挥重要的调控作用,并参与突触可塑性变化及学习记忆等生理过程[1]。研究表明,铅暴露可降低仔鼠海马mGluR5蛋白的表达并导致空间学习记忆能力下降[2],但mGluR的调控蛋白Homer蛋白在其中的作用尚不清楚。本研究通过建立慢性铅暴露大鼠模型,观察发育期低浓度铅暴露对仔鼠的脑海马组织Homer蛋白表达的变化以及对仔鼠被动回避反应学习记忆能力的影响,探讨发育期铅暴露影响仔鼠学习记忆能力的信号转导机制。结果报告如下。
1 材料与方法 1.1 主要试剂与仪器小鼠抗大鼠Homer-1b/c单克隆抗体(美国santa cruz公司);辣根过氧化酶标记羊抗小鼠二抗(北京中山生物技术有限公司)。ChemiImager 5500自动电泳凝胶成像分析仪(美国Apha Innotech公司);大鼠电刺激跳台仪(中国医学科学院药物研究所); AI1200原子吸收光谱仪(加拿大Aurora公司)。
1.2 实验动物与分组处理Wistar大鼠(中国医科大学动物实验中心),体重(24 020)g,许可证号:SCXK(辽)2008-0005,90 只,按雄、雌1∶2交配,以次晨发现阴栓者确定为妊娠第0天。将孕鼠随机分为3组,每组10只,分笼饲养。自怀孕第1天起分别饲以双蒸水(对照组),0.05%、0.20% 醋酸铅水溶液(低、高剂量染铅组),仔鼠断乳(生后21 d)后自行饮用与其母鼠相同饮用水,生后28 d,改饮双蒸水。
1.3 指标与方法 1.3.1 孕鼠和仔鼠一般状况观察染铅期间,每天观察大鼠一般状况,包括饮食饮水、精神状态、被毛及大小便状况,定期称量仔鼠体重。
1.3.2 仔鼠血铅、海马铅测定各组分别随机选取出生后28 d 雄性仔鼠12只,按文献[3]测定血清及脑海马铅含量。
1.3.3 跳台试验各组分别随机选取出生后56 d雄性子代大鼠12只,按文献[4]进行试验。测试装置为被动回避反应箱,箱底部有铜栅均匀分布,通36 V交流电,内设安全台供大鼠躲避电击。大鼠适应反应箱5 min后开始实验,记录大鼠首次受电击后跳上安全台所需时间(逃离潜伏期,与回避反应的获得有关)、5 min 内跳下圆台次数(错误次数),作为学习成绩。24 h 后将大鼠放至安全台,此时记下第1次跳下安全台的时间即为停留(触电)潜伏期和5 min 内跳下安全台至铜栅的次数作为小鼠的记忆成绩。如果5 min 内未跳下安全台,错误次数记录为0次,停留潜伏期记录为300 s.
1.3.4 仔鼠海马Homer-1b/c蛋白表达测定采用蛋白免疫印迹法,各组分别随机选取出生后7、14、21、28 d雄性仔鼠各10只,取海马组织,迅速置于液氮保存,待检。将样品放到4 ℃预冷的裂解缓冲液中,4 ℃超声混匀(6 s×6次),4 ℃孵育30 min,离心25 000 g,10 min×3次,取上清分装;用Bradford法测蛋白含量,以牛血清蛋白为标准管,用10%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质,每孔蛋白加样60 μg,恒压160 v电泳至胶底部,转膜,5%脱脂奶粉封闭2 h后,分别加入1:100抗大鼠homer-1b/c一抗,抗(-actin单抗,37 ℃摇床1 h,PBST(phosphate buffer solution-Twen20)洗涤3次,10 min/次,加入辣根过氧化物酶标记的羊抗兔IGg-HRP,37 ℃摇床1 h,PBST洗涤3次,10 min/次,采用化学发光剂显色,X线片暗室曝光,将蛋白印迹显影图扫描,以Homer-1b/c与相应内参(β-actin) 的灰度值比值代表相对蛋白含量。
1.4 统计分析数据采用(x±s)表示,应用SPSS 18.0软件进行统计分析,多组间比较采用单因素方差分析,两两比较用SNK-q检验,P<0.05为差异有统计学意义。
2 结 果 2.1 染铅对大鼠一般状况影响实验期间,对照组和低、高剂量铅暴露组孕鼠进食和饮水正常;各组之间孕鼠体重未见明显差异,喂养过程中未发现孕鼠有明显铅中毒症状和体征;均为自然分娩,未见畸胎和死胎。生后21、56 d时,铅暴露组与对照组仔鼠体重未见明显差异。
2.2 染铅对仔鼠血铅和海马脑铅含量影响(表 1)| 表 1 发育期铅暴露对仔鼠血铅和海马脑铅含量影响(x±s,n=12) |
于仔鼠生后28 d进行血铅和大脑海马铅含量测定,结果显示,与对照组比较,各剂量染铅组仔鼠血铅和海马铅含量明显升高,差异有统计学意义(P<0.01);与低剂量染铅组比较,高剂量染铅组仔鼠血铅和海马铅含量明显升高,差异有统计学意义(P<0.01)。
2.2 染铅对仔鼠学习记忆能力影响(表 2)| 表 2 发育期铅暴露对仔鼠学习和记忆能力影响(x±s,n=10) |
与对照组比较,仔鼠跳台试验逃离潜伏期明显长延长,停留潜伏期则明显缩短,差异有统计学意义(P<0.05),呈剂量效应关系;与对照组比较,仔鼠学习和记忆错误次数均明显升高,差异有统计学意义(P<0.05)。
2.3 染铅对仔鼠海马Homer1-b/c蛋白表达影响(图 1、表 3)
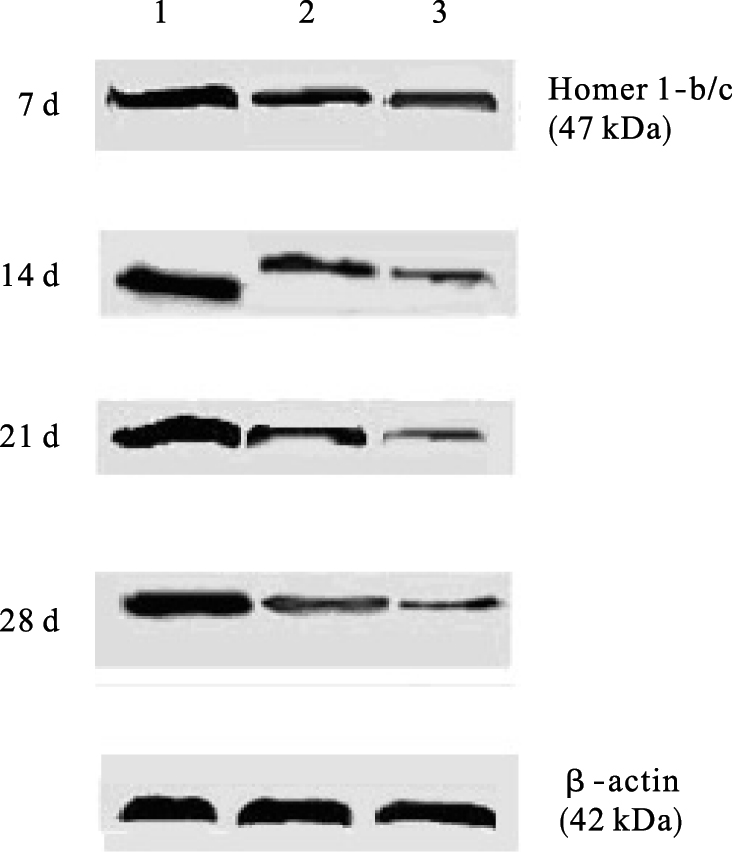
|
注:1:对照组,2、3:0.05%、0.20%醋酸铅组。 图 1 发育期铅暴露对仔鼠海马Homer1-b/c蛋白表达影响 |
| 表 3 发育期铅暴露对仔鼠海马Homer-1b/c蛋白表达影响(x±s,n=10) |
结果显示,与对照组比较,染铅组仔鼠海马Homer-1b/c蛋白表达明显下降,差异有统计学意义(P<0.01),呈剂量效应关系。
3 讨 论铅是环境中广泛存在的重金属毒物,可经呼吸道、消化道和皮肤进入人体内,引起听力及视力障碍、周围神经病变和铅毒性脑病,其中最主要的是神经毒性。胚胎及婴幼儿期对铅毒性更为敏感。本研究通过饮水途径使孕鼠和仔鼠在发育期暴露于低浓度铅,复制仔鼠铅暴露模型,结果表明与对照组比较,发育期染铅组仔鼠生后28 d时脑海马铅及血铅含量均明显升高;跳台试验结果显示,铅暴露组仔鼠学习和记忆能力下降。提示,胚胎期和发育早期铅暴露可致仔鼠成熟期(生后56 d)学习和记忆功能降低。
1997年,Brakeman首先发现Homer基因[5]。Homer基因依其序列同源可分为3种类型,即Homer 1a、1b、1c,homer 2a、2b,homer3。由366个氨基酸组成的Homer-1b/c,是Homer 1a的剪切异变体,C-末端还有2条长的亮氨酸链,形成螺旋卷曲的二级结构[6]。Homer-1b/c位于突触后,并集中在PSD结构下方,Homer-1b/c在突触边缘含量丰富,与第I组mGluRs(mGluR 1a、1b、1c、1d、1g和mGluR 5a、5b)在突触部位有相似的分布规律[7]。在皮质、海马、纹状体、嗅球和小脑组织中检测到Homer-1b/c,海马内Homer-1b/c主要分布在CA1~CA3区始层(多形层)、辐射分子层及齿状回[8]。本研究结果显示,仔鼠海马中Homer-1b/c基本在生后2周时表达量最高,这与文献[9]报道一致,这一时期是海马的神经元迁移、分化和突触发生并逐渐成熟的时期,这种表达部位和时间的一致性,可能是由于其参与了海马的发育和成熟过程,并对海马的神经环路形成、突触可塑性的维持和学习记忆能力的形成起到潜在作用,因此,Homer蛋白可以作为研究学习记忆行为失常的新指标。
mGluR5在神经系统中参与很多重要生理功能,如介导兴奋性神经信号传导和学习记忆过程中的突触传递[10]。Homer1-b/c蛋白C-末端的卷曲结构相互结合,使谷氨酸受体和细胞内的信号级联放大作用有关的蛋白聚集,形成Homer蛋白二聚体,使mGluRs和3-磷酸肌醇受体(inositol 1,4,5-trisphosphate receptor,IP3R)结合,形成mGluRs-CC-Homer-IP3R大分子复合物[11],导致胞外Ca2+内流,胞内Ca2+浓度增加[12],参与长时程增强的发生[13]。Homer1a蛋白受多种因素调节选择性阻断Homer1-b/c的C-末端的卷曲结构与Ⅰ组mGluR相结合破坏多聚复合蛋白体的形成,减少胞内Ca2+释放。mGluR5的C-端结合Homer蛋白则以Ca2+非依赖方式介导主要的细胞外信号调节激酶(extracellularsignal-regulated kinase,ERK)激活[14]。经这条通路激活的ERK可以协同刺激转录因子(transformation specific,ETS)相似基因1和环磷酸腺苷反应成分结合蛋白,从而促进 ETS相似基因1和环磷酸腺苷反应成分结合蛋白敏感基因的表达[15]。环磷酸腺苷反应成分结合蛋白表达是长时记忆的蛋白质基础。
Homer1-b/c的C端和mGluR5的N端相结合,结合其他大分子物质,形成二聚体分子,从而参与调节影响学习记忆的信号通路[6]。Homer1-b/c在mGluR5影响学习记忆的通路中主要起连接和介导的正向调节作用。本研究结果显示,在慢性低浓度铅暴露过程中,仔鼠的脑海马Homer1-b/c的表达量减少。提示,慢性低浓度铅暴露对仔鼠学习记忆能力影响可能与Homer蛋白表达下降,影响mGluR5介导的下游信号通路有关。
| [1] | Nicoletti F, Battaglia G, Storto M, et al. Metabotropic glutamate receptors:beyond the regulation of synaptic transmission[J]. Psychoneuroendocrinology, 2007, 24 :S40–S45 . |
| [2] | 侯学东, 刘正琦, 文涛. 铅暴露对大鼠脑海马mGluR5表达和学习记忆影响[J]. 中国公共卫生,2014,30 (4) :451–452. |
| [3] | 李宁, 杨国俊, 乔明武, 等. 铅对仔鼠学习记忆及其海马组织TNF-(表达影响[J]. 中国公共卫生,2011,27 (11) :1442–1443. |
| [4] | 秦伟, 金寰, 罗孝美, 等. 硫化氢对吗啡依赖大鼠学习记忆的影响及机制研究[J]. 中国现代医学杂志,2014,4 (26) :18–21. |
| [5] | Brakeman PR, Lanahan AA, O'Brien R, et al. Homer:a protein that selectively binds metabotropic glutamate receptors[J]. Nature, 1997, 386 (6622) :284–288 . |
| [6] | Kato A, Ozawa F, Saitoh Y, et al. Novel members of the Vesl/Homer family of PDZ protein that bind metabotropic glutamate receptors[J]. Biol Chem, 1998, 273 (37) :23969–23975 . |
| [7] | Xiao B, Tu JC, Petralia RS, et al. Homer regulates the association of group1 metabotr-opic glutamate receptors with multivalent complexes of homer-related synaptic protein[J]. Neuron, 1998, 21 (4) :707–716 . |
| [8] | Sun J, Tadokoro S, Imanaka T, et al. Isolation of PSD-Zip45,a novel Homer/vesl family protein containing leucine zipper motifs,from rat brain[J]. FEBS Lett, 1998, 437 (3) :304–308 . |
| [9] | Klugmann M, Wymond SC, Leichtlein CB. AVV-mediated hippocmpal expression of short and long Homer1 proteins differentially affect cognition and seizure activity in adult rats[J]. Mol Cell Neurosci, 2005, 28 (2) :347–360 . |
| [10] | Francesconi W, Cammalleri M, Sanna PP, et al. The metabotropic glutamate receptor 5 is necessaryfor late-phase long-term potentiation in the hippocampal CA1 region[J]. Brain Res, 2004, 1022 (1-2) :12–18 . |
| [11] | Tu JC, Xiao B, Yuan JP, et al. Homer binds novel proline-rich motif and links group 1 metabotropic glutamate receptors with IP3 receptors[J]. Neuron, 1998, 21 (4) :717–726 . |
| [12] | Sala C, Roussignol G, Meldolesi J, et al. Key role of the postsynaptic density scaffold proteins Shank and Homer in the functional architecture of Ca2+ homeostasis at dendritic spines in hippocampal neurons[J]. Neurosci, 2005, 25 :4587–4592 . |
| [13] | Yeh TH, Wang H. Global ischemia downregulates the function of metabotropic glutamate receptor subtype 5 in hippocampal CA1 pyramidal neurons[J]. Mol Cell Neurosci, 2005, 29 :484–492 . |
| [14] | Kinney GG, Burno M, Campbell UC. Metabotropic glutamate subtype 5 receptors modulate locomotor activiy and sensorimotor gating in rodents[J]. Pharmacol Exp Ther, 2003, 306 (1) :116–123 . |
| [15] | Castiglione M, Calafiore M, Costa L. Group I metabotropic glutamate receptors control proliferation,survival and differentiationn of cultured neural progenitor cells Isolated from the subventricular zone of adult mice[J]. Neuropharmacology, 2008, 55 (4) :560–567 . |
 2016, Vol. 32
2016, Vol. 32
