2. 珠海南医大生物医药公共服务平台有限公司
Notch信号是一个高度保守的信号通路,调控细胞的凋亡、增殖和分化。另外,Notch信号通路的异常与肿瘤的发生发展有关[1, 2, 3]。Notch受体是一种单次跨膜蛋白,哺乳动物总共有4种Notch受体,即Notch1、2、3、4,包括胞外区、跨膜区和胞内区。其中Notch胞内区(Notch intracellular domain,NICD)起着很重要的传导作用。近年来,Notch2越来越受到关注,它与许多肿瘤的发生密切相关,通过调控Notch2信号转导通路成为肿瘤治疗的一个新的契机。本研究旨在构建人Notch2胞内域基因的真核表达载体,并转染HEK 293T细胞进行N2ICD的表达,为进一步探讨Notch2信号通路的生物学行为及其在肿瘤中的生物学中的作用奠定基础。
1 材料与方法 1.1 材料 1.1.1 细胞株人宫颈癌细胞系Hela细胞、HEK293T细胞(南方医科大学生物技术学院生物治疗研究所实验室保存)。
1.1.2 主要试剂和仪器真核表达质粒pCMV-Tag4(南方医科大学生物技术学院生物治疗研究所实验室保存),限制性内切酶Quick CutTMNotⅠ、Quick CutTMXhoⅠ、pMD 18-T 载体、T4 DNA 连接酶、RNAiso Plus、PrimeScriptTM 一步法 RT-PCR试剂盒、割胶回收试剂盒、质粒提取试剂盒、PrimeScript RT试剂盒、荧光定量PCR(quantitative polymerase chain reaction,Q-PCR)试剂盒,PrimeScriptⅡ 逆转录酶(大连TaKaRa公司),感受态大肠杆菌DH5α(北京Tiangen公司),LipofectamineTM 2000(美国Invitrogen公司),胎牛血清( Fetal Bovine Serum,FBS)(浙江天杭生物科技有限公司),高糖培养基(Dulbecco′s modified Eagle′s medium,DMEM)(美国Gibco公司),RIPA裂解液(广州弗德生物科技有限公司),Bradford蛋白浓度测定试剂盒(中国Beyotime公司),兔抗FLAG标签抗体(上海santa cruz公司),兔抗N2ICD抗体(美国CST公司),辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗兔IgG(中国弗德生物科技有限公司),引物合成、基因测序(北京中美泰和生物技术有限公司);Mini P-4型电泳仪(北京凯元信瑞仪器有限公司),Eppendorf 5418型离心机(德国Eppendorf公司),Thermo 3111型CO2培养箱(中国赛默飞世尔科技有限公司),Eppendorf 荧光定量PCR仪(德国Eppendorf公司)。
1.2 方法 1.2.1 Hela细胞的培养及总RNA的提取Hela细胞含10% FBS DMEM培养,待细胞长满,用胰酶消化细胞终止后1 000 r/min、5 min离心去上清并用磷酸盐缓冲液( Phosphate Buffer solution,PBS)清洗3遍,然后加适量RNAiso Plus裂解细胞按照说明书提取总RNA。
1.2.2 Notch2蛋白胞内区基因的扩增根据NCBI数据库中的Notch2的基因序列(AF308601.1),设计扩增蛋白胞内区基因N2ICD的引物(N2ICD-F:5116~5128~N2ICD-R:7401~7425),扩增长度2 310 bp。 以Hela细胞的总RNA为模板,RT-PCR扩增N2ICD,反应为50 ℃ 30 min,94 ℃ 2 min,94 ℃ 30 s、57 ℃ 30 s、72 ℃ 2.5 min,35个循环,72 ℃ 5 min。RT-PCR产物经1%琼脂糖凝胶电泳鉴定并切胶回收。
1.2.3 N2ICD与pMD-18T载体连接与鉴定将切胶回收的N2ICD与克隆载体pMD-18T在16 ℃下连接3 h,连接产物转化到大肠杆菌DH5α中,从含有青霉素、异丙基-β-d-硫代半乳糖苷(isopropyl-beta-d-thiogalactopyranoside,IPTG)、X-gal的LB固体培养板挑取白色单菌落过夜培养和提取质粒,经PCR、双酶切及测序鉴定。
1.2.4 真核表达重组体N2ICD/pCMV-Tag4的构建和鉴定用XhoⅠ和NotⅠ双酶切N2ICD/pMD-18T和真核载体pCMV-Tag4,将酶切过后的pCMV-Tag4和N2ICD分别进行切胶回收。将纯化的pCMV-Tag4和N2ICD在T4连接酶的作用下16 ℃连接过夜,产物转化大肠杆菌DH5α,从含有卡那霉素的LB固体培养板挑取单菌落过夜培养和提取质粒,经双酶切及测序鉴定。
1.2.5 重组质粒N2ICD/pCMV-Tag4瞬时和稳定转染以含10%FBS的DMEM高糖培养基常规培养HEK 293T细胞,每3 d传代1次。转染前以2.5×106个/mL接种到10 cm细胞培养板中,待细胞生长到80%汇合度时,转染按试剂盒说明书进行,同时以转染空载体pCMV-Tag4为阴性对照和以无转染的HEK 293T细胞为空白对照,转染48 h后进行基因和蛋白水平鉴定。另外,重组质粒N2ICD/pCMV-Tag4和pCMV-Tag4转染HEK 293T细胞48 h 后,对HEK 293T、pCMV-Tag4、N2ICD/pCMV-Tag4 3组细胞分别加入G418(800 μg/mL),37 ℃,5%的CO2进行筛选,每2 d换1次含G418(800 μg/mL)的培养基,7~9 d待HEK 293T组的细胞全部死亡后换G418(400 μg/mL)进行筛选,再过2周后换成G418(200 μg/mL)培养,直至得到稳定表达N2ICD的细胞株。
1.2.6 检测目的基因在mRNA水平上扩增及在蛋白水平上的表达重组质粒转染HEK 293T细胞48 h后,按照RNAiso Plus试剂盒说明书进行细胞总RNA的提取。应用Q-PCR检测目的基因mRNA扩增水平,第一链cDNA合成按照PrimeScript RT试剂盒说明书完成及Q-PCR按照PrimeScriptⅡ逆转录酶试剂操作进行,以β-actin为内参(NM_001101.3),Q-PCR引物见(表 1),总反应体系为20 μL,Q-PCR反应程序为95 ℃ 30 s,95 ℃ 5 s、60 ℃ 34 s 40个循环,95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。定量方法参照[4],以2-ΔΔCt值表示目的基因mRNA的相对扩增量。ΔCt为N2ICD基因Ct值与内参β-actin基因Ct值的差值,ΔΔCt为转染重组质粒组与空白对照组的ΔCt值的差值。
| 表 1 N2ICD Q-PCR特异引物 |
应用蛋白印记(Western blot,WB)鉴定重组质粒,转染细胞48 h后收集细胞,用RIPA裂解液冰上裂解细胞30 min,4 ℃ 12 000 r/min离心5 min去除细胞碎片后,取40 μg样品与上样缓冲液混合,煮沸7 min,进行10% 十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)电泳,转至 聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜。将膜在含5%脱脂奶粉的Tris 盐酸缓冲液(Tris buffered saline) 含0.05% 土温20(10 mmol/L Tris-HCl,pH7.5,150 mmol/L NaCl,0.08% 土温-20)中室温封闭1.5 h,随后加入兔抗FLAG标签一抗室温孵育1.5 h,洗涤后加入羊抗兔IgG-HRP二抗,室温孵育40 min;洗涤后用化学发光试剂检测结果。同样用兔抗N2ICD作为一抗再做一次WB,化学发光试剂检测结果。
2 结 果 2.1 RT-PCR扩增Notch2蛋白胞内区基因(图 1)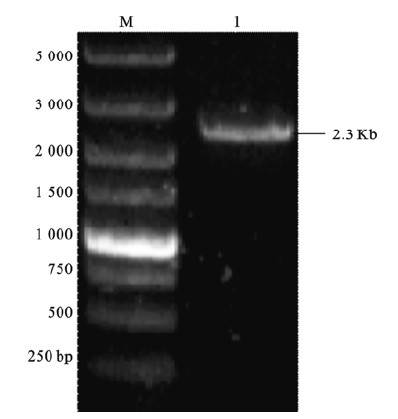 | 注:M:DL15 000 DNA Marker;1:N2ICD。 图 1 N2ICD基因的PCR扩增 |
以Hela细胞的cDNA序列为模板,用RT-PCR扩增Notch2蛋白胞内区基因(N2ICD),1%琼脂糖凝胶电泳检测显示,在2 300 bp左右可见特异性目的条带,与预期结果一致。
2.2 N2ICD/pMD-18T重组质粒的构建及鉴定(图 2)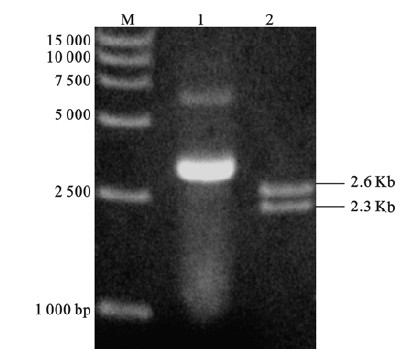 | 注: M:DL15 000 DNA Marker;1:N2ICD/pMD-18T;2:XhoⅠ和NotⅠ双酶切。 图 2 重组质粒N2ICD/pMD-18T双酶切鉴定图 |
切胶回收N2ICD后,与pMD-18T载体16 ℃连接3 h后转化大肠杆菌DH5α,挑取单菌落,过夜培养提取质粒,进行XhoⅠ和NotⅠ双酶切鉴定,1%琼脂糖电泳结果可见pMD-18T载体条带(2.6Kb)和N2ICD条带(2.3Kb),提示编码N2ICD成功克隆入pMD-18T载体。对酶切鉴定正确的克隆进行测序,测序结果在NCBI上进行BLAST比对分析,读码框完全正确,无突变位点,将测序正确的克隆命名为N2ICD/pMD-18T。
2.3 N2ICD/pCMV-Tag4重组质粒的构建及鉴定(图 3)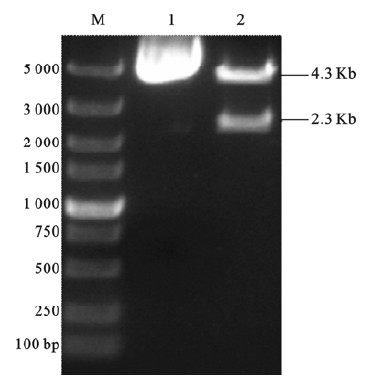 | 注: M:DL5 000 DNA Marker;1: N2ICD/pCMV-Tag4;2: XhoⅠ和NotⅠ双酶切。 图 3 重组质粒N2ICD/pCMV-Tag4酶切鉴定 |
用XhoⅠ和NotⅠ双酶切N2ICD/pMD-18T,切胶回收N2ICD片段,用同样的酶双酶切pCMV-Tag4真核表达载体并回收片段,将N2ICD与pCMV-Tag4过夜连接并转化转化大肠杆菌DH5α,挑取单菌落,过夜培养提取质粒,提取质粒进行XhoⅠ和NotⅠ进行双酶切鉴定,1%琼脂糖凝胶电泳结果可见pCMV-Tag4载体条带(4.3Kb)、N2ICD条带(2.3Kb),说明重组成功。
2.4 Q-PCR检测目的基因瞬时表达(图 4、5)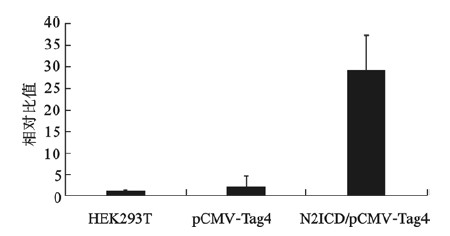 | 图 4 Q-PCR分析转染HEK 293T细胞N2ICD的mRNA扩增水平 |
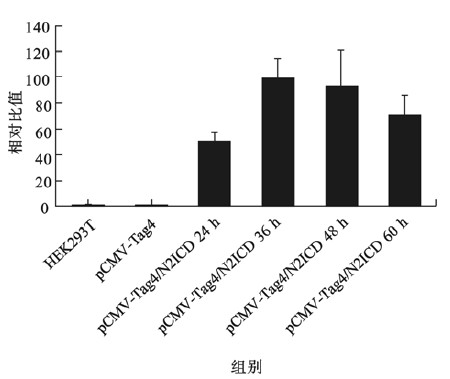 | 图 5 Q-PCR分析瞬时转染HEK 293T细胞N2ICD的mRNA扩增水平 |
重组质粒N2ICD/pCMV-Tag4、空载体pCMV-Tag4转染HEK 293T细胞48 h后提取总RNA,反转录后进行Q-PCR检测,无转染HEK 293T细胞作为空白对照。结果显示,N2ICD/pCMV-Tag4能够明显提高细胞内N2ICD胞内段mRNA的扩增,明显高于空载体转染阴性对照组和空白对照组(图 4)。另外,将重组质粒N2ICD/pCMV-Tag4瞬时转染HEK 293T细胞24 、36 、48 h后,用Q-PCR检测N2ICD基因的扩增水平,结果得出转染36 h后N2ICD的mRNA扩增最高(图 5)。
2.5 WB法检测目的基因瞬时表达(图 6~8)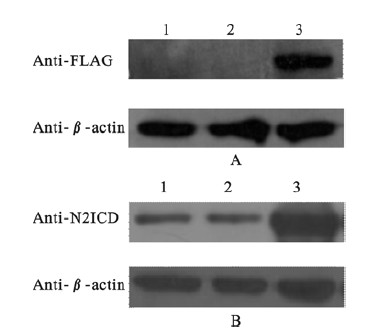 | 注: 1: 未转染细胞对照;2: 空载体转染对照;3: pCMV-Tag4/N2ICD转染对照。 图 6 转染pCMV-Tag4/N2ICD后的蛋白表达结果 |
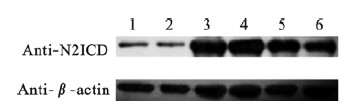 | 注:1: 未转染细胞对照;2: 空载体转染对照;3~6: 24 、36、48、60 h 图 7 转染pCMV-Tag4/N2ICD后不同时间点的蛋白表达水平 |
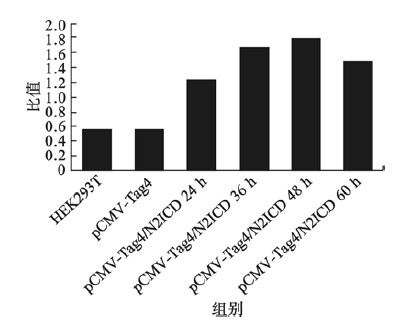 | 图 8 灰度分析结果 |
重组质粒N2ICD/pCMV-Tag4转染HEK 293T细胞48 h后,提取细胞总蛋白,每孔上样40 μg蛋白样品,用FLAG标签特异性抗体检测到在83 kD处出现特异性的结合条带,而转染空白质粒组中未检测出目的基因的表达(图 6A),再用兔抗N2ICD抗体检测到转染重组质粒N2ICD/pCMV-Tag4组的N2ICD蛋白表达量明显增加(图 6B),这说明重组质粒中目的基因在蛋白水平可以正常表达。另外,兔抗N2ICD抗体检测重组质粒N2ICD/pCMV-Tag4瞬转HEK 293T细胞24、36、48 h后N2ICD表达水平,发现结果得到瞬转48 h时,N2ICD蛋白表达最高(图 7、8)。
3 讨 论Notch基因于1916年因其部分功能缺失会导致果蝇翅膀边缘产生“锯齿样”字形缺口(notches)而命名。Notch信号传导通路受多水平多蛋白的调控,受体和配体相互作用后发生构型改变,受体胞内区释放并往细胞核迁移的过程中与众多分子组成多蛋白复合体,共同来参与下游基因的活化或抑制[5],Notch受体与配体结合后构象发生改变,使得受体胞外域金属蛋白酶切割位点暴露,在γ-分泌酶的介导下发生水解作用,释放出Notch蛋白的胞内域NICD,进入细胞核后与转录抑制因子RBP-Jk(也称为CSL/CBF1)结合,Ⅰ/Ⅱ型组蛋白去乙酰化酶等蛋白形成共活化物成为转录活化因子活化特定基因的转录影响细胞的凋亡、增殖和分化[6]。Notch信号的传递过程为Notch相关疾病的临床治疗提供了一系列靶点[5, 7, 8]。例如,陶欣等[9]研究发现Notch信号通路可能成为氟中毒所致的机体损伤的潜在治疗靶点。人和哺乳动物共发现4种Notch受体,即Notch1、Notch2、Notch3和Notch4,各个受体蛋白及其相应的配体组成的信号传导通路在不同的细胞和组织发育中发挥着不同的功能。目前对Notch1及其配体的信号通路的研究比较多,同时越来越多的研究关注Notch2及其配体的信号通路,发现Notch2及其配体的信号通路的活化和抑制与多种肿瘤的发生、发展有关[10, 11, 12, 13, 14, 15, 16, 17, 18]。杨春秀等[19]发现N2ICD过表达可抑制慢性粒细胞白血病细胞K562的增殖,李春芳等[20]用小干扰RNA下调Notch2可以减缓肝癌细胞HepG2的增殖。所以,Notch2信号通路及其胞内区N2ICD的表达调控可能是肿瘤治疗的一个新的靶点[8]。
在本研究中,将目的基因N2ICD克隆入真核表达载体pCMV-Tag4并成功在HEK 293T细胞中获得表达,HEK 293T细胞是人源化细胞,可以使表达的目的蛋白进行磷酸化等翻译后修饰,有利于获得具有天然构象的蛋白,为下一步进行单克隆抗体的制备及功能研究奠定基础。另外,将N2ICD基因克隆入带有FLAG标签的真核表达载体,有助于利用标签抗体进行靶标蛋白的纯化,简化了繁琐的纯化过程。从mRNA水平上看,重组质粒N2ICD/pCMV-Tag4瞬时转染36 h后N2ICD表达量最高。 从蛋白水平上看,转染48 h后N2ICD表达最高。可见,基因和蛋白水平的表达不一定完全同步。总之,N2ICD表达不仅可以为下一步纯化获得靶蛋白提供可能,也为进一步研究N2ICD的生理功能及信号传导机制奠定基础,而且还可以更深入探讨N2ICD的表达调控对肿瘤发生发展的影响。本研究成功构建了人Notch2蛋白胞内域基因的真核表达载体,转染HEK 293T细胞后,实现了N2ICD的表达,为后续机制研究实验奠定了基础。
| [1] | Cenciarelli C,Marei HE,Zonfrillo M,et al.PDGF receptor alpha inhibition induces apoptosis in glioblastoma cancer stem cells refractory to anti-Notch and anti-EGFR treatment[J].Mol Cancer,2014,13:247. |
| [2] | Wang K,Zhang Q,Li D,et al.PEST domain mutations in Notch receptors comprise an oncogenic driver segment in triple-negative breast cancer sensitive to a gamma-secretase inhibitor[J].Clin Cancer Res,2015,21(6):1487-1496. |
| [3] | Wu G,Wilson G,George J,et al.Modulation of Notch signaling as a therapeutic approach for liver cancer[J].Curr Gene Ther,2015,15(2):171-181. |
| [4] | 宋艳,张茂林,关振宏,等.miR-29c真核表达载体构建及鉴定[J].中国公共卫生,2012,28(9):1241-1243. |
| [5] | Chapman G,Liu L,Sahlgren C,et al.High levels of Notch signaling down-regulate Numb and Numblike[J].J Cell Biol,2006,175(4):535-540. |
| [6] | Gokulan R,Halagowder D.Expression pattern of Notch intracellular domain(NICD) and Hes-1 in preneoplastic and neoplastic human oral squamous epithelium:their correlation with c-Myc,clinicopathological factors and prognosis in oral cancer[J].Med Oncol,2014,31(8):126. |
| [7] | Carmena A,Speicher S,Baylies M.The PDZ protein Canoe/AF-6 links Ras-MAPK,Notch and Wingless/Wnt signaling pathways by directly interacting with Ras,Notch and Dishevelled[J].PLoS One,2006,1:e66. |
| [8] | Previs RA,Coleman RL,Harris AL,et al.Molecular pathways:translational and therapeutic implications of the Notch signaling pathway in cancer[J].Clin Cancer Res,2015,21(5):955-961. |
| [9] | 陶欣,于燕妮,朱志坚.慢性氟中毒对肝脏Notch1、Hes1蛋白表达影响[J].中国公共卫生,2015,31(6):747-750. |
| [10] | Colombo M,Thummler K,Mirandola L,et al.Notch signaling drives multiple myeloma induced osteoclastogenesis[J].Oncotarget,2014,5(21):10393-10406. |
| [11] | Guo LY,Li YM,Qiao L,et al.Notch2 regulates matrix metallopeptidase 9 via PI3K/AKT signaling in human gastric carcinoma cell MKN-45[J].World J Gastroenterol,2012,18(48):7262-7270. |
| [12] | Li J,Ding S,Ying L,et al.Effect of siRNA-mediated silencing of Notch2 on proliferation of the HepG2 human hepatocellular carcinoma cells] [J].Zhonghua Gan Zang Bing Za Zhi,2014,22(5):354-357. |
| [13] | Kiel MJ,Velusamy T,Betz BL,et al.Whole-genome sequencing identifies recurrent somatic NOTCH2 mutations in splenic marginal zone lymphoma[J].J Exp Med,2012,209(9):1553-1565. |
| [14] | Kishida S,Mu P,Miyakawa S,et al.Midkine promotes neuroblastoma through Notch2 signaling[J].Cancer Res,2013,73(4):1318-1327. |
| [15] | Zheng Q,Qin H,Zhang H,et al.Notch signaling inhibits growth of the human lung adenocarcinoma cell line A549[J].Oncol Rep,2007,17(4):847-852. |
| [16] | Troen G,Wlodarska I,Warsame A,et al.NOTCH2 mutations in marginal zone lymphoma[J].Haematologica,2008,93(7):1107-1109. |
| [17] | Cho OH,Shin HM,Miele L,et al.Notch regulates cytolytic effector function in CD8+ T cells[J].J Immunol,2009,182(6):3380-3389. |
| [18] | Kijima M,Iwata A,Maekawa Y,et al.Jagged1 suppresses collagen-induced arthritis by indirectly providing a negative signal in CD8+ T cells[J].J Immunol,2009,182(6):3566-3572. |
| [19] | 杨春秀,陈建斌,张树君,等.Notch2胞内段基因过表达对K562细胞增殖的影响及其机制[J].中国生物制品学杂志,2011,24(11):1278-1281,1289. |
| [20] | 李建芳,丁世雄,应丽萍,等.小干扰RNA下调Notch2对肝细胞癌HepG2细胞增殖的影响[J].中华肝脏病杂志,2014,22(5):354-357. |
 2016, Vol. 32
2016, Vol. 32


