2. 贵阳医学院法医病理学教研室;
3. 贵阳医学院公共卫生学院环境卫生学教研室
氟骨症是长期摄入过量氟引起的骨病变,其发病机制至今未能阐明。近年来研究显示,Notch信号通路在细胞分化、增殖中起重要作用,对骨细胞的分化具有重要影响[1]。本研究通过建立慢性氟中毒大鼠模型,观察骨组织中Notch信号通路关键信号分子-核转录抑制因子(recombination signal-binding protein-J kappa,RBPJ)表达水平变化,并观察其下游效应靶基因Hes 5表达变化,旨在了解氟中毒时骨组织内Notch通路信号分子的变化及作用,探讨RBPJ在氟骨症发病机制中的作用。结果报告如下。 1 材料与方法 1.1 主要仪器与试剂
Bio-rad电泳槽(美国Bio-rad公司),CFX 96TM实时定量PCR仪(美国Bio-rad公司),Chemi Doc XRS凝胶成像系统(美国Bio-rad公司)。兔抗 Jagged 1(Jag1)单克隆抗体(英国Abcam公司),兔抗RBPJ单克隆抗体(美国Cell Signaling公司),兔抗Hes 5多克隆抗体(美国Genetex公司),Immobilon 化学发光试剂(美国Millipore公司),PV-9001兔超敏二步法免疫组化检测试剂(北京中杉金桥生物技术有限公司),Trizol Reagent(美国 Invitrogen公司),RevertAid First Strand cDNA Synthes(美国Thermo Scientific Multiskan 公司),SYBR Premix Ex Taq II(大连宝生物工程有限公司)。 1.2 实验动物与分组处理
健康纯系清洁级Sprague-Dawley大鼠24只(体重100~150 g),由贵阳医学院动物实验中心提供,许可证号:SCXK(黔)2012-0001,经常规适应性饲养1周后随机分为3组,每组8只,雌雄各半。对照组大鼠饮用普通自来水(饮水氟含量<1 mg/L);低、高氟组大鼠分别饮用氟含量50、100 mg/L的NaF自来水,实验周期6个月。染氟结束后,收集大鼠尿液;股动脉放血处死动物,取一侧股骨上段10%中性福尔马林固定,取一侧股骨组织于-80 ℃保存,取胫腓骨液氮保存。 1.3 指标与方法 1.3.1 尿氟、骨氟水平测定
尿氟采用氟离子电极法,骨氟灰化后采用氟离子电极法。 1.3.2 骨组织形态学检查
取股骨组织经10%中性福尔马林固定,以10%乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)在4 ℃恒温脱钙3周,常规石蜡包埋切片后苏木精-伊红染色(hematoxylin-eosin staining,HE),每张切片选取骺板下0.5 cm部位,观察病理学变化,测量骨皮质厚度、骨小梁宽度、骨小梁密度、成骨细胞指数。 1.3.3 骨组织成骨细胞Notch通路蛋白表达测定
采用免疫组化法,石蜡切片常规脱蜡至水后,浸入乙二胺四乙酸抗原修复液(pH=8.0)后65 ℃恒温4 h,3%双氧水放置10 min,山羊血清37 ℃ 封闭20 min,滴加一抗湿盒中4 ℃过夜,其中兔抗Jag1抗体为1:400,兔抗RBPJ、Hes5抗体为1:500;按照PV-9001说明书操作,采用3,3′-二氨基联苯胺显色,苏木素复染后,脱水,透明,封片,光镜下观察。判断标准:Jag 1阳性细胞为细胞膜或细胞质中有黄色着色,RBPJ阳性细胞为细胞核中有黄色着色,Hes 5阳性细胞为细胞核或细胞质中有黄色着色。在400倍镜下随机选取5个视野,每个视野选取5个阳性区域计算平均光密度,平均光密度与蛋白表达水平呈正比。 1.3.4 骨组织Notch通路蛋白表达测定
采用免疫印迹法,将大鼠骨组织用液氮捣碎后,称取100 mg骨组织,加入1 mL RIPA裂解液(强)提取总蛋白,用二喹啉甲酸法测定蛋白浓度,取相同上样量进行聚丙烯凝胶电泳分离蛋白,再用转膜装置转于聚偏二氟乙烯莫(polyvinylidene fluoride,PVDF)膜上,分别用RBPJ抗体(1:5 000)和Jag1、Hes5抗体(1:1 000)4 ℃孵育过夜,加入辣根过氧化物酶标记的山羊抗兔lgG(1:2 000)37 ℃孵育1 h,化学发光试剂显色,凝胶成像系统曝光后,采用Image Lab软件分析,以β-actin为内参,以相对灰度值反映骨组织蛋白表达量。 1.3.5 骨组织RBPJ、Jag1和Hes5 mRNA表达测定
采用实时荧光定量法,将骨组织用液氮捣碎后,Trizol提取总RNA,按照逆转录试剂盒说明书合成cDNA,进行实时荧光定量反应,引物由上海生工生物工程股份有限公司设计并合成,反应结束后,计算2-ΔCT进行比较。Jag1引物序列:上游5′-GAACTGGACAAACAAACAGGACAAC-3′,下游5′-CCTCAGACTGGGATACGACAACA-3′,产物大小163 bp;RBPJ引物序列:上游5′-GCGGTTTGTCTTTCTGGCTA-3′,下游5′-TGTTCGGAGTGGCATTTACA-3′,产物大小142 bp;Hes5引物序列:上游5′-TGCTCAGTCCCAAGGAGAAAAAT-3′,下游5′-GCTTTGCTGTGCTTCAGGTAG-3′,产物大小193 bp;三磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)引物序列:上游5′-GGCACAGTCAAGGCTGAGAATG-3′,下游5′-ATGGTGGTGAAGACGCCAGTA-3′,产物大小143 bp。PCR反应体系20 μL,其中SYBR® Premix Ex TaqTM(2×)10 μL,上下游引物各0.8 μL,cDNA模板 1 μL,加双蒸水补足20 μL,PCR设置条件Jag1、GAPDH为95 ℃ 30 s;95 ℃ 5 s;58 ℃ 30 s;72 ℃ 35 s;共40个循环。RBPJ、Hes 5为95 ℃ 30 s;95 ℃ 5 s;60 ℃ 30 s;72 ℃ 35 s;共40循环。 1.4 统计分析
计量资料均采用x±s表示,采用SPSS 17.0软件进行统计分析,多组间均数比较采用方差分析,方差齐性采用最小显著差异法,方差不齐采用Games-Howell法,检验水准为α=0.05。 2 结 果 2.1 染氟对大鼠尿氟和骨氟含量影响(表 1)
与对照组比较,染氟组大鼠尿氟、骨氟含量均升高,差异均有统计学意义(均P<0.05),且高氟组尿氟含量高于低氟组,差异有统计学意义(P<0.05)。
| 表 1 染氟对大鼠骨氟与尿氟含量影响(x±s,n=8) |
HE染色光镜下可见对照组骨皮质厚度均匀,骨小梁宽度适中,排列有序(图 1 2a);染氟组大鼠骨皮质增厚,骨小梁增生变粗,排列紊乱,骨小梁腔隙变小,成骨细胞数目增多,呈立方形或椭圆形等(图 1 2b、2c)。与对照组比较,染氟组大鼠骨皮质厚度、骨小梁宽度、骨小梁密度、成骨细胞指数均升高,差异均有统计学意义(均P<0.05)(表 2)。
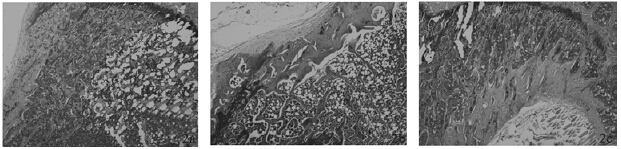 | 注:2a:对照组;2b:50 mg/L染氟组;2c:100 mg/L染氟组。 图 1 大鼠骨组织形态学改变(HE,×40) |
| 表 2 染氟对大鼠骨组织形态学计量学影响(x±s,n=8) |
与对照组比较,高氟组大鼠骨组织中Jag1蛋白表达降低,低、高剂量染氟组大鼠RBPJ蛋白表达均升高、Hes5蛋白表达均降低,差异均有统计学意义(均P<0.05)。
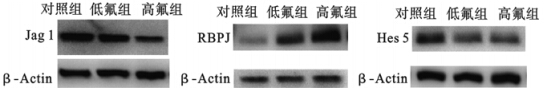 | 图 2 染氟对大鼠骨组织Jag 1、RBPJ、Hes 5蛋白表达影响 |
| 表 3 染氟对大鼠骨组织Notch通路蛋白表达影响(x±s,n=8) |
光镜观察显示,对照组大鼠成骨细胞Jag 1阳性表达数目较多,染色较深,而染氟组大鼠成骨细胞阳性表达数目较少,染色较浅;对照组大鼠成骨细胞RBPJ阳性表达数目较少,染色较浅,而染氟组阳性表达数目较多,染色较深;染氟组大鼠成骨细胞Hes5阳性表达较对照组数目和染色深浅上无明显变化。低、高氟组大鼠Jag1表达[分别为(0.024±0.008)、(0.029±0.009)]均低于对照组(0.044±0.023),差异均有统计学意义(均P<0.05);低、高氟组大鼠RBPJ表达水平[分别为(0.032±0.017)、(0.033±0.017)]均高于对照组(0.021±0.013),差异均有统计学意义(均P<0.05)。 2.5 染氟对大鼠骨组织Notch通路因子 mRNA表达影响(表 4)
高氟组大鼠骨组织Jag1 mRNA相对表达量均低于对照组和低氟组,差异均有统计学意义(均P<0.05);染氟组大鼠RBPJ mRNA相对表达量均低于对照组,差异均有统计学意义(均P<0.05)。
| 表 4 染氟大鼠骨组织Notch通路因子mRNA表达影响(x±s,n=8) |
研究表明氟骨症的发生与骨组织信号通路相关,氟可以通过刺激Wnt经典信号使成骨作用增强,从而引起骨骼病变发生氟骨症[2],慢性氟中毒可引起股骨成骨细胞中特异性转录因子osterix表达改变,导致骨骼损伤[3],Notch通路与骨形成和发育有关[4]。Notch通路包括CBF-1/RBPJ依赖途径和CBF-1/RBPJ非依赖途径,前者称为Notch经典途径,其受体目前发现4种,即Notch1、2、3、4,而配体包括DLL 1、3、4和Jagged 1、2。Notch受体与配体结合后,释放胞内段(notch1 intracellular domain,NICD),NICD进入核内与CBF-1/RBPJ结合,CBF-1/RBPJ本身为转录抑制因子,CBF-1/RBPJ与NICD结合后转化为转录激活因子,激活靶基因如Hes 1、Hes 5、Hey 1、Hey 2、Hey L等[5]。
Jag 1作为Notch通路重要配体之一,与骨组织形成和发育密切相关。研究发现一种常表现为心血管缺陷,颅面骨及脊椎骨畸形的常染色体显性遗传病—阿拉吉欧综合征被认为与Jag 1基因的突变有关[6],Engin等[7]发现在人骨肉瘤组织中Jag 1表达量异常升高;Dishowitz等[8]研究表明Jag 1可以介导间充质干细胞向成骨细胞分化并导致矿化出现;王胜朝等[9]发现Jag 1在骨髓基质细胞Kusa-A1成骨分化过程中表达大幅下调。本研究结果表明,染氟组大鼠骨组织和成骨细胞中Jag 1蛋白表达量降低,高氟组骨组织Jag 1 mRNA表达水平明显下调。提示高氟可以在蛋白和mRNA水平抑制Jag 1表达,促进成骨分化,导致骨硬化。
RBPJ作为Notch经典通路核心因子,只有当其被激活后才能将Notch通路的信号向下游传导,发挥作用。研究表明RBPJ/CBF1升高有利于促进Kusa-A1的成骨分化[10],RBPJ作为一个负性调控因子抑制破骨细胞的分化及成熟[11]。本研究结果显示,染氟组大鼠骨组织中RBPJ蛋白水平升高,并出现骨皮质增厚、骨小梁变粗、骨小梁腔隙变小等骨硬化表现。推测氟可能促进RBPJ蛋白表达,增加对下游靶基因的抑制作用,使成骨细胞增殖、分化加快,大于破骨代谢,骨动态平衡被打破,从而出现骨硬化表现。
Hes家族基因由多个因子构成,目前证明Hes 1、Hes 5、Hes 7是依赖Notch信号通路的下游靶基因,而Hes 5参与骨形成与重建,软骨分化过程中Hes 5表达量下降,抑制Hes 5的表达有利于软骨细胞增殖[12],另外在骨关节炎中可观察到大量Hes 5表达[13]。本研究结果显示,Hes 5在氟中毒大鼠骨组织中蛋白表达降低。提示高氟使Notch通路信号分子受抑制,从而加快软骨内成骨过程,导致骨形成与重建过程加快。
| [1] | Koch U,Lehal R,Radtke F.Stem cells living with a Notch[J].Development,2013,140(4):689-704. |
| [2] | 陈锡山,于燕妮,易韦,等.氟对大鼠成骨细胞Wnt3a、β-链蛋白mRNA和蛋白表达的影响[J].中华地方病学杂志,2013,32(2):140-145. |
| [3] | 杨丹,于燕妮,邓超男,等.氟对大鼠骨组织Osterix mRNA及其蛋白表达影响[J].中国公共卫生,2011,27(8):1008-1009. |
| [4] | Regan J,Long F.Notch signaling and bone remodeling[J].Curr Osteoporos Rep,2013,11(2):126-129. |
| [5] | Rizzo P,Osipo C,Foreman K,et al.Rational targeting of Notch signaling in cancer[J].Oncogene,2008,27(38):5124-5131. |
| [6] | Li L,Dong J,Wang X,et al.JAG1 mutation spectrum and origin in Chinese children with clinical features of Alagille syndrome[J].PLoS One,2015,10(6):e0130355. |
| [7] | Engin F,Bertin T,Ma O,et al.Notch signaling contributes to the pathologenesis of human osteosarcomas[J].Human Molecular Genetics,2009,18:1464-1470. |
| [8] | Dishowitz MI,Zhu F,Sundararaghavan HG,et al.Jagged1 immobilization to an osteoconductive polymer activates the Notch signaling pathway and induces osteogenesis[J].J Biomed Mater Res A,2014,102(5):1558-1567. |
| [9] | 王胜朝,Kawashima N,Sakamoto K,等.小鼠骨髓基质细胞Kusa-A1成骨分化中Notch信号相关基因表达分析[J].口腔医学研究,2005,21(4):389-392. |
| [10] | 王胜朝,Kawashima N,Sakamoto K,等.小鼠骨髓基质细胞Kusa-A1成骨分化中CBF1的作用[J].基础医学与临床,2006,26(4):411-414. |
| [11] | Ma J,Liu YL,Hu YY,et al.Disruption of the transcription factor RBP-J results in osteopenia attributable to attenuated osteoclast differentiation[J].Mol Biol Rep,2013,40(3):2097-2105. |
| [12] | Karlsson C,Jonsson M,Asp J,et al.Notch and HES5 are regulated during human cartilage differentiation[J].Cell Tissue Res,2007,327(3):539-551. |
| [13] | Karlsson C,Brantsing C,Egell S,et al.Notch1,Jagged1,and HES5 are abundantly expressed in osteoarthritis[J].Cells Tissues Organs,2008,188:287-298. |
 2016, Vol. 32
2016, Vol. 32


