应激(stress)是指机体在受到内外环境中各种应激源刺激时引发的一系列神经内分泌反应,以及由此导致的机能和代谢出现的一系列改变。但是当应激达到一定强度或个体耐受不良时,机体稳态受损,进而出现各种病理生理反应[1];研究表明机体处于应激状态时心脏的节律受到影响,严重者甚至出现恶性心律失常导致心源性猝死[2]。目前心理或躯体应激所引起的心脏病已被命名为应激性心肌病(stress cardiomyopathy,SC)系指严重精神或躯体应激状态下出现的一过性左室收缩功能障碍疾病,属获得性心肌病的一种[3]。缝隙连接蛋白Cx43(connexin 43,Cx43)是心肌细胞之间的缝隙连接蛋白通道(gap junction,GJ)的主要构成蛋白,是心肌细胞之间进行电耦联和代谢耦联关键蛋白[4]。近年来研究表明Cx43与多种心脏疾病及心律失常的发生关系密切[5, 6]。本研究参考文献[7, 8],建立联合应激小鼠模型,观察心肌病理改变及Cx43的表达与磷酸化水平变化,旨在为应激触发的心源性猝死案例的法医病理诊断提供实验依据。
1 材料与方法 1.1 主要试剂与仪器兔抗鼠 Cx43多克隆抗体、兔抗鼠 Cx43单克隆抗体、兔抗鼠β-actin 抗体(美国 cell singaling 公司),辣根过氧化物酶标记羊抗兔IgG 、PV-6001聚合物免疫组化检测系统、二氨基联苯胺(DAB)显色液(北京中杉生物公司),磷酸化蛋白富集试剂盒(美国 QIAGEN 公司)。电泳仪、电泳槽、转移槽(美国伯乐公司)、双色红外激光扫描成像系统(美国Odyssey公司)、ND2000型超微量紫外分光光度计(美国ThermoNanDrop)。
1.2 实验动物分组与建模雄性昆明小鼠45只,体重(25±5)g,购于贵阳医学院动物中心,许可证号:SCXK(黔)2012-001。实验前将小鼠置于实验室适应性饲养1周,自由饮食、饮水,自然昼夜节律光照。1周后,将45只小鼠随机分为对照组、应激组及心性猝死组,每组各15只。实验中每天不定时给予应激组小鼠定量的联合应激刺激(将小鼠置于透气的束缚盒中,束缚刺激20 min;将小鼠尾端固定后,悬吊刺激20 min;将小鼠放入水深约20 cm,水温25 ℃左右的圆形玻璃缸中,游泳刺激20 min);于第2周开始给予应激组小鼠应激刺激,持续7周;实验期间,应激组小鼠单独置于其他房间饲养以避免对其他实验组小鼠产生干扰;对照组与心性猝死组正常饲养不做任何处理;所有小鼠在实验第8周处死,对照组及应激组小鼠采用断颈处死,心性猝死组小鼠通过注射异丙肾上腺素处死以模拟心源性猝死。
1.3 小鼠心肌病理观察及Cx43表达检测于实验第8周末次应激后分别处死小鼠,随机选取对照组、应激组及心性猝死组小鼠各10只,解剖取心脏,将心脏标本置于中性福尔马林中固定2~3 d后,切取心室区2 mm厚组织块,脱水,透明,浸蜡及包埋,切片机连续切片5张,厚度4 μm;分别进行苏木素-伊红染色(hematoxylin-eosin,HE)及powervsion(PV)一步法免疫组化染色;用Olympus显微镜观察切片并拍照。应用IPP 6.0图像分析系统对图像进行分析,分别测量阳性表达产物的强度(OD值)。
1.4 心肌Cx43磷酸化水平检测采用Western-blot法,于实验第8周处死小鼠后随机选取对照组小鼠、应激组小鼠及心性猝死组小鼠各5只,取心脏,用生理盐水冲洗,使用试剂盒提取小鼠心肌磷酸化总蛋白;采用超微量紫外分光光度计测定各样品蛋白浓度,制作10%分离胶和5%积层胶,每孔上样15 μg,电泳结束后将蛋白电转移至聚偏二氟乙烯膜,封闭液(5%牛血清白蛋白)中,封闭120 min。分别加入p-Cx43一抗(1:1 000),β-actin一抗(1:1 000),4 ℃孵育过夜;次日取出,加入0.05% Tween-20的三羟甲基氨基甲烷缓冲液(triethanolamine buffered saline solution-Tween-20,TBS-T))漂洗10 min×3次,加入辣根过氧化物酶标记山羊抗兔IgG二抗(1:1 000),室温孵育60 min,TBS-T液漂洗10 min×3次。应用凝胶成像系统显像并拍照,应用图像处理软件Image-J检测p-Cx43及β-actin条带光密度值,将2者光密度比值作为Cx43蛋白磷酸化水平。
1.5 统计分析数据采用x±s表示,采用 SPSS 19.0 软件对数据进行统计处理,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
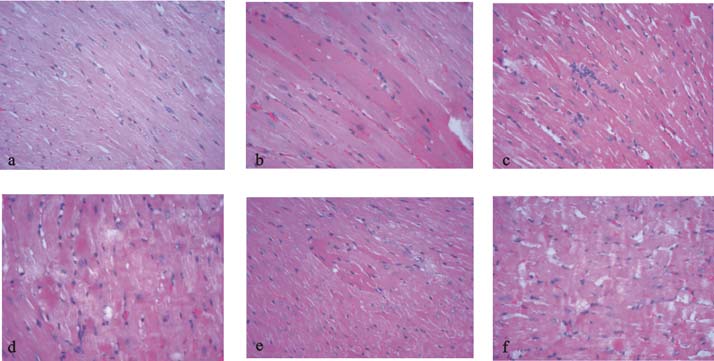
2 结 果 2.1 应激对小鼠心肌组织病理影响(图 1)对照组小鼠心肌细胞横纹清晰,细胞核致密,染色均匀,未见心肌细胞缺血梗死及炎症细胞浸润等病理表现(图 1a);应激组小鼠心肌细胞灶性嗜酸性染色加深(图 1b),心肌间隙可见灶性炎细胞浸润(图 1c),心肌横纹欠清晰,细胞核细长、深染,结构不清,部分区域心肌可见收缩带坏死(图 1d);心性猝死组小鼠心肌细胞灶性嗜酸性染色加深(图 1e),细胞核深染,结构不清,部分区域心肌横纹不清,心肌纤维断裂呈波浪状,收缩带坏死(图 1f)。
|
注:a:对照组;b、c、d:应激组;e、f:心性猝死组。 图 1 应激对小鼠心肌组织病理影响(HE,×200) |
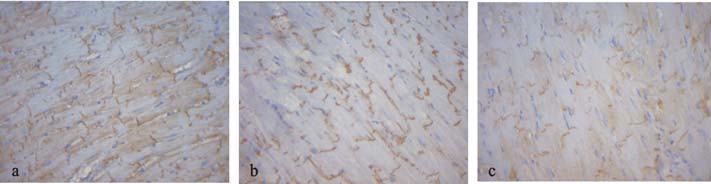
对照组小鼠心肌Cx43表达呈线条状集中分布于心肌闰盘处即心肌细胞的端-端连接处,与心肌细胞纵轴垂直(图 2a);应激组小鼠心肌Cx43表达减弱,阳性染色分布不均,部分区域可见少量缺染及呈散在颗粒状染色,部分Cx43分布在闰盘纵轴的细胞侧-侧连接处(图 2b);心性猝死组小鼠心肌Cx43表达阳性面积明显减少,部分区域心肌出现大量缺染及淡染,呈点片状分布紊乱(图 2c)。对照组、应激组、心性猝死组心肌组织Cx43表达分别为(0.26±0.04)、(0.24±0.05)、(0.18±0.03);与对照组比较,心性猝死组小鼠心肌组织Cx43表达明显下降,差异有统计学意义(P<0.05)。
|
注:a:对照组;b应激组;c心性猝死组。 图 2 应激对小鼠心肌Cx43表达影响(PV,×200) |
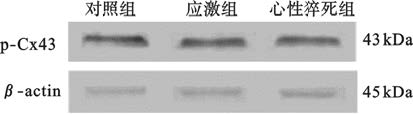
Western blot结果显示,对照组、应激组、心性猝死组小鼠心肌组织Cx43蛋白磷酸化水平分别为(476.28±14.76)%、(432.23±25.17)%、(188.69±22.95)%;与对照组比较,应激组小鼠心肌内Cx43蛋白磷酸化水平下降,心性猝死组小鼠心肌内Cx43蛋白磷酸化水平明显下降,差异有统计学意义(P<0.05)。
|
图 3 应激对小鼠心肌Cx43蛋白磷酸化水平影响 |
研究表明应激性心肌病的发生除伴有恒定的躯体或心理应激史外,与血浆内儿茶酚胺水平的升高明显相关[9],儿茶酚胺与心肌收缩带坏死和炎细胞浸润关系密切[10]。异丙肾上腺素为人工合成的β肾上腺素受体激动药,可通过加快心率、增加心肌收缩力等,增加心肌耗氧量,使心脏负荷加重,造成心肌微循环障碍引发心率失常,目前常被用于复制心律失常及应激性心肌病的动物模型[11]。本研究结果表明应激组小鼠和心性猝死小鼠心肌出现嗜酸性染色加深、炎细胞浸润及收缩带坏死等病理学表现,而对照组小鼠心肌中未见上述病理学改变,表明应激小鼠模型建立成功。
Cx43是心室肌细胞间缝隙连接蛋白通道(gap junction,GJ)的主要成分,是心肌细胞间代谢耦联和电耦联的物质基础[4]。大部分Cx43 处于磷酸化状态,其磷酸化状态决定着其自身的活性以及缝隙连接通道的开闭[12],且对各种化学刺激敏感[13]。Rohr等[14]研究认为心肌细胞间兴奋冲动的传导存在各向异性,即沿长轴方向的纵向传导速度约为短轴方向的横向传导速度的3倍,这主要是由Cx在心肌细胞表面的分布位置所决定的,心肌细胞间的端-端连接能保障电冲动沿肌束纵轴传导的快速性,而侧-侧连接可以协调侧面相邻细胞间电传导的提前和滞后,通过上述2种电传导方式来确保心电冲动沿肌束长轴传导的连续性及心脏整体电活动同步性和协调性。Beardslee等[15]研究表明由心肌缺血导致的心室区心肌细胞Cx43去磷酸化程度与心室细胞间的电耦联障碍程度呈正相关,当心肌缺血得到缓解时,随着Cx43恢复磷酸化,心肌细胞间电耦联障碍可以逆转,心肌的收缩功能逐步恢复;一旦Cx43去磷酸化程度过于严重,则心肌电耦联和收缩功能的障碍不可逆转。
与应激相关的“阴性解剖”心源性猝死案例,在法医病理工作中并不少见,是法医病理学上一个亟待解决的难题。本研究结果显示,应激组小鼠心肌Cx43蛋白表达减少,分布于闰盘以外的细胞侧-侧连接区域,心性猝死组小鼠心肌Cx43表达呈点片状分布紊乱,表达量明显下降;应激组、心性猝死组心肌组织Cx43蛋白磷酸化水平较对照组明显下降。提示应激组小鼠与心性猝死组小鼠心肌Cx43表达及磷酸化水平相似,均出现不同程度的分布紊乱和下降,间接印证了恶性应激可导致心律失常甚至猝死。这一结论可为应激触发的心源性猝死案例的法医病理诊断提供理论依据。
| [1] | Mao WM,Zheng WH,Ling ZQ.Epidemiologic risk factors for esophageal cancer development[J].Asian Pac J Cancer Prev,2011,12(10):2461-2466. |
| [2] | Zhang Y.Epidemiology of esophageal cancer[J].World J Gastroenterol,2013,19(34):5598-5606. |
| [3] | 邢立莹,刘莉,礼彦侠,等.辽宁省6市2013年男性居民恶性肿瘤死亡水平及特征分析[J].中国公共卫生,2015,31(7):951-953. |
| [4] | Pennathur A,Gibson MK,Jobe BA,et al.Oesophageal carcinoma[J].Lancet,2013,381(9864):400-412. |
| [5] | 赵强,闻丹忆,孙建和.食管癌动物模型的建立[J].上海师范大学学报:自然科学版,2013,42(4):398-404. |
| [6] | 李步强,许健,李奇志,等.食管癌TE-1细胞生物学性状的相关性研究[J].中国现代医药杂志,2011,13(10):33-35. |
| [7] | Zhao BS,Liu SG,Wang TY,et al.Screening of microRNA in patients with esophageal cancer at same tumor node metastasis stage with different prognoses[J].Asian Pac J Cancer Prev,2013,14(1):139-143. |
| [8] | Liu SG,Qin XG,Zhao BS,et al.Differential expression of miRNAs in esophageal cancer tissues[J].Oncol Lett,2013,5(5):1639-1642. |
| [9] | Zang W,Wang Y,Du Y,et al.Differential expression profiling of microRNAs and their potential involvement in esophageal squamous cell carcinoma[J].Tumour Biol,2014,35(4):3295-3304. |
| [10] | Sakai NS,Samia-Aly E,Barbera M,et al.A review of the current understanding and clinical utility of miRNAs in esophageal cancer[J].Semin Cancer Biol,2013,23(6PtB):512-521. |
 2015, Vol. 31
2015, Vol. 31


