卵巢癌是妇科常见的恶性肿瘤之一,在全世界范围内,卵巢癌的病死率位居妇科恶性肿瘤的第5位[1]。由于其深居盆腔,早期患者并无明显症状,发病时多数已达晚期,尽管经过治疗后大多数患者可获得缓解,但仍有70%的患者会出现病情复发[2, 3]。目前化疗在卵巢癌的治疗中占有重要地位,但其疗效仍然不理想,因此,寻找一种有效的药物来抑制卵巢癌至关重要。目前分子靶向药物的研究主要集中在表皮生长因子受体酪氨酸蛋白激酶(epithelial growth factor receptor tyrosire protein kinase,EGFR TPK)上,其在多种恶性肿瘤均存在过表达[4],有研究表明,EGFR TPK抑制剂厄洛替尼是一种靶向的竞争性表皮生长因子受体酪氨酸激酶抑制剂,其对多种肿瘤细胞的生长均具有抑制作用[5, 6, 7]。山奈酚又名黄芪甙元、山奈黄素,属黄酮醇类化合物,主要来源于姜科植物山奈的根茎,具有抗炎、抗氧化、抗癌等多种生物活性及药理作用[8]。近年发现山奈酚对卵巢癌[9]、乳腺癌[10]、胃癌[11]、肺癌[12]等多种肿瘤有抑制作用,而山奈酚联合厄洛替尼对人卵巢癌是否有抑制协同作用尚未见报道。为探讨厄洛替尼和山奈酚对EGFR TPK的抑制作用,并阐明两者诱导卵巢癌细胞凋亡的协同作用机制,本研究拟以SKOV 3人卵巢癌细胞株为研究对象,通过体外和细胞实验初步探讨天然活性成分山奈酚联合厄洛替尼在治疗卵巢癌中的可能价值。结果报告如下。
1 材料与方法 1.1 主要试剂与仪器山奈酚(分析标准品,从姜根茎提取)20 mg[阿拉丁试剂(上海)有限公司,批号:K107144],其标准储备溶液用一定浓度的乙醇溶液进行配制,乙醇用量<3.0%,其浓度为100 μmol/L;厄洛替尼(盐酸厄洛替尼片,瑞士罗氏有限公司,国药准字J20090116),给药前超声1 h,浓度为15 g/L。Caspase GlooR3检测试剂盒 [Sigma aldrich(上海)贸易有限公司],RPMI 1640 培养基[赛默飞世尔生物化学(北京)有限公司],优级肽牛/小牛血清(自澳大利亚 PAA 公司),胰蛋白酶(美国 Gibco公司),二甲基亚砜(dimethyl sulfoxide,DMSO)(广州瑞舒生物科技有限公司);四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT),用5×103 mg/L的磷酸盐缓冲溶液(phosphate buffered saline,PBS)配制(北京鼎国昌盛生物技术有限责任公司)。SpectraMax Plus384酶标仪[美谷分子仪器(上海)有限公司],pHS 3C型酸度计(上海雷磁仪器厂),EPS 300电泳仪及电泳设备(上海天能科技有限公司),Bio Rad680型酶联检测仪(美国伯乐Bio rad公司)。SKOV 3人卵巢癌细胞来自中国科学院典型培养物种保藏委员会细胞库 /中国科学院上海生命科学研究院细胞资源中心,在本实验室进行培养。
1.2 方法 1.2.1 EGFR TPK活性检测 SKOV3人卵巢癌细胞用低渗酶提取缓冲液4 ℃提取,超声破碎细胞,离心,收集上清液,进行分装,在-80 ℃保存,之后参照文献[13]方法,将药物分别加入到用 PBS 洗过的 96 孔培养板中,每孔 10 μL,每浓度 3 孔。反应体系如下:70 μL 的 RT Buffer,20 μL含EGFR TPK的PBS溶液,反应系统总体积为100 μL,在37 ℃水浴1 h后,用洗液(50 mmol/L Tris HCl,pH 7.5、0.15 mol/L NaCl,0.05 mmol/L MgCl2,0.02% Tween20)清洗3次,除去未结合的游离底物,再每孔加入100 μL 1%牛血清白蛋白(albumin from bovine serum,BSA),室温封闭30 min,阻止生物素与链亲和素蛋白的非特异性结合,洗板,每孔加入50 μL 的SA ALP稀释液(100 ng/mL),37 ℃水浴 1 h,洗板,每孔加入10 μL不同浓度(0.1、0.5、1.0、2.5、5.0 mg/mL)的山奈酚和50 μL邻苯二胺(o phenylenediamine,OPD) 1 mg/mL,pH 9.5、37 ℃ 水浴30 min;每孔加入0.5 mol/L的NaOH终止反应。酶标仪测定490 nm波长处A值,以确定EGFR TPK的活性,同时设置不加药物的空白对照组和厄洛替尼组,计算酶的抑制作用=实验孔A值/空白对照孔A值。
1.2.2 SKOV 3人卵巢癌细胞侵袭转移能力检测[14]取对数生长期的SKOV 3人卵巢癌细胞,用完全培养液配制成细胞悬液,每孔250 μL,接种于96孔板中,在37 ℃、5%CO2、饱和湿度的环境下孵化24 h,待细胞完全贴壁生长后将细胞进行分组,空白对照组、厄洛替尼组和山奈酚组继续培养24 h,采用Transwell小室法构建体外侵袭模型,分别消化空白对照组、厄洛替尼组和山奈酚组的SKOV 3细胞,制成细胞悬液,并加于混合的条件培养基,甲醛固定15 min 后,常规苏木精-伊红染色法(hematoxylin eosin staining,HE)染色后于400倍光镜下计数膜背面侵袭的细胞数,并求出平均数。
1.2.3 SKOV 3人卵巢癌细胞凋亡蛋白caspase 3活性检测[15]采用 caspase GlooR3检测试剂盒,具体过程参照产品说明书。分析前将试剂与96孔板置于室温平衡,之后将SKOV 3人卵巢癌细胞以 15×104每孔接种于96孔板,选取不同浓度(0.1、1.0、2.5、5.0 mg/mL)的山奈酚和厄洛替尼处理 24、48、72 h 后,向细胞培养物中加等体积(1:1)的Caspase Glo试剂,置于震荡仪,以400 r/min转速轻轻震荡混合30 s,室温孵育60 min后,用酶标仪检测,并与厄洛替尼进行对比。
1.2.4 MTT法检测细胞生长抑制将对数生长期的SKOV 3人卵巢癌细胞,用0.25%胰蛋白酶消化单细胞,重悬于新鲜生长培养液中;细胞接种于96孔培养板,置37 ℃、5%CO2培养箱中培养过夜;根据实验设计,处理96孔板中的细胞,继续置37 ℃、5% CO2培养箱中培养,药物处理24、48、72 h后,直接于每孔中加入MTT溶液,37 ℃孵育2~4 h;室温静置至沉淀完全溶解(约10 min),用酶标仪(检测波长570 nm)检测各孔A值。取复孔平均值计算细胞死亡率=(空白A值-抑制剂A值/空白A值)。
1.2.5 山奈酚联合厄洛替尼对SKOV 3人卵巢癌细胞生长抑制协同作用检测根据文献[16]报告的方法,本研究稍作调整后对山奈酚联合厄洛替尼对SKOV 3细胞生长抑制作用的影响进行研究。Va 代表山奈酚单独存在时的抑制率,Vb 代表厄洛替尼单独存在时的抑制率,Vab代表山奈酚和厄洛替尼联合使用时的抑制率。如果Vab-Vc<-0.1,那么两者对SKOV 3人卵巢癌细胞生长的抑制作用为协同效应;如果-0.1<Vab-Vc<0.1,那么两者对SKOV 3人卵巢癌细胞生长的抑制作为加和效应;如果Vab-Vc>0.1,那么两者对SKOV 3人卵巢癌细胞生长的抑制作用为拮抗效应。
1.3 统计分析实验数据以 x±s表示,应用SPSS 11.0软件对数据进行统计学分析。组间比较采用单因素方差分析,两两比较采用最小显著差法,以 P<0.05 为差异有统计学意义。
2 结 果 2.1 EGFRTPK活性检测(图 1)如图 1所示,低浓度(0~1.0 mg/mL)的山奈酚对EGFR TPK活性的抑制作用不明显,随着浓度的进一步增大(1.0~4.0 mg/mL),山奈酚对EGFR TPK活性的抑制明显加强,但当山奈酚的浓度达到4.0 mg/mL后,山奈酚对EGFR TPK活性的抑制趋于平缓,其半数抑制浓度 (half maximal inhibitory concentration,IC50)为(2.33±0.32)mg/mL,与厄洛替尼的IC50(1.75±0.18)mg/mL较为接近,差异无统计学意义(P>0.05)。
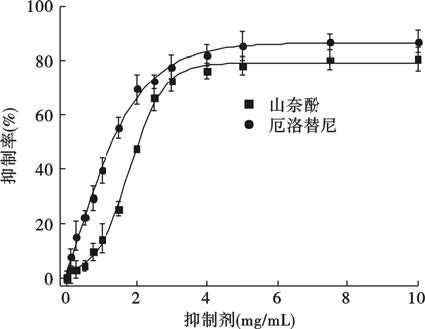
|
图 1 山奈酚和厄洛替尼对EGFR TPK的抑制作用 |
与空白对照组比较,0.1、0.5、1.0、2.5、5.0 mg/mL山奈酚和厄洛替尼组肿瘤细胞转移数量均减少,差异均有统计学意 义(P<0.05)。细胞活力检测结果显示,1.0、2.5、 5.0 mg/mL山奈酚组作用24、48、72 h后,SKOV 3 人卵巢癌细胞中凋亡蛋白caspase 3活性均高于空白对照组,差异均有统计学意义(P<0.05);0.1 mg/mL 厄洛替尼组作用72 h和1.0、2.5、5.0 mg/mL 厄洛替尼组作用24、48、72 h后,SKOV 3人卵巢癌细胞中凋亡蛋白caspase 3活性均高于空白对照组,差异均有统计学意义(P<0.05)。
|
|
表 1 不同组别SKOV 3人卵巢癌细胞转移数量、caspase 3活性比较( x±s,n=6) |
0.1 mg/mL山奈酚组作用48、72 h和 1.0、2.5、5.0 mg/mL 山奈酚组作用24、48、72 h后,SKOV 3人卵巢癌细胞生长抑制率均高于空白对照组,差异均有统计学意义(P<0.05);0.1、0.5、1.0、 2.5、5.0 mg/mL 厄洛替尼组作用24、48、72 h后,SKOV 3人卵巢癌细胞生长抑制率均高于空白对照组,差异均有统计学意义(P<0.01)。
|
|
表 2 不同组别SKOV 3人卵巢癌细胞生长抑制率(%) |
山奈酚和厄洛替尼协同能力检测结果显示,0.5 mg/mL 厄洛替尼与0.5、2.5和5.0 mg/mL 山奈酚联合使用对抑制SKOV 3人卵巢癌细胞生长均具有协同效应,2.5和5.0 mg/mL厄洛替尼与0.5、2.5和5.0 mg/mL山奈酚联合使用对抑制SKOV 3人卵巢癌细胞生长均具有加和效应。
|
|
表 3 山奈酚联合厄洛替尼对SKOV 3人卵巢癌细胞生长的抑制效应( x±s,n=6) |
表皮生长因子受体(epithelial growth factor receptor,EGFR)蛋白的异常高表达促使肿瘤细胞活化,长期处于无限增殖状态,是肿瘤形成的重要原因之一[17],本研究通过对山奈酚和厄洛替尼2种药物的抑制EGFR TPK能力和抑制SKOV 3人卵巢癌细胞生长的能力进行了评估,并对两者的联合用药进行了探讨,发现山奈酚和厄洛替尼对EGFR TPK的活性和SKOV 3细胞生长均具有良好的抑制能力,且能够诱导肿瘤细胞穿过人工基底膜的能力下降,很好阻碍了SKOV 3人卵巢癌细胞的转移。这是由于表皮生长因子(epithelial growth factor,EGF)本身具有酪氨酶激酶活性,一旦与EGFR组合可启动细胞核内的有关基因,从而促进细胞分裂增殖。EGFR是原癌基因c erbB1的表达产物,是表皮生长因子受体的家族成员之一。一旦EGFR TPK活性降低,可使SKOV 3人卵巢癌细胞中的EGFR降低,从而导致癌细胞自身衰落和转移能力下降。此外,山奈酚和厄洛替尼对SKOV 3人卵巢癌细胞生长的协同能力检测发现,当厄洛替尼在低浓度下,山奈酚联合厄洛替尼SKOV 3人卵巢癌细胞生长的抑制率具有较好的协同效应,而随着厄洛替尼浓度的增加,这种协同效应随之减弱,当厄洛替尼浓度达到2.5 mg/mL时,两者对SKOV 3细胞生长的抑制协同效应变为加和效应,这为天然活性成分山奈酚的使用提供了良好的理论依据,使其安全用药得以发展和应用。 在细胞凋亡过程中,酶联反应的终末因子是由caspase 3和caspase共同组成的[18, 19]。Caspase 3是导致细胞凋亡的关键酶,在实验过程中casepase 3能够催化底物Ac DEVD pNA产生黄色的pNA,其在 405 nm 附近紫外吸收,因此可以通过测定405 nm 吸光度来检测caspase 3的活性;本研究结果显示,经山奈酚和厄洛替尼处理后,caspase 3活性在不断地增加,提示山奈酚和厄洛替尼能够对caspase 3活性产生激活作用,进而对酶联反应进行有效的调控,最终对SKOV 3人卵巢癌细胞生长起到抑制作用[18]。
| [1] | Jemal A,Siegel R,Xu J,et al.Cancer statistics[J].CA Cancer J Clin,2010,60(5):277-300. |
| [2] | 孙弋雅,郭琳,刘乙蒙,等.卵巢癌中CK2α蛋白表达及其与MMP-2关系[J].中国公共卫生,2015,31(4):470-472. |
| [3] | 陈梦香,王春兰,张慧敏,等.晚期卵巢癌新辅助化疗的临床研究[J].河北医药,2008,30(6):788-790. |
| [4] | González Martín A.Molecular biology of cervical cancer[J].Clin Trans l Oncol,2007,9(6):347-354. |
| [5] | 刘显红,马丽霞,张爽,等.厄洛替尼治疗吉非替尼失败后晚期非小细胞肺癌的疗效[J].中国老年学杂志,2011,31(24):4790-4791. |
| [6] | Ma C,Wei S,Song Y.T790M and acquired resistance of EGFR TKI:a literature review of clinical reports[J].J Thorac Dis,2011,3(1):10-18. |
| [7] | 隆艳艳,王飞,石燕,等.厄洛替尼在晚期胰腺癌综合治疗中的作用[J].临床肿瘤学杂志,2011,16(12):1108-1111. |
| [8] | Luo H,Garyo R,Liu L,et al.Kaempferol inhibits angiogenesis and VEGF expression through both HIF dependent and independent pathways in human ovarian cancer cells[J].Nut Cancer,2009,61(4):554-563. |
| [9] | Luo H,Rankin GO,Li Z,et al.Kaempferol induces apoptosis in ovarian cancer cells through activating p53 in the intrinsic pathway[J].Food Chem,2011,128(2):513-519. |
| [10] | Choi EJ,Ahn WS.Kaempferol induced the apoptosis via cell cycle arrest in human breast cancer MDA-MB-453 cells[J].Nutr Res Pract,2008,2(4):322-325. |
| [11] | 杜标炎,周瑶,谭宇蕙,等.山奈酚对人胃癌MGC-803细胞的生长抑制及诱导凋亡作用[J].肿瘤,2010,30(6):477-480. |
| [12] | 廖峥嵘,沈永青,赵娟,等.山奈酚对人小细胞肺癌H446细胞凋亡的影响[J].河北师范大学学报,2011,35(5):510-512. |
| [13] | 张晓峰.不同药物对HT29细胞及其体外肿瘤移植模型作用[J].中国公共卫生,2014,30(10):1273-1275. |
| [14] | 董德刚,郭恩绵,张瑶,等.桂枝茯苓对宫颈癌HeLa细胞侵袭转移及MMP-2、MMP-9表达的影响[J].山东医药,2007,47(27):49-51. |
| [15] | 杨辉,谢辉,洪明,等.组蛋白去乙酰化酶抑制剂联合芬维A胺诱导人肝癌细胞凋亡的研究[J].临床医学工程,2012,19(11):1881-1883. |
| [16] | Cai S,Wang O,Wang M,et al. In vitro inhibitory effect on pancreatic lipase activity of subfractions from ethanol extracts of fermented oats (Avena sativa L.) and synergistic effect of three phenolic acids[J].J Agric Food Chem,2012,60(13):7245-7251. |
| [17] | Kim SJ,Rabbani ZN,Dong F,et al.Phosphorylated epidermal growth factor receptor and cyclooxygenase-2 expression in localized non-small cell lung cancer[J].Med Oncol,2010,27(1):91-97. |
| [18] | 王晶.秦皮甲素对人肺癌细胞A549凋亡影响[J].中国公共卫生,2015,31(4):464-466. |
| [19] | Yao G,Yang L,Hu Y,et al.None phenol-induced thymocyte apoptosis Involved caspase-3 activation and mitochondrial depolarization[J].Mol Immunol,2006,43(7):915-926. |
 2015, Vol. 31
2015, Vol. 31
