2. 环境污染与疾病监控省部共建教育部重点实验室
外源化合物在体内的生物转化过程中,代谢酶扮演着重要角色,它能把无活性的进入体内的环境致癌物代谢转变为亲电子化学物,后者可攻击细胞内DNA或蛋白质等大分子形成加合物最终引起癌基因和抑癌基因的变异而导致疾病的发生。细胞色素P-450是外源化学致癌物在体内生物转化第一时相最主要的代谢酶,其编码基因亚型中有CYP1A1和CYP2E1,且具基因多态性。其多态性可引起所编码酶的活性改变,从而影响外源化学物对不同个体可能造成的危害风险差异[1, 2, 3]。贵州省地方性砷中毒是以居民长期燃用高砷煤导致的以皮肤损害为典型临床表现的疾病,可引起皮肤癌、肺癌等。CYP1A1和CYP2E1基因多态性与砷中毒发病风险的研究鲜有报道,本研究检测燃煤型砷中毒患者CYP1A1和CYP2E1基因各基因型的分布情况,并分析各基因型与燃煤型砷中毒发病风险的关系,为深入阐释地方性砷中毒发病机制及筛选高危人群提供参考依据。
1 材料与方法 1.1 对象2006年以贵州省兴仁县交乐乡燃煤型砷中毒病区为调查点,参照地方性砷中毒诊断标准(WS/T211—2001)[4]选取经临床复查确诊130例燃煤型砷中毒患者为病例组。以距交乐乡13 km非燃用高砷煤且生活环境及习惯与病例组相似的140名健康居民作为对照组。调查对象均为汉族,排除既往放射线接触史、家族遗传病史及近期疾病感染史者。
1.2 主要试剂和仪器Mastercycler gradient PCR扩增仪(德国eppendorf公司);Ultrospec2100型核酸蛋白分析仪(美国安玛西亚中国有限公司);Gel Doc 2000凝胶成像分析系统(美国Bio-RAD公司);dNTPs、MgCl2、TaqDNA聚合酶(大连宝生物生物工程公司);引物(上海Sangon公司合成);Msp I内切酶、Pst I内切酶、Dra I内切酶(均为英国 BioLabs公司产品)。
1.3 方法 1.3.1 采集血样及DNA提取经研究对象知情同意后,收集其外周血2 mL,乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)抗凝,酚-氯仿法提取基因组DNA。
1.3.2 PCR-RFLP法检测各多态位点基因型运用聚合酶链反应-限制性片段长度多态性(polymerase chain reaction-restriction fragment length polymorphism,PCR-RFLP)法检测CYP1A1 Msp I、CYP2E1 Pst I和CYP2E1 Dra I多态位点基因型。PCR扩增引物序列及片段长度见表 1。PCR扩增体系:10×PCR 反应缓冲液、0.25 mmol MgCl2 1.5 mmol、10 μmol上下游引物各0.2 μmol、Taq DNA聚合酶1.25U,扩增总体积25 μL。PCR扩增条件为:94 ℃ 7 min后94 ℃ 50 s,62 ℃ 50 s(CYP1A1 Msp I); 57 ℃ 30 s(CYP2E1 Pst I); 60 ℃ 50 s(CYP2E1 Dra I); 72 ℃ 1 min,35个循环后72 ℃ 10 min。PCR产物10、7、8 μL分别与限制性内切酶Msp I(6U)、Pst I(8U)、Dra I(6 U)在 37 ℃条件下消化6、4、16 h,酶切产物经2.0%琼脂糖凝胶在140 V电压下电泳40 min,凝胶成像系统观察结果并拍照。
| 表 1 PCR扩增引物序列及片段长度 |
采用SPSS 13.0统计软件进行分析,χ2检验比较各组基因型构成比,比值比(odds ratio,OR)及其95%可信区间(95% confidence interval,95%CI)估计相对危险度,非条件 logistic回归计算校正后的ORadj值及95%CI。
2 结 果 2.1 一般情况病例组男性90例,女性40例,平均年龄(48.3±11.0)岁;对照组男性99人,女性41人,平均年龄(35.0±7.5)岁。经χ2检验,病例组与对照组性别构成差异无统计学意义(χ2=0.07,P=0.79),但年龄构成差异有统计学意义(χ2=88.88,P=0.00),实验结果经非条件 logistic回归分析校正。
2.2 基因型判断 2.2.1 CYP1A1 Msp I多态位点(图 1)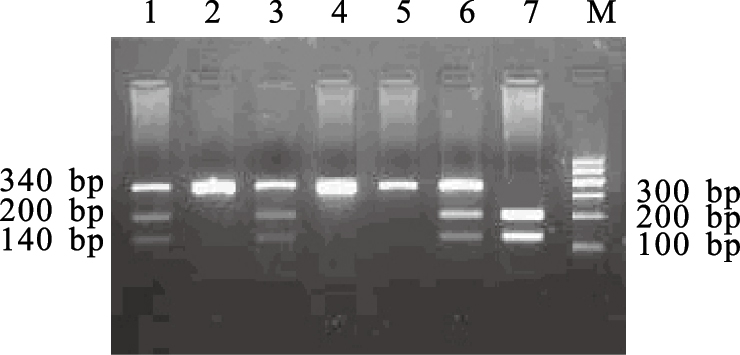 | 注:M:100bp DNA Marker;2,4,5:m1/m1基因型;1,3,6:m1/m2基因型;7:m2/m2基因型。图 1 CYP1A1 基因PCR扩增产物经Msp I限制性内切酶酶切后的琼脂凝胶电泳图 |
经Msp I酶切后出现340、200和140 bp 3个片段,其中m1/m1基因型(纯合野生型)仅340 bp 1个片段,m1/m2 基因型(杂合型)为340、200和140 bp 3个片段,m2/m2 基因型(纯合突变型)为200和140 bp 2个片段。
2.2.2 CYP2E1 Pst I 多态位点(图 2) | 注:M:100bp DNA Marker;2,3,4: c1/c1基因型;5:c1/c2基因型;1: c2/c2基因型。图 2 CYP2E1 基因PCR扩增产物经Pst I限制性内切酶酶切后的琼脂凝胶电泳图 |
经Pst I酶切后出现410、290和120 bp 3个片段,其中c1/c1 基因型(纯合野生型)仅410 bp 1个片段,c1/c2 基因型(杂合型)为410、290和120 bp 3个片段,c2/c2基因型(纯合突变型)为290和120 bp 2个片段。
2.2.3 CYP2E1 Dra I 多态位点(图 3)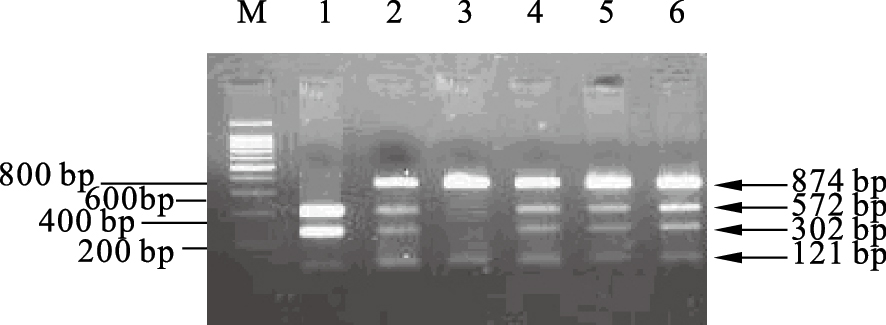 | 注:M:100bp DNA marker;1: DD基因型;2,4,5,6: DC基因型;3:CC基因型。图 3 CYP2E1 基因PCR扩增产物经Dra I限制性内切酶酶切后的琼脂凝胶电泳图 |
经Dra I酶切出现874、572、302 和121 bp 4个片段,其中DD 基因型(纯合野生型)为572、302和121 bp 3个片段,DC 基因型(杂合型)为874、572、302和121 bp 4个片段,CC 基因型(纯合突变型)为874和121 bp 2个片段。
2.2.4 各多态位点基因型分布频率 (表 2)| 表 2 各基因多态位点与燃煤型砷中毒发病风险的关系 |
CYP1A1 Msp I多态位点m1/m1、(m1/m2+m2/m2)基因型;CYP2E1 Pst I多态位点c1/c1、(c1/c2+c2/c2)基因型;CYP2E1 Dra I多态位点DD、(DC+CC)基因型在病例组和对照组间的频率,上述基因型在病例组与对照组之间的分布均无统计学差异(P值分别为0.341、0.574、0.972);各多态位点与燃煤型砷中毒的发病风险无统计学关联(经年龄性别校正后P值分别为0.433、0.219、0.832)。
2.2.5 各基因多态位点不同基因型之间的联合作用分析(表 3)| 表 3 各基因多态位点不同基因型之间联合作用与燃煤型砷中毒发病风险的关系 |
CYP1A1 Msp I和CYP2E1 Pst I、CYP1A1 Msp I和CYP2E1 Dra I、CYP2E1 Pst I和CYP2E1 Dra I不同基因型联合在病例组与对照组中的分布差异无统计学意义。
3 讨 论燃煤型砷中毒是中国特有的地方病,虽然政府采取了改炉改灶等措施减少了燃煤砷对村民的健康危害,但砷对机体的远期效应致病区病人病情有加重趋势,癌症患者增多[5, 6, 7]。研究表明,砷在体内的活化代谢产物是导致机体发生砷中毒的重要因素之一,而与遗传背景有关的基因多态性成为近年来砷中毒研究的热点[8, 9],其中代谢酶基因多态性被认为与砷在体内的活化代谢密切相关。本课题组前期研究发现[10, 11, 12],燃煤型砷中毒患者的发病风险与Ⅱ相代谢酶谷胱甘肽硫转移酶的基因多态性有关,在此研究基础上,课题组进一步对Ⅰ相代谢酶——细胞色素P-450与燃煤型砷中毒发病风险的关系进行研究。
CYP1A1是一种肝外氧化代谢酶,主要在肺组织内表达,编码芳烃羟化酶。CYP1A1基因主要存在四种基因多态位点,即Msp I位点、exon 7位点、AA位点和CYP1A1*4位点,目前以Msp I位点多态性与疾病易感性的关系研究较多。CYP2E1主要分布于肝脏,人肝微粒体CYP2E1催化能力有较大差异,其主要原因是来源于该基因5’-端上游调节区Pst I多态改变了该基因的转录活性、第六内含子区Dra I多态影响其酶的表达。在CYP1A1基因多态性与砷中毒关系研究方面,Adonis等[13, 14]报道,在智利高砷水接触人群中,CYP1A1 Msp I m2/m2基因型能引起吸烟者患肺癌的危险性增加(OR=2.08,95%CI=1.04~4.03)。目前未见CYP2E1基因多态性与砷中毒关系的报道。通过本研究,未发现CYP1A1 Msp I多态位点、CYP2E1 Pst I和CYP2E1 Dra I多态位点与燃煤型砷中毒发病风险有关,在基因-基因的联合作用分析时亦未观察到上述多态位点之间与燃煤型砷中毒的发病风险存在联合作用。分析原因可能与下列因素有关。其一,砷致癌机制复杂,代谢酶作用后真正底物及作用机制目前尚不完全明确,代谢酶基因多态性对燃煤型砷中毒或饮水型砷中毒发病风险的影响是否一致还有待更多研究证实。其二,不同种族的遗传背景不同,人种、个体及生活方式的差异可能导致对砷中毒反应不一致。其三,本研究为单中心的队列研究,因研究样本数量有限,未考虑基因-基因及基因-环境之间的作用对研究结果的影响。
本研究虽未发现CYP1A1和CYP2E1基因多态性与燃煤型砷中毒的发病风险有关,但本研究从遗传背景角度考虑砷中毒对机体的影响,为深入阐明砷中毒的分子机理研究积累了实验数据。本研究将有待于加大样本量,剔除某些影响因素后进一步深入研究。
| [1] | Ghisari M,Eiberg H,Long M,et al.Polymorphisms in phase I and phase II genes and breast cancer risk and relations to persistent organic pollutant exposure:a case-control study in Inuit women[J].Environmental Health,2014,13(1):19. |
| [2] | Agundez JA.Cytochrome P450 gene polymorphism and cancer[J].Curr Drug Metab,2004,5(3):211-224. |
| [3] | Bhat GA,Shah IA,Makhdoomi MA,et al.CYP1A1 and CYP2E1 genotypes and risk of esophageal squamous cell carcinoma in a high-incidence region,Kashmir[J].Tumour Biol,2014,35(6):5323-5330. |
| [4] | 《中华人民共和国卫生行业标准:地方性砷中毒诊断标准(WS/T211-2001)》[M].1版.北京:中国标准出版社, 2002,1-2. |
| [5] | Song N,Tan W,Xing D,et al.CYP 1A1 polymorphism and risk of lung cancer in relation to tobacco smoking:a case-control study in China[J].Carcinogenesis,2001,22(1):11-16. |
| [6] | Hong YC,Park HS,Ha EH.Influence of genetic susceptibility on the urinary excretion of 8-hydroxydeoxyguanosine of fire fighters[J].Occupational and Environmental Medicine,2000,7(6):370-375. |
| [7] | Kato S,Shields PG,Caporaso NE,et al.Analysis of cytochrome P450 2E1 genetic polymorphisms in relation to human lung cancer[J].Cancer Epidemiology Biomarkers and Prevention,1994,3(6):515-518. |
| [8] | 张爱华.生物标志物在地方性砷中毒研究中的应用及展望[J].中国地方病学杂志,2005,24(2):119-120. |
| [9] | 秦秀军,裴秋玲.几种砷代谢相关酶和转运蛋白及其遗传多态性的研究进展[J].中国地方病学杂志,2005,24(2):232-234. |
| [10] | 梁冰, 张爱华, 奚绪光, 等.谷胱甘肽硫转移酶M1和T1基因多态性与燃煤型砷中毒发病的关系[J].中国地方病学杂志, 2007, 26(1):71-74. |
| [11] | 梁冰, 张爱华, 奚绪光, 等.GSTO基因多态性与燃煤污染型砷中毒易感性的关系[J].环境与职业医学, 2007, 24(2):129-132. |
| [12] | 梁冰, 张爱华, 董学新.GSTO1 Glu155△Glu 基因多态性与燃煤污染型地方性砷中毒的关系[J].中国地方病学杂志, 2012, 3(1):132-135. |
| [13] | Adonis M,Martinez V,Marin P,et al.Smoking habit and genetic factors associated with lung cancer in a population highly exposed to arsenic[J].Toxicol Lett,2005,159(1):32-37. |
| [14] | Adonis M,Martine V,Marin P,et al.CYP1A1 and GSTM1 genetic polymorphisms in lung cancer populations exposed to arsenic in drinking water[J].Xenobiotica,2005,35(5):519-530. |
 2015, Vol. 31
2015, Vol. 31


