黄芩作为中国传统中药,药用历史悠久,分布广泛,资源十分丰富[1]。黄芩苷(baicalin)是从黄芩的干燥根中提取出的一种黄酮类化合物,是黄芩的主要有效成分之一[2]。中药黄芩苷具有解热、抗菌、抗炎、抗氧化、抗心脑血管疾病、免疫调节等药理作用[3]。黄芩苷的解热作用显著,其复方制剂在临床上也有较好的解热效果[4]。黄芩苷和柴胡组成的新博柴黄颗粒[5] 近年来在临床应用取得了较好的解热效果,同时由于黄芩苷有良好的抑菌作用,能减少合用抗生素的用量,降低其毒副反应,甚至使某些耐药菌转为敏感菌[6]。野黄芩苷对干酵母大鼠发热模型具有解热作用,解热作用强于阿司匹林[7]。研究发现,黄芩苷有明显的解热作用,其作用机制可能主要与减少tumor necrosis factor-α(TNF-α)和interleukin-1β(IL-1β)含量有关[8],本研究旨在探讨黄芩苷解热过程中Toll-like receptor 4(TLR4)介导的信号转导通路作用及机制。结果报告如下。
1 材料与方法 1.1 实验动物健康Sprague-Dawley大鼠40只,雌雄不限,4~6周龄,体重160~180 g,由扬州大学实验动物中心提供,许可证号:SCXK(苏)2004-2005。动物饲养环境为常规日夜周期,室温(22±2)℃,相对湿度(50±2)%,自由进食饮水。
1.2 主要试剂与仪器黄芩苷原料药(含量 95%)(四川百利药业有限公司);酵母(番禺梅山—马利酵母有限公司);MC142电脑数字型体温计[欧姆龙(大连)有限公司],使用前经标准温度计校正;肿瘤坏死因子α(tumor necrosis factor-α)、白介素1β(interleukin-1β )酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)试剂盒(美国R&D公司);RT-PCR试剂(大连宝生物公司);Toll样受体4(TLR4)、p65和IκBα一抗(江苏碧云天生物技术研究所);紫外全自动凝胶成像系统(英国SYNGENE公司);Bio-Rad电泳系统(美国Bio-Rad公司);梯度PCR分析仪(英国TECHNE TC-512);低温高速离心机(美国Sigma公司);DNM-9602G酶标分析仪(北京普朗新技术有限公司)。
1.3 动物分组处理和模型制备40只大鼠随机分为5组,每组8只,分别为对照组、模型组、黄芩苷低、中、高剂量组;对照组灌胃磷酸盐缓冲液(PBS)2 ml/kg+皮下注射生理盐水10 mL/kg;模型组灌胃 PBS 2 mL/kg+皮下注射酵母2 g/kg;黄芩苷低、中、高剂量组灌胃黄芩苷40、80、160 mg/kg+皮下注射酵母2 g/kg。大鼠发热模型复制:用无热原生理盐水将酵母配成20%悬液,按10 mL/kg容量经大鼠背部皮下注射,实验前3 d将大鼠置于实验环境中摸拟实验操作(包括捉拿、固定、安放温度计)使其适应实验条件,选取基础体温在37.5~38.5 ℃大鼠,第4 d开始正式实验;大鼠实验前10 h禁食,实验当日,每隔1 h测1次体温,取3次平均值作为基础体温,然后各组注射相应受试物,以后每间隔 2 h 记录1次体温,连续测量14 h。
1.4 指标与方法 1.4.1 血清IL-1β和TNF-α检测于发热高峰(8 h)时腹腔注射乌拉坦溶液1 g/kg麻醉大鼠,断头取血4 mL,3 000 r/min离心10 min,分离血清置于-20 ℃冰箱保存待测。ELISA法测定血清中IL-1β、TNF-α含量,按试剂盒说明书操作。
1.4.2 TLR4 mRNA表达检测采用RT-PCR法,取出全脑,于视交叉与灰结节之间取下丘脑速置液氮中,取下丘脑组织按1∶10(W∶V)加入生理盐水,匀浆15 s×3次,4 ℃离心(15 000 r/min,20 min),取上清-20 ℃保存[9]。取约100 mg大鼠脑组织于玻璃研磨器内,放入Trizol溶液,按试剂盒要求操作,提取总RNA。取约1 μg总RNA,进行反转录。逆转录条件:30 ℃ 10 min,42 ℃ 30 min,95 ℃ 5 min。TLR4引物:上游:5′-CTATCATCAGTGTATCGGTG-3′,下游:5′-CAGTCCTCATTCTGGCTC-3′(186 bp)。内参甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)引物序列上游:5′-AATGCATCCTGCCACCACCAACTGC-3′,下游:5′-GGAGGCCATGTAGTAGGCCATGAGGTC-3′(555 bp)。PCR 反应条件:94 ℃ 45 s,55 ℃ 50 s,72 ℃ 1 min 15 s。电泳结束后,置于凝胶成像系统进行观察,用凝胶图像分析系统对 RT-PCR 产物电泳条带进行密度分析,以 GAPDH 为内参,根据 TLR4 和 GAPDH 密度比值,计算TLR4 相对表达量。
1.4.3 脑组织中TLR4、p65、IκBα蛋白表达测定采用Western blot法,取约100 mg脑组织加入裂解液剪碎后移入1.5 mL EP 管中,超声粉碎,4 ℃ 12 000 r/min 离心 30 min,取上清用二辛可酸法进行蛋白定量;取等量样品进行变性十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,90 V 恒压,半干法将蛋白转移至硝酸纤维素膜,封闭,洗膜,加入 1:400稀释一抗,4 ℃ 杂交过夜,用洗膜液漂洗后加入 1:1 000 稀释二抗,摇床上杂交 1 h,用Tris-buffered saline and Tween 20冲洗3遍,每次 5 min,电化学发光显色,上机检测。以 β-actin 为内参,根据TLR4、p65、IκBα蛋白和 β-actin 密度比值,计算 TLR4、p65、IκBα相对表达量。
1.5 统计分析数据以(x±s)表示,采用SPSS 17.0软件进行统计分析,组间比较采用单因素方差分析,方差齐采用最小显著差法进行多重比较,方差不齐采用Dunnett′s T3 法进行多重比较。P < 0.05认为差异有统计学意义。
2 结果 2.1 黄芩苷对酵母性发热大鼠体温影响(表 1)模型组大鼠给药8 h时达到发热高峰,体温明显高于对照组(P<0.01);与模型组比较,黄芩苷中、高剂量组大鼠体温明显降低,差异有统计学意义(P<0.05)。
| 表 1 黄芩苷对酵母性发热大鼠体温影响(x±s,n=8,℃) |
与对照组比较,模型组大鼠血清中IL-1β、TNF-α含量明显升高(P < 0.05);与模型组比较,黄芩苷中、高剂量组大鼠血清中IL-1β、TNF-α含量均明显降低(P < 0.05)。
| 表 2 黄芩苷对大鼠血清中IL-1β、TNF-α含量影响(x±s,n=8) |
结果显示,与对照组比较,模型组大鼠脑组织中TLR4 mRNA表达明显增多(P < 0.01);与模型组比较,黄芩苷低、中、高剂量组大鼠脑组织中TLR4 mRNA表达水平降低,差异有统计学意义(P < 0.05)。
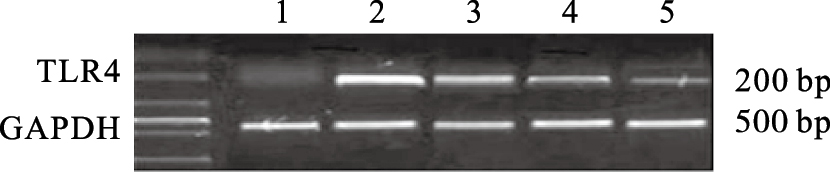 | 注:1:对照组;2:模型组;3~5:黄芩苷低、中、高剂量组。 图 1 黄芩苷对酵母性发热大鼠脑组织TLR4 mRNA表达影响 |
与对照组比较,模型组大鼠脑组织中TLR4、p65蛋白表达明显增加(P < 0.01),IκBα蛋白表达明显减少(P < 0.01);与模型组比较,黄芩苷中、高剂量组大鼠脑组织中TLR4、p65蛋白表达降低、IκBα蛋白表达明显增加(P < 0.05或P < 0.01)。
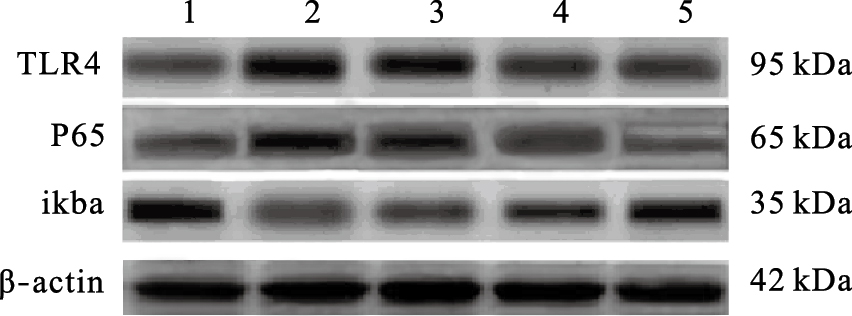 | 注:1:对照组;2:模型组;3~5:黄芩苷低、中、高剂量组。 图 2 黄芩苷对酵母性发热大鼠脑组织中TLR4、p65、IκBα蛋白表达影响 |
酵母菌属于真菌类,注射酵母混悬液可引起机体发热,其致热成分是菌体所含的荚膜多糖和蛋白质。酵母菌作用于机体后,可激活内生致热原细胞产生和释放内生致热原,引起体温升高[10]。本研究结果表明,模型组大鼠皮下注射酵母悬液后8 h达到发热高峰,体温明显高于对照组,而黄芩苷中、高剂量组大鼠体温明显低于模型组,且血清中IL-1β、TNF-α含量明显降低。提示黄芩苷对酵母所致发热大鼠的解热作用可能与其减少炎症细胞因子有关。
新克隆出来的 TLR4 是介导炎症及先天免疫反应的跨膜受体,TLR4 与配体结合后可引起NF-κB 的活化,调控炎症和免疫相关基因表达[11]。正常情况下,NF-κB以p65/p50二聚体形式存在并且IκBα的磷酸化与降解是NF-κB活化的关键步骤[12]。本研究结果显示,与对照组比较,模型组大鼠脑组织中TLR4 mRNA、TLR4蛋白表达明显增多,黄芩苷低、中、高剂量组大鼠脑组织中TLR4 mRNA、TLR4蛋白表达水平明显下降。
本研究结果还显示,酵母致热大鼠脑组织中IκBα蛋白表达明显减少及P65核转位增加;而黄芩苷组大鼠脑组织中p65 表达下降,IκBα表达升高。提示,黄芩苷对酵母所致大鼠发热具有缓解作用,其解热机制可能与TLR4/NF-κB信号通路有关。
| [1] | 文敏, 李雪, 付守廷.黄芩苷的药理作用研究新进展[J].沈阳药科大学学报, 2008, 2:158-162. |
| [2] | 朱淼, 李琳, 张腾龙, 等.黄芩苷对小鼠金黄色葡萄球菌肺炎的保护作用研究[J].北方药学, 2014, 11(6):65-68. |
| [3] | 周必英, 周冷.黄芩苷对卡氏肺孢子虫肺炎大鼠TNF-α和IL-8的影响[J].中国公共卫生, 2009, 25(10):1250-1251. |
| [4] | 李倩楠, 葛晓群.黄芩苷及黄芩复方制剂解热作用机制研究进展[J].Journal of International Pharmaceutical Research, 2008, 35(5):342-345. |
| [5] | 许峰, 胡兰, 陈永富, 等.新博柴黄冲剂对急性呼吸道感染患儿体温干预机制的初步研究[J].儿科药学杂志, 2004, 10(1):53-54. |
| [6] | 延卫东, 王端君, 何琰, 等.黄芩苷药理作用研究进展[J].陕西中医, 2002, 23(12):1127-1129. |
| [7] | 徐珊, 孟庆刚.黄芩提取物解热作用及机制研究进展[J].中华中医药学刊, 2008, 26(6):1179-1181. |
| [8] | 李倩楠, 葛晓群.黄芩苷的解热作用及对细胞因子的影响[J].中国中药杂志, 2010, 35(8):1068-1072. |
| [9] | 孙淑玉, 许继平, 李玉莲, 等.癫痫大鼠经免疫球蛋白干预后脑组织匀浆中免疫细胞因子变化的实验研究[J].山东大学学报, 2005, 43(9):827-828. |
| [10] | 叶红, 朱李娜, 冯甲棣, 等.丁香酚对酵母菌发热大鼠血浆及脑脊液中精氨酸加压素含量的影响[J].中国医科大学学报, 2006, 35(3):260-264. |
| [11] | Heidi E, Carolyn W, Stefan E, et al.The toll-like receptor 4-antagonist eritoran reduces murine cardiac hypertrophy[J].European Journal of Heart Failure, 2011, 1(15)∶602-610. |
| [12] | Zeuke S, Ulmer AJ, Kusumoto S, et al.TLR4-mediated inflammatory activation of human coronary artery endothelial cells by LPS[J].Cardiovasc Res, 2002, 56(1):126-134. |
 2015, Vol. 31
2015, Vol. 31
