随着微波技术的广泛应用,接触微波辐射的暴露人群越来越多,其辐射生物效应也日益受到关注。研究发现,微波辐射可引起学习记忆等脑结构和功能损伤[1, 2],但其机制尚不明确。研究表明,突触素I一方面通过磷酸化作用调节神经递质释放,另一方面通过对突触结构影响,从而在突触可塑性中起到一定作用[3]。突触素Ⅰ有多个磷酸化位点,分别受环磷酸腺苷依赖蛋白激酶、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、Ⅰ型和Ⅱ型依赖蛋白激酶(Ca2+/CaM)和细胞周期素依赖性激酶5(cyclin-dependent kinase 5,Cdk5)催化[4]。本研究拟观察微波辐射对突触素I磷酸化及其相关激酶影响,探讨其在微波辐射所致囊泡循环和氨基酸递质释放中作用,为阐明微波辐射致学习记忆障碍的机制提供依据。结果报告如下。
1 材料与方法 1.1 原代海马神经元培养取出生12 h以内Wistar大鼠(军事医学科学院),许可证号:SCXK-(军)2012—2004,剥离海马,切成1~2 mm3组织块,用0.125%胰蛋白酶37 ℃下消化25 min,吹打分散,离心制成细胞悬液。按5×105个/mL密度接种细胞,置于37 ℃、5%的CO2培养箱,24 h更换培养基,将种植液换为饲养液,每周半量换液2次,为抑制非神经元过度增殖,在培养的第4天向培养基中加入适量阿糖胞苷(每皿中加阿糖胞苷储备液30~50 μL,终浓度为3~5 μg/mL),培养10 d后使用。
1.2 辐射方法采用军事医学科学院自建微波模拟源进行辐射,原代神经元接种于35 mm培养皿中,放在辐射台上接受辐射。平均功率密度分别为30 mW/cm2,辐射时间为5 min。对照组仅放置于辐射台上5 min,不给予辐射。
1.3 指标与方法 1.3.1 海马神经元Ser-62/67及Ser-553位点突触素I磷酸化表达检测采用免疫荧光法,原代海马神经元培养10 d后,于辐射前加入Ser-62/67及Ser-553位点调控激酶抑制剂U0126和roscovitine(终浓度10 μmol/L),作用30 min;于辐射后1、6、12 h,1、2、3 d,分别取细胞爬片,甲醇丙酮(1:1)固定15 min,于4 ℃保存,以新鲜爬片进行血清封闭,0.01%TritonX-100细胞膜打孔,一抗分别以磷酸化细胞外调节激酶(phosphorylated extracellular signal-regulated kinase,p-ERK)、Cdk5、Ser-62/67及Ser-553磷酸化突触素I进行标记,37 ℃孵育1 h,4 ℃过夜,二抗以异硫氰酸荧光素(fluorescein isothiocyanate,FITC)及四甲基异硫氰酸罗丹明(tetramethylrhodamine isothiocyanate,TRITC)进行标记,常温孵育1 h,PI/Hochest染核,封片,激光共聚焦显微镜观察。
1.3.2 海马神经元氨基酸递质检测采用高效液相色谱法,原代海马神经元培养10 d后,于辐射前加入U0126和roscovitine(终浓度10 μmol/L),作用30 min;于辐射后6 h,采用30 mmol/L KCl刺激2 min后,取上清;1000 r/min离心5 min,取上清;加入10%磺基水杨酸(V/V=3:2),5 000 r/min离心15 min;取上清,4 ℃保存;用高效液相色谱检测氨基酸神经递质,5 L衍生试剂内加入1 L样品,振荡2 min,进样针加样6 L;测得数据为被测氨基酸所占峰面积(A样),根据标准品峰面积(A标)和浓度(C标)比,计算被测氨基酸浓度:C样(mg/mL)= C标×A样/A标。
1.3.3 海马神经元突触囊泡循环观察采用time-lapse法,原代海马神经元培养10 d,于辐射前加入U0126和roscovitine(终浓度10 μmol/L),作用30 min;于辐射后6 h,采用冰浴的缓冲液洗3次,加入5 μg/mL FM1-43染液,37 ℃孵育2 min,time-lapse实时观察囊泡循环情况。
1.4 统计分析数据以x±s表示,采用SPSS 11.0软件进行统计分析,多组间比较采用方差分析,辐射组与假辐射组比较,采用t检验,P<0.05为差异有统计学意义。
2 结果 2.1 微波辐射对海马神经元Ser-62/67及Ser-553位点突触素I磷酸化影响海马神经元Ser-62/67位点突触素I磷酸化表达于辐射后6 h~2 d明显减少,Ser-553位点突触素I磷酸化表达于辐射后12 h内明显减少,1 d后基本恢复。
2.2 抑制剂对海马神经元p-ERK及Ser-62/67、Ser-553位点突触素I磷酸化影响(图 1)与对照组比较(图 1A、B),U0126组神经元内p-ERK与Ser-62/67位点(图 1C、D)突触素I磷酸化表达减弱;单纯辐射组与辐射+U0126组神经元p-ERK(图 1E、G)与Ser-62/67位点(图 1F、H)突触素I磷酸化表达明显减弱。
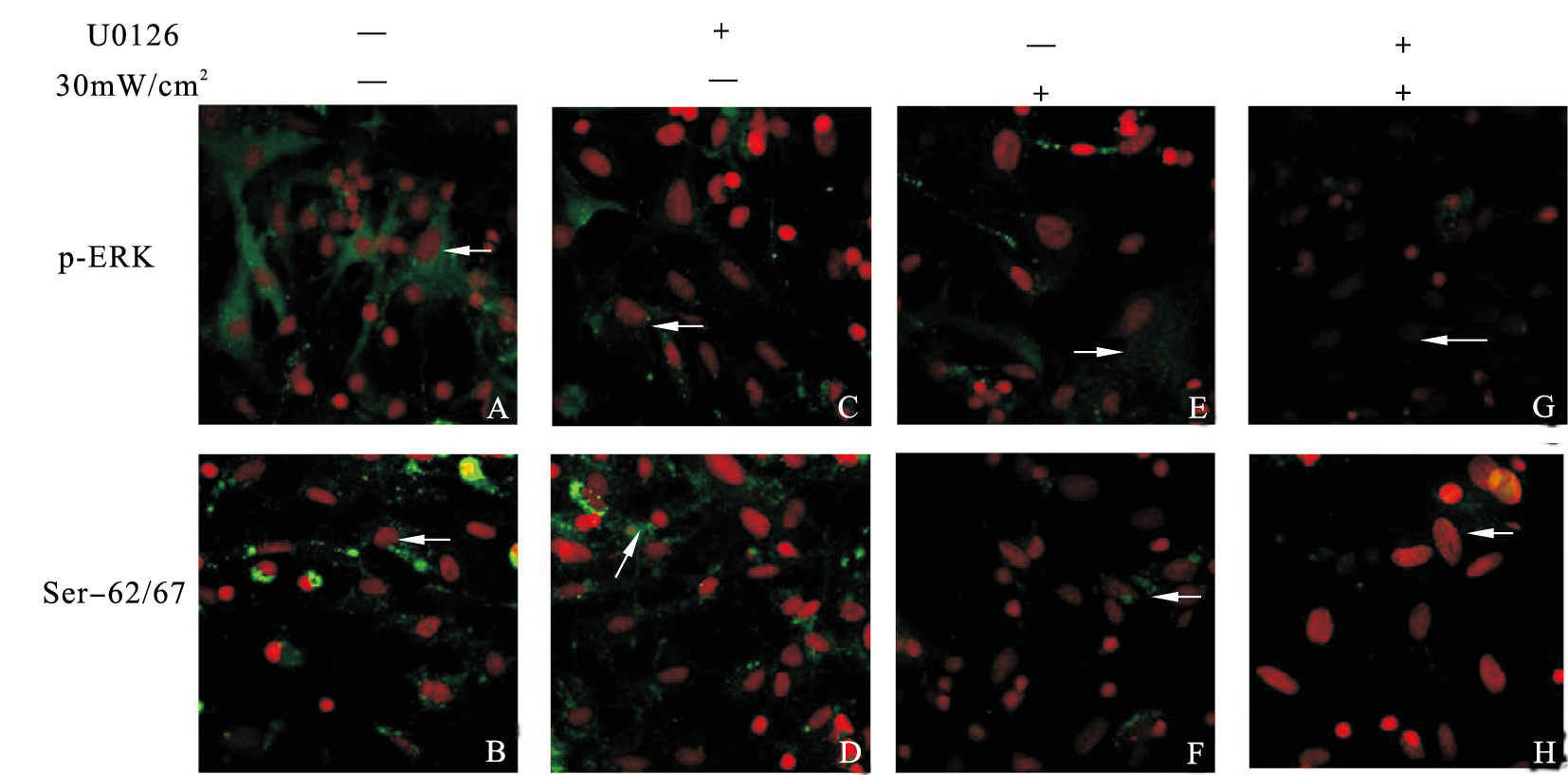 | 注:A、B:对照组;C、D:U0126组;E、F:单纯辐射组;G、H:辐射+U0126组。 图 1 U0126对微波辐射后海马神经元p-ERK及Ser-62/67突触素I磷酸化影响(×400) |
与对照组比较(图 2A),roscovitine组(图 2C)、单纯辐射组(图 2E)及辐射+roscovitine组(图 2G)Cdk5表达均明显减少;与对照组比较(图 2B),单纯辐射组(图 2F)与辐射+roscovitine组(图 2H)Ser-553位点磷酸化突触素I表达减少。
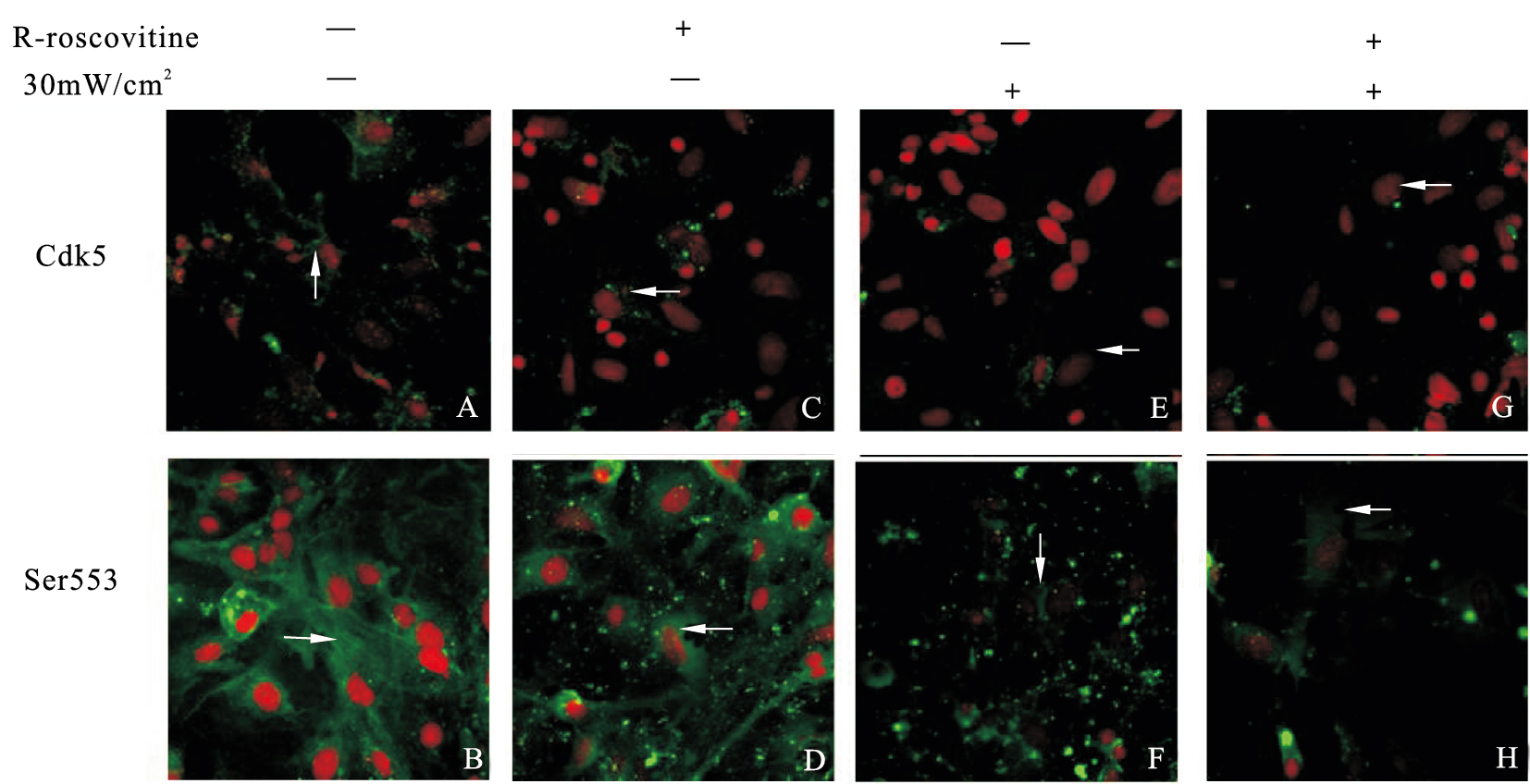 | 注:A、B:对照组;C、D:roscovitine组;E、F:单纯辐射组;G、H:辐射+roscovitine组。 图 2 给予roscovitine微波辐射后海马神经元Ser-553突触素I磷酸化表达改变(×400) |
辐射后γ-氨基丁酸(γ-aminobutyric acid,GABA)和甘氨酸释放明显减少。与单纯辐射组比较,给予roscovitine并辐射后GABA释放明显增加,给予U0126对辐射后氨基酸释放未见明显影响。
| 表 1 抑制剂对微波辐射后海马神经元氨基酸递质释放影响(mg/mL,x±s,n=5 ) |
与对照组比较,30 mW/cm2辐射后6 h,海马神经元囊泡循环速度减慢;单纯给予丝裂原活化蛋白激酶的抑制剂U0126后囊泡循环速度也减慢,但单纯给予Cdk5抑制剂roscovitine后,囊泡循环速度未见明显改变;辐射+U0126或roscovitine囊泡循环速度均减慢;辐射+roscovitine组海马神经元囊泡循环速度明显慢于单纯辐射组。
3 讨论突触前突触囊泡可摄取神经递质,携递质至突触前膜,与前膜锚定、融合,并释放到突触间隙。突触素I以磷酸化形式参与囊泡转运递质过程,并促进递质释放和再循环,突触素I存在多个磷酸化位点,受不同蛋白激酶催化。研究发现,30 mW/cm2微波辐射可引起海马突触素I表达增加,但其磷酸化改变尚不明确[5]。本研究结果显示,微波辐射后p-ERK活性降低,突触素I Ser-62/67位点的磷酸化受到抑制,进而使囊泡锚定于突触前膜障碍;而Cdk5活性降低,可促进突触素I Ser-553位点的磷酸化,进而促使囊泡锚定于突触前膜,但微波辐射早期对Cdk5的影响较弱,未能使其发挥保护性作用。本研究结果还显示,微波辐射后抑制性氨基酸释放障碍,且Cdk5活性降低可能通过促进突触素I Ser-553位点磷酸化而使包含有GABA的囊泡锚定障碍。
苯乙烯类荧光染料可用于标记追踪囊泡的胞吞胞吐及循环过程[6, 7]。磷酸化突触素I参与递质释放及囊泡循环过程[8, 9]。本研究结果表明,微波辐射后ERK抑制可通过下调突触素I Ser-62/67位点磷酸化而使囊泡循环受抑制;辐射后Cdk5激酶活性受抑制,突触素I Ser-553位点磷酸化受抑制,加重了辐射所致囊泡循环障碍。Cdk5在中枢神经系统发育、突触前膜的囊泡循环、轴突运输等多方面发挥重要作用[10, 11],这可能与Cdk5参与突触传递其他环节有关。
综上,30 mW/cm2微波辐射后可通过下调海马神经元ERK活性,抑制突触素I Ser-62/67位点磷酸化而使囊泡循环受抑制,囊泡锚定障碍;辐射可通过下调Cdk5表达,促进突触素I Ser-553位点磷酸化,而利于含GABA的囊泡锚定于突触前膜,但抑制囊泡循环。
| [1] | Kesari KK, Kumar S, Behari J.Pathophysiology of microwave radiation:effect on rat brain[J].Appl Biochem Biotechnol, 2012, 166(2):379-388. |
| [2] | Zhao L, Peng RY, Wang SM, et al.Relationship between cognition function and hippocampus structure afer long-term microwave exposure[J].Biomed Environ Sci, 2012, 25(2):182-188. |
| [3] | Bogen IL, Jensen V, Hvalby O, et al.Synapsin-dependent development of glutamatergic synaptic vesicles and presynaptic plasticity in postnatal mouse brain[J].Neuroscience, 2009, 158(1):231-241. |
| [4] | Yamagata Y, Jovanovic JN, Czernik AJ, et al.Bidirectional changes in synapsin I phosphorylation at MAP kinase-dependent sites by acute neuronal excitation in vivo[J].J Neurochem, 2002, 80(5):835-842. |
| [5] | 王丽峰, 彭瑞云, 胡向军, 等.微波辐射对大鼠大脑皮层和海马突触囊泡相关蛋白的影响[J].中国公共卫生, 2007, 23(10):1155-1157. |
| [6] | Gu F, Fu L, Ma YJ.Functional analysis of calcium channel-mediated exocytosis in synaptic terminals by FM imaging technique[J].Neurosci Bull, 2009, 25(4):216-220. |
| [7] | Clayton EL, Cousin MA.Quantitative monitoring of activity-dependent bulk endocytosis of synaptic vesicle membrane by fluorescent dextran imaging[J].J Neurosci Methods, 2009, 185(1):76-81. |
| [8] | Cui Y, Costa RM, Murphy GG, et al.Neurofibromin regulation of ERK signaling modulates GABA release and learning[J].Cell, 2008, 135(3):549-560. |
| [9] | Orenbuch A, Shalev L, Marra V, et al.Synapsin selectively controls the mobility of resting pool vesicles at hippocampal terminals[J].J Neurosci, 2012, 32(12):3969-3980. |
| [10] | Barnett DG, Bibb JA.The role of Cdk5 in cognition and neuropsychiatric and neurological pathology[J].Brain Res Bull, 2011, 85(1-2):9-13. |
| [11] | Hisanaga S, Endo R.Regulation and role of cyclin-dependent kinase activity in neuronal survival and death[J].J Neurochem, 2010, 115(6):1309-1321. |
 2015, Vol. 31
2015, Vol. 31


