2. 青岛大学基础学院;
3. 内蒙古科技大学包头医学院
滥用酒精已经成为世界致残致死五大危险因素之一[1],酒精能引起一系列的肝脏损伤,进而形成酒精性肝病(alcoholic liver disease,ALD),其病理表现为脂肪肝,肝纤维化,肝硬化[2]。动物实验证实酒精可以导致铁在肝脏中过度蓄积,Kew[3]研究发现铁过载可诱导肝损伤,并且可能会诱发肝细胞癌,Zhang等[4]研究发现铁与酒精表现出强烈的协同促氧化作用 。柠檬烯为单萜烯类化合物,临床用于治疗胆囊炎。此外,右旋柠檬烯(D-柠檬烯)还有抑制胃食管反流和促进胃肠健康蠕动、镇静中枢神经、缓解心绞痛、抗菌等作用[5]。研究表明柠檬烯对肝脏氧化应激有保护作用,并且能抑制肝癌细胞生长[5]。本研究通过酒精灌胃建立肝损伤动物模型,观察D-柠檬烯对酒精性肝损伤大鼠肝脏铁浓度(liver iron concentration,LIC)、血浆铁调素(hepcidin,HEPC)、铁蛋白(serum ferritin,SF),血幼素(hemojuvelin,HJV)水平变化,探讨柠檬烯对酒精性肝损伤引起的铁过载拮抗作用,结果报告如下。
1 材料与方法 1.1 主要试剂与仪器D-柠檬烯(美国sigma公司),分子式为C10H16,浓度为98%,HEPC检测试剂盒(北京诺亚杰生物科技有限公司),SF、HJV检测试剂盒(上海迪奥公司)。7500cx电感耦合等离子体质谱仪(ICP-MS)(美国Agilent公司);微波消解仪(美国CEM公司);密封消解罐(聚四氟乙烯材料)(滨海县正信仪器厂);分析天平(精密度0.1 mg)(上海民桥精密科学仪器有限公司);ELx808酶标仪(西安明克斯检测设备有限公司);LEICARM2135 切片机(德国Leica Biosystems公司)。
1.2 动物分组与处理2月龄无特定病原体(specific pathogen-free,SPF)级雄性Wistar大鼠70只,体重180~220 g,由青岛派特福德白鼠养殖专业合作社提供,许可证号:SYXK(鲁)2013-0001,适应性喂养7 d;按体重随机分为7组,每组10只。对照组,每天用生理盐水灌胃1次,连续6周,前2周每日给予0.9%生理盐水8 mL/kg,后4周12 mL/kg;模型组,前2周每日给予50%酒精8 mL/kg,后4周12 mL/kg;柠檬烯低、中、高剂量组,分别给予D-柠檬烯100、200、400 mg/kg;柠檬烯对照组,每日给予D-柠檬400 mg/kg;甘利欣(阳性对照)组,剂量200 mg/kg。柠檬烯低、中、高剂量组、甘利欣组大鼠给予酒精剂量与方法同模型组,对照组与柠檬烯对照组大鼠给予等量蒸馏水,连续6周。末次灌胃后,禁食12 h,不禁水,称重后给予7%水合氯醛0.5 mL/100 g 腹腔注射麻醉,经腹主动脉取血,剥离肝脏,分离血清,保存于-80 ℃冰箱中备用。
1.3 指标与方法 1.3.1 肝组织形态结构观察采用苏木精-伊红(hematoxylin-eosin staining,HE)染色法,将肝脏组织用10%中性甲醛固定后,常规石蜡包埋,切片,脱蜡,HE染色,中性树胶封片,光学显微镜(×400)下观察各组大鼠肝脏形态学改变。
1.3.2 肝脏超微结构观察采用透射电镜法,肝组织4%戊二醛灌流固定,包埋,制作切片,电镜(×10 000)下观察肝脏组织超微结构变化。
1.3.3 肝组织铁含量测定采用ICP-MS法,取大鼠肝脏0.4 g,置于消解罐中,加入0.5 mL硝酸,再加入0.5 mL高氯酸,高氯酸加2次,于微波消解仪中消解,冷却,将消化液转移至10 mL离心管中,用双蒸水定容至刻度,混匀,上机检测;同时做空白对照。
1.3.4 血浆HEPC、SF、HJV含量测定采用试剂盒法,实验步骤严格按照试剂盒说明书进行,在450 nm处用酶标仪测吸光度(A)值,根据标准曲线得出HEPC、SF、HJV含量。
1.4 统计分析实验数据采用x±s表示,采用 SPSS 17.0 软件对数据进行统计分析,组间比较采用单因素方差分析,两两比较采用最小显著差法检验,P<0.05 为差异有统计学意义。
2 结 果 2.1 D-柠檬烯对酒精性肝损伤大鼠肝脏病理形态学影响HE染色结果显示,对照组大鼠肝组织结构完整,肝细胞以中央静脉为中心向四周呈放射状排列,肝细胞无变性、坏死等形态学改变;模型组大鼠肝小叶结构紊乱,肝组织呈弥漫性大泡性脂肪变性,肝小叶纤维组织增生明显,并可见点灶状坏死,坏死区有炎细胞浸润,汇管区有大量炎细胞浸润;与模型组比较,柠檬烯组大鼠肝细胞坏死程度明显减轻;柠檬烯低剂量组大鼠肝脏大泡性脂变、中央静脉周围脂变明显、汇管区大量炎细胞浸润,柠檬烯中剂量组大鼠肝脏可见大量空泡、脂肪变性形成少量大脂滴、汇管区有少量炎细胞浸润,柠檬烯高剂量组大鼠肝细胞以中央静脉为中心向四周呈放射状整齐排列,大小较一致,无明显脂滴,少量空泡,汇管区少量炎细胞浸润;柠檬烯对照组与甘利欣组大鼠肝细胞以中央静脉为中心向四周呈放射状整齐排列,肝窦无扩张,肝细胞无变性,坏死等形态学改变,汇管区有少量炎细胞浸润。
2.2 D-柠檬烯对酒精性肝损伤大鼠肝组织超微结构影响(图 1)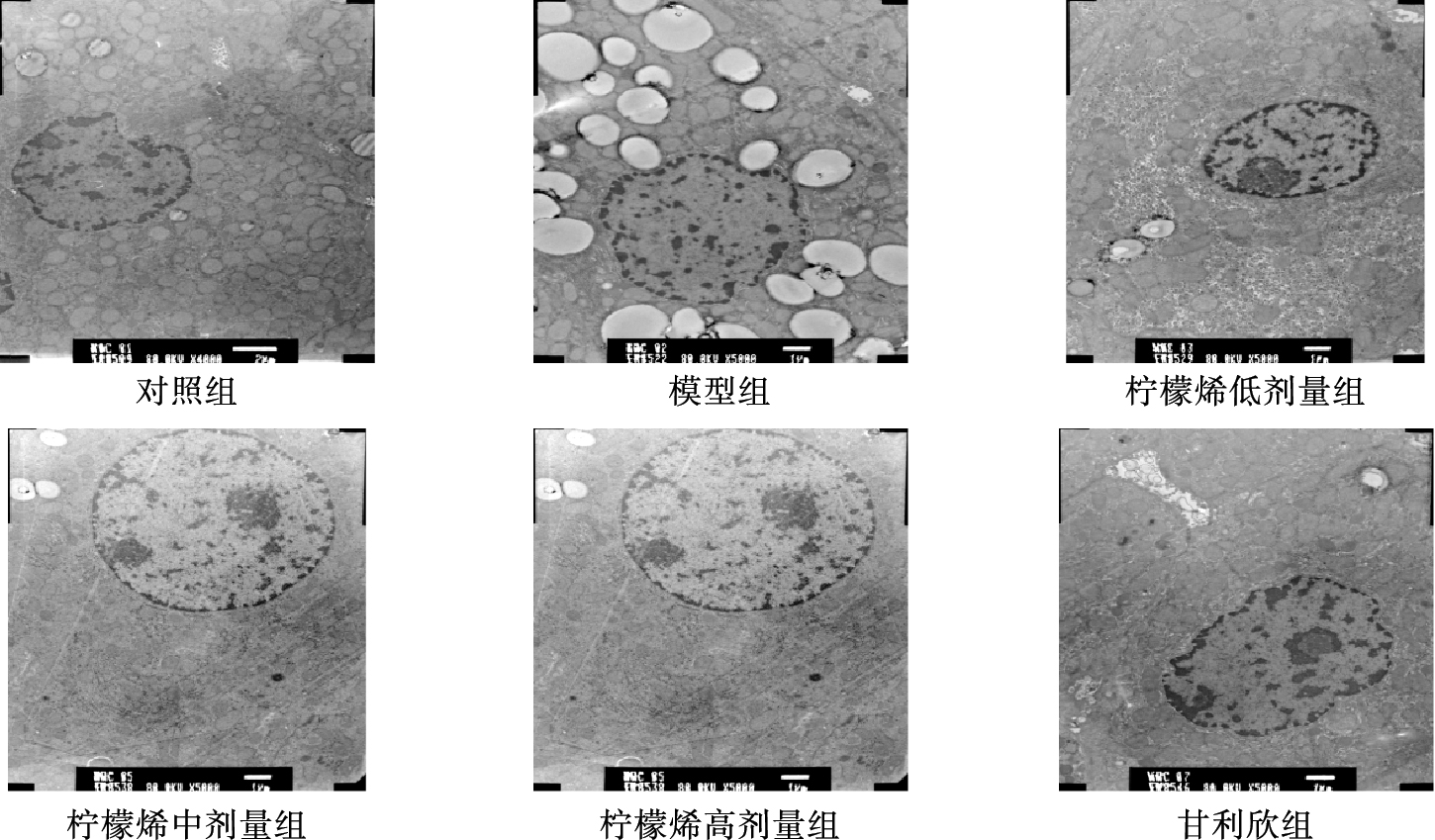 | 图 1 D-柠檬烯对大鼠肝细胞超微结构影响(×10 000) |
结果显示,对照组大鼠肝细胞形态结构正常,线粒体、高尔基体形态正常;模型组大鼠肝细胞脂滴多,线粒体形状不规则,嵴断裂模糊,次级溶酶体数量增加,微绒毛数量有所减少,胶原纤维化明显;与模型组比较,柠檬烯低剂量组大鼠肝细胞胞浆脂滴数量减少、核膜比较完整、线粒体形状较规则、次级溶酶体减少,柠檬烯中剂量组大鼠肝细胞胞浆脂滴数量减少、线粒体病变明显减轻且数目增加、粗面内质网退化与排列紊乱程度改善,柠檬烯高剂量组大鼠肝细胞胞浆脂滴数量减少,核膜完整,线粒体形状较规则,次级溶酶体减少。与模型组比较,甘利欣组大鼠肝细胞脂滴较少,偶见溶酶体,线粒体正常。
2.3 D-柠檬烯对酒精性肝损伤大鼠LIC、血浆SF、HEPC、HJV影响(表 1)| 表 1 D-柠檬烯对酒精性肝损伤大鼠LIC、HEPC、SF、HJV影响(x±s) |
试验过程中模型组3只大鼠死于操作技术不当。与对照组比较,模型组大鼠肝脏铁含量、血浆SF水平明显上升(P<0.05),血浆HEPC、HJV水平明显下降(P<0.05);与模型组比较,各剂量柠檬烯组大鼠肝脏铁含量、血浆SF水平下降,HEPC、HJV水平升高,差异有统计学意义(P<0.05)。
3 讨 论研究表明,萜类化合物具有广泛地生理学与药理学活性,如抗氧化、抗肿瘤、抑菌、调节血脂,抗炎等作用[6]。戈娜[7]研究表明,海兔素可以显著下调酒精性肝损伤大鼠体内诱导型一氧化氮合酶表达,减少一氧化氮过量生成,减轻酒精引起的肝组织损伤。Li等[8]研究报道,人参皂苷能激活Nrf2通路,从而显著减轻酒精引起的肝组织纤维化。D-柠檬烯是一种天然的功能性萜类化合物,具有抗肝癌作用。铁是人体必需元素之一,维持人体正常生理功能离不开铁元素,但是如果铁过量,则会对身体造成一定的伤害。除铁代谢相关基因变异和外源性铁摄入过多之外,某些病理情况也可导致铁过载。长期大量饮酒使血浆和肝组织(小叶中央区)中含铁血黄素明显升高,导致铁在肝脏中沉积,加重肝脏功能损害。而铁又可通过Haber-Weiss反应,最终造成肝细胞死亡,而肝细胞的死亡又会进一步加重肝脏铁过载,形成恶性循环。而打破这一恶性循环的关键在于消除铁过载[9]。在成人体内大约有4~5 g铁,70%以血红蛋白和肌红蛋白的形式存在于骨骼和血液中,当体内铁超负荷时,70%铁则沉积在肝中。铁蛋白为机体内一种贮存铁的可溶组织蛋白,血浆铁蛋白浓度与体内储存的铁成正比。铁调素是维持铁稳态极其重要的负调节激素[10],通过调节铁的吸收和利用而维持机体铁平衡。铁调素表达水平受体内铁含量,红血球生成活跃程度,体内低氧状况的影响。Goodnough等[11]研究发现,过量饮酒可以使铁调素转录下调,肠道铁转运蛋白表达增加,促进肠道铁吸收,最终导致肝脏铁异常堆积。铁调素的高表达能够抑制铁的超负荷从而改善肝损伤[12]。血幼素是一种糖化磷脂酰肌醇锚连的膜蛋白,是一种重要的铁调素调节蛋白,控制铁调素的编码基因表达在正常范围内[13]。
本研究结果表明,酒精模型组大鼠肝脏总铁含量、血浆铁蛋白水平明显高于对照组,而铁调素、血幼素表达明显低于对照组;酒精模型组大鼠肝脏细胞内线粒体数量减少,脂滴增多,粗面内质网排列紊乱,并且有大量炎细胞浸润等肝脏损伤的病理表现;柠檬烯各剂量组大鼠肝脏总铁含量、血浆铁蛋白水平明显低于模型组,铁调素与血幼素明显高于模型组,且肝脏病变减轻,脂滴减少,粗面内质网排列紊乱与退化程度有所改善。提示 D-柠檬烯对酒精性肝损伤大鼠的铁过载有一定拮抗作用,其机制可能与上调肝脏铁调素水平有关。
| [1] | Torruellas C,French SW,Medici V,et al.Diagnosis of alcoholic liver disease[J].World Journal of Gastroenterology,2014,20(33):11684-11699. |
| [2] | 张桂英,吴光健,王宝贵,等.白桦脂醇对大鼠酒精性肝损伤保护作用[J].中国公共卫生,2009,25(3):378-379. |
| [3] | Kew MC.Hepatic iron overload and hepatocellular carcinoma[J].Livr Cancer,2014,3(1):31-40. |
| [4] | Zhang ZY,Liu D.Taurine supplementation reduces oxidative stress and protects the liver in an iron-overload murine model[J].Molecular Medicine Reports,2014,10:2255-2262. |
| [5] | 李思思,王涛.右旋柠檬烯的研究进展及其新型专利技术[J].河南医学研究,2013,22(4):636-638. |
| [6] | Cheung FW,Li C,Che CT,et al.Geoditin A induces oxidative stress and apoptosis on human colon HT29 cells[J].Marine Drugs,2010,8(1):80-90. |
| [7] | 戈娜.海兔素对慢性酒精性肝损伤大鼠肝超微结构及NO和iNOS的影响[J].中国海洋药物,2014,33(3):63-68. |
| [8] | Li JP,Gao Y,Chu SF,et al.Nrf2 pathway activation contributes to anti-fibrosis effects of ginsenoside Rg1 in a rat model of alcohol and CCl4-induced hepatic fibrosis[J].Acta Pharmacologica Sinica,2014,35:1031-1044. |
| [9] | 马明霞,任源.表没食子儿茶素没食子酸酯对酒精性肝病小鼠肝脏Tf和TfRl表达的影响[J].中国实验方剂学杂志,2013,19(1):268-271. |
| [10] | Chaiung B,Chston T,Marks J,et a1.Hepcidin decreases iron transporter expression in vivo in mouse duodenum and spleen and in vitro in THP-1 macro-phages and intestinal Caco-2 cells[J].The Journal of Nutrition,2009,139(8):1457-1462. |
| [11] | Goodnough JB,Ramos E,Nemeth E,et a1.Inhibition of hepcidin transcription by growth factors[J].Hepatology,2012,56(1):291-294. |
| [12] | 韦远欢,施文祥,任源,等.EGCG 对酒精性肝病小鼠肝脏铁调素表达影响[J].中国公共卫生,2014,30(3):305-307. |
| [13] | Przybyszewska J,Zekanowska E.The role of hepcidin and haemojuvelin in the pathogenesis of iron disorders in patients with severe malnutrition[J].Annals of Agricultural and Environmental Medicine,2014,21(2):336-338. |
 2015, Vol. 31
2015, Vol. 31


