2. 贵州医科大学病理学教研室 贵州 贵阳 550004
氟是一种卤族化学元素,多以氟化物的形式广泛存在于自然界。氟作为人体必需的微量元素之一,每日约需1.0~1.5 mg,在生理代谢过程中,发挥着不可替代的作用。人与动物可从多种途径摄入氟,当体内的氟含量增多导致机体器官损伤时,称为地方性氟中毒(地氟病)。氟中毒时可干扰肝细胞的正常生理功能,引起肝脏结构、功能异常[1, 2, 3, 4]。研究表明刺猬(hedgehog,Hh)信号通路可以在氟中毒大鼠肝脏中表达[5]。本研究通过饮水方式制备大鼠慢性氟中毒模型[6],观察Hh信号通路在氟中毒大鼠肝脏中表达变化及意义,结果报告如下。
1 材料与方法 1.1 主要试剂与仪器 总RNA提取试剂Trizol(美国Invitrogen公司),RT-PCR试剂盒(美国Thermo公司),兔抗鼠印度刺猬蛋白(Indian hedgehog,Ihh)、跨膜蛋白(smoothened protein,Smo)、胶质瘤相关癌基因(glioma-associated oncogene homolog 1,Gli1)蛋白多克隆抗体(美国Santa Cruz公司),十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(dodecyl sulfate sodium salt-polyacrylamide gel electrophoresis,SDS-PAGE)试剂(美国Bio-Rad公司),总超氧化物歧化酶(total superoxide dismutase,T-SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、谷氨酰胺合成酶(glutamine synthetase,GS)、脂质过氧化物(lipid peroxide,LPO)检测试剂盒(南京建成生物公司)、GTVisionTM II 型免疫组化试剂盒(上海基因科技有限公司)。5810-R型台式冷冻离心机(德国 Eppendorf公司),OLYMPUS CH20显微镜(德国 Leica公司),BIOMIAS-2001高清晰度图像分析系统(四川大学图像图形研究所),ELX800UV 酶标仪(美国Bio-Rad公司)。 1.2 动物分组与处理4~5周龄、健康Sprague-Dawley(SD)大鼠36 只(第三军医大学大坪医学动物实验中心,许可证号:SCXK(渝)2007-0005,饲养1周后按体重随机分为3组,每组12只,雌雄各半;对照组大鼠饮用自来水(含氟量<2 mg/L);低、高氟组大鼠饮用含氟化钠的自来水(含氟量分别为5、50 mg/L);喂养6个月后股动脉放血(取血清-80 ℃冰箱保存)处死大鼠。取肝脏左叶组织,部分4%中性甲醛固定,余放于-80 ℃冰箱保存待用。
1.3 指标与方法 1.3.1 大鼠一般状况观察 饲养期间隔天观察大鼠牙齿、饮食、毛发光泽度、日常活动等状况,记录临床症状。 1.3.2 大鼠骨氟、尿氟含量测定染氟结束时用代谢笼收集大鼠24 h尿液,氟离子选择电极法测定尿氟含量,处死大鼠后,分离右后肢股骨,采用灰化-氟离子选择电极法测定骨氟含量。
1.3.3 大鼠肝功能检测取保存于-80 ℃血清,采用自动生化仪检测各组大鼠血清中谷草转胺酶(aspartate transaminase,AST)、谷丙转胺酶(alanine transaminase,ALT)的活性及总蛋白、白蛋白含量。
1.3.4 肝脏组织病理学观察采用苏木素-伊红(hematoxylin eosin,HE)染色法,取适量4%中性甲醛浸泡的肝组织做石蜡切片,脱蜡至水洗后苏木精染色2 min,1%盐酸酒精分化20 s,1%碳酸锂反蓝30 s,伊红染色30 s,梯度酒精脱水,透明、封片,在光镜下观察大鼠肝脏组织的形态学改变。
1.3.5 Hh信号通路相关因子蛋白表达检测(1)免疫组化envision二步法:石蜡切片常规脱蜡至水,3%H2O2孵育20 min,高压修复2.5 min,取出自然冷却至室温,封闭液孵育20 min,滴加Ihh、Smo、Gli1(1:100)稀释的一抗4 ℃过夜。次日取出复温5 min,依次加入二抗及辣根过氧化物酶分别孵育25 min;二氨基联苯胺显色,流水终止反应;苏木素复染,脱水、透明、封片。以磷酸盐缓冲液(Phosphate-buffered Saline,PBS)代替一抗作为空白对照。Ihh、Smo、Gli1阳性反应为细胞浆及细胞核出现黄色或棕黄色颗粒,采用BIOMIAS-2001分析软件测定每张标本中Ihh、Smo、Gli1积分光密度(IOD),IOD值高低与阳性表达成正比。(2)Western blot法:提取大鼠肝脏组织蛋白,采用二喹啉甲酸(bicichoninic acid,BCA)法进行蛋白定量,蛋白经SDS-PAGE分离后,转到聚偏氟乙烯膜,用5%牛血清蛋白封闭1 h,4 ℃孵育一抗 Ihh、Smo、Gli1(1:200)过夜,次日室温孵育二抗(1:3 000)1 h,曝光显影,以β-actin蛋白条带作为内参照进行Image J灰度分析。
1.3.6 Hh信号通路相关因子mRNA表达检测采用real-time-PCR法,取肝脏组织于研磨器中研磨,加入 Trizol试剂,按常规方法提取肝组织RNA。按照反转录试剂盒说明书进行RT-PCR反应。以β-actin作为内参,Ihh、Smo、Gli1引物由上海捷瑞生物工程有限公司设计合成。Ihh上游引物:5′-GCCCAGGTCCACCTAGAAAC-3′,下游:5′-CTCTCA GCCTGTTTGGCTCA-3′;Smo上游:5′-ATGCGTGTTTCTTTGTGGGC-3′,下游:5′-ACACAGGATAGGGTCTCGCT-3′;Gli1上游引物:5′-TGGAAGG GGACATGTCTAGC-3′,下游: 5′-GCTCACTGTTGATGTGGTGC-3′;β-actin上游引物:5′-CGTAAAGACCTCTATGCCAACA-3′,下游: 5′-AGCCA CCAATCCA CACAGAG-3′。PCR反应体系为20 μL,反应条件为:95 ℃ 10 min;95 ℃ 15 s,60 ℃ 30 s,72 ℃ 30 s;共40个循环,60 ℃ 10 min终止反应,PCR产物经2.0%琼脂糖凝胶电泳后,采用凝胶成像系统进行扫描分析。
1.3.7 肝组织中氧化应激指标检测采用黄嘌呤氧化酶法测定肝组织中T-SOD活力,化学比色法测定GSH-Px和GS活力,硫代巴比妥酸法测定LPO含量。
1.4 统计分析 数据以x±s表示,采用SPSS 19.0软件进行统计分析,多组间均数比较采用单因素方差分析,两两比较采用最小显著差法,以P<0.05为差异有统计学意义。 2 结 果 2.1 染氟对大鼠一般状态影响饲养期间,对照组大鼠皮毛光滑,食欲良好,活跃,牙齿无明显病变;随染氟时间延长,低氟组大鼠出现食欲减退,活动度下降,皮毛无光泽,牙齿有轻微白垩改变;高氟组大鼠精神萎靡、嗜睡,食欲减退,运动明显减少,皮毛无光泽,牙齿白垩改变明显。
2.2 染氟对大鼠骨氟、尿氟含量影响(表 1)| 表 1 染氟对大鼠骨氟、尿氟含量影响(x±s,n=12) |
与对照组比较,随染氟剂量升高,染氟组大鼠骨氟、尿氟含量逐渐升高,差异有统计学意义(P<0.05),呈剂量效应关系。
2.3 染氟对大鼠肝功能影响(表 2)| 表 2 染氟对大鼠肝功能影响(x±s,n=12) |
与对照组比较,随染氟剂量升高,染氟组大鼠血清中ALT和AST活性逐渐升高,呈剂量效应关系(P<0.05);与对照组比较,低、高剂量染氟组大鼠血清中总蛋白、白蛋白含量逐渐降低,差异有统计学意义(P<0.05)。
2.4 染氟对大鼠肝组织病理结构影响光镜观察显示,对照组大鼠肝脏细胞大小一致,细胞排列呈条索状,以中央静脉为中心呈放射状分布;低氟组大鼠肝细胞索排列紊乱,肝细胞肿大,部分肝细胞胞浆透明,呈水样变性;高氟组大鼠肝脏可见肝索紊乱,细胞高度水肿呈气球样改变,部分肝细胞轮廓不清,部分肝细胞膜消失或可见核固缩。
2.5 染氟对Hh信号通路因子蛋白表达影响(表 3、图 1)| 表 3 染氟对大鼠肝组织中Hh信号通路因子蛋白表达影响 (x±s,n=12) |
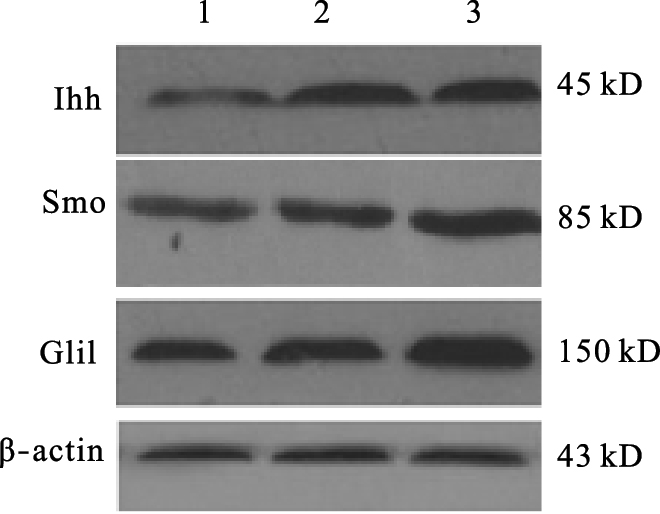 | 注:1~3:分别为对照组、低、高剂量染氟组。 图 1 染氟对大鼠肝组织中Hh信号通路因子蛋白表达影响 |
免疫组化结果显示,对照组大鼠肝组织中Ihh、Smo、Gli1蛋白表达较少,细胞着色较少,颜色较淡;与对照组比较,随染氟浓度增加Ihh、Smo、Gli1蛋白表达的细胞数目增多,颜色加深;差异有统计学意义(P<0.05)(表 3);Western blot结果显示,与对照组比较,各剂量染氟组大鼠肝组织中Ihh、Smo、Gli1蛋白表达明显增加(图 1)。
2.6 染氟对大鼠肝组织中Hh通路因子mRNA表达影响(表 4、图 2)| 表 4 染氟对大鼠肝组织中Hh信号通路因子mRNA表达影响 (x±s,n=12) |
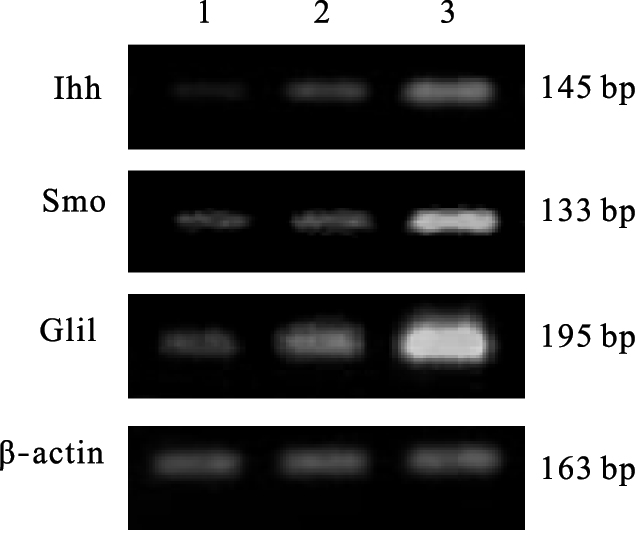 | 注:1~3:分别为对照组、低、高剂量染氟组。 图 2 染氟对大鼠肝组织中Hh信号通路因子蛋白表达影响 |
与对照组比较,染氟组大鼠肝组织中Hh信号通路因子Ihh、Smo、Gli1 mRNA表达均升高,呈剂量效应关系(P<0.05)。
2.7 染氟对大鼠肝组织中氧化应激指标影响(表 5)| 表 5 氟对大鼠肝组织中氧化应激指标影响(x±s,n=12) |
与对照组比较,各剂量染氟组大鼠肝组织中T-SOD、GSH-Px及GS活性明显降低,LPO含量升高,差异有统计学意义(P<0.05),呈剂量效应关系。
3 讨 论肝脏是机体解毒的器官,血清中AST和ALT活性可反映肝脏受损程度,总蛋白和白蛋白可反映肝脏的合成功能。本研究结果显示,与对照组比较,染氟组大鼠尿氟、骨氟含量随染氟浓度增加而升高,血清中AST和ALT活性逐渐增加,而TP和ALB的含量下降;肝组织形态学观察显示,染氟组大鼠肝细胞变性,部分出现坏死、纤维组织增生。与已有结果一致[7],表明饮水型慢性氟中毒肝损伤模型制备成功。研究表明慢性氟中毒可导致肝细胞发生变性、坏死、纤维化和凋亡,可能与氧化应激、细胞凋亡、信号通路的激活有关[8, 9]。
Hh信号通路在哺乳动物中存在3个同源基因:sonic hedgehog、Indian hedgehog 和 desert Hedgehog,分别编码Shh、Ihh和Dhh蛋白,其中Ihh蛋白则是软骨内成骨过程中的关键性调节因子;Shh蛋白参与胚胎肢芽不对称性发育和中枢神经系统发育过程,是表达最广泛且潜能最大的同源基因,Dhh则与生殖细胞的发生有关。Hh信号通路存在patched(Ptch)和smoothened(Smo)2种膜蛋白受体。Smo属于G蛋白偶联受体超家族的一员,具有转导Hh信号的作用,是Hh信号向胞内转导的中心环节,负责细胞内信号的传导[10]。其下游锌指结构转录因子Gli家族有 Gli1、Gli2、Gli3蛋白3个成员,Gli1蛋白是介导或扩大Hh信号反应的激动剂[11],激活时可诱导目标基因表达;Gli2、Gli3功能复杂,在不同环境中可对Hh信号起激动或抑制作用[10]。研究发现,Hh信号通路在肝脏疾病发生、发展中起着重要调节作用[12, 13],通常情况下,Hh信号通路激活与表达是短暂且受控的,在不同组织、器官需要不同的Hh信号通路表达水平来发挥其正常功能,通路失调可以导致无节制的细胞增殖,引起相应器官功能的严重紊乱[14, 15, 16]。本研究结果显示,随染氟浓度增加,大鼠肝组织中Ihh、Smo、Gli1 蛋白及mRNA表达逐渐增加。提示,Hh信号通路可能与慢性氟中毒肝损伤的发病机制有关。
氟是化学性质极为活泼的元素,机体摄入过量氟后,氟可直接攻击氧,干扰氧代谢导致氧自由基增多,诱导机体发生脂质过氧化,导致抗氧化酶活性降低,造成体内脂质过氧化。SOD/LPO及GSH-Px/LPO比值可作为客观反映体内氧化与抗氧化功能指标[17]。研究发现氟中毒大鼠血清和肝组织中LPO含量升高,而SOD和GS活性明显降低,表明氟中毒时体内氧化和抗氧化系统失衡,机体脂质过氧化增强而抗氧化能力减弱[18, 19]。研究发现氧化应激损伤可刺激Shh释放,自闭症中氧化应激和Shh可以协同调节丙二醛(MDA)、Bcl-2、SOD、GSH-Px的表达[12, 20]。本研究结果显示,染氟组大鼠肝组织中T-SOD、GSH-Px、GS活力下降,LPO含量升高,表明慢性氟中毒时大鼠体内氧化系统和抗氧化系统失衡,机体脂质过氧化增强而抗氧化能力减弱,从而引起慢性氟中毒大鼠肝组织的损伤。与已有结果[21, 22]一致。提示,Hh信号通路可能与氧化应激共同参与氟中毒肝损害发病过程。
| [1] | 李广生.地方性氟中毒发病机制[M].北京:科学出版社,2004:20-31. |
| [2] | 于燕妮,曹序茂,肖开棋,等.慢性氟中毒大鼠肝脏损伤的形态计量学研究[J].中国地方病学杂志,1990,9(1):1-3. |
| [3] | 孙景春,徐辉,张桂珍,等.氟中毒家兔肝细胞凋亡与肝功能损害[J].中国地方病防治杂志,2001,16(3):129-131. |
| [4] | Tuncer MC,Ozturk H,Buyukbayram H,et al.Interaction of L-arginine-methyl ester and sonic hedgehog in liver ischemia-reperfusion injury in the rats[J].World J Gastroenterol,2007,13(28):3841-3846. |
| [5] | Zhao L,Yu Y,Deng C.Protein and mRNA expression of Shh,Smo and Gli1 and inhibition by cyclopamine in hepatocytes of rats with chronic fluorosis[J].Toxicol Lett,2014,225(2):318-324. |
| [6] | 陈锡山,于燕妮,易韦,等.氟对大鼠成骨细胞Wnt3a、β-链蛋白mRNA和蛋白表达的影响[J].中华地方病学杂志,2013,32(2):140-145. |
| [7] | 李惠兰,于燕妮,陈扬,等.燃煤污染型氟中毒大鼠Mn-超氧化物歧化酶mRNA和蛋白水平的改变[J].中华病理学杂志,2012,41(9):627-630. |
| [8] | Wang AG,Xia T,Chu QL,et al.Effects of fluoride on lipid peroxidation,DNA damage and apoptosis in human embryo hepatocytes[J].Biomed Environ Sci,2004,17(2):217-222. |
| [9] | Gutierrez-Salinas J,Morales-Gonzalez JA,Madrigal-Santillan E,et al.Exposure to sodium fluoride produces signs of apoptosis in rat leukocytes[J].Int J Mol Sci,2010,11(9):3610-3622. |
| [10] | Denef N,Neubuser D,Perez L,et al.Hedgehog induces opposite changes in turnover and subcellular localization of patched and smoothened[J].Cell,2000,102(4):521-531. |
| [11] | Mullor JL,Sanchez P,Ruizi AA.Pathways and consequences:hedgehog signaling in human disease[J].Trends Cell Biol,2002,12(12):562-569. |
| [12] | Ghanizadeh A.Malondialdehyde.Bcl-2,superoxide dismutase and glutathione peroxidase may mediate the association of sonic hedgehog protein and oxidative stress in autism[J].Neurochem Res,2012,37(4):899-901. |
| [13] | Xia YP,Dai RL,Li YN,et al.The protective effect of sonic hedgehog is mediated by the phosphoinositide[corrected]3-kinase/AKT/Bcl-2 pathway in cultured rat astrocytes under oxidative stress[J].Neuroscience,2012,209:1-11. |
| [14] | Stoick-Cooper CL,Moon RT,Weidinger G.Advances in signaling in vertebrate regeneration as a prelude to regenerative medicine[J].Genes Dev,2007,21(11):1292-1315. |
| [15] | Sicklick JK,Li YX,Jayaraman A,et al.Dysregulation of the hedgehog pathway in human hepatocarcinogenesis[J].Carcinogenesis,2006,27(4):748-757. |
| [16] | Katoh Y,Katoh M.Hedgehog target genes:mechanisms of carcinogenesis induced by aberrant hedgehog signaling activation[J].Curr Mol Med,2009,9(7):873-886. |
| [17] | 于燕妮,周永,张华.燃煤污染型氟中毒患者抗氧化系统的变化[J].中华预防医学杂志,2000,34(6):347. |
| [18] | 刘连,徐园园,许洁,等.氟对大鼠肝功及GSH-Px 基因表达影响[J].中国公共卫生,2010,26(5):647-648. |
| [19] | 陈杨,于燕妮,吕学霞,等.氧化应激在燃煤污染型氟中毒大鼠中的作用[J].中国实用医药,2008,3(4):1-3. |
| [20] | Fitch PM,Howie SE,Wallace WA,et al.Oxidative damage and TGF-β differentially induce lung epithelial cell sonic hedgehog and tenascin-C expression:implications for the regulation of lung remodelling in idiopathic interstitial lung disease[J].Int J Exp Pathol,2011,92(1):8-17. |
| [21] | Deutsch G,Jung J,Zheng M,et al.A bipotential precursor population for pancreas and liver within the embryonic endoderm[J].Development(Cambridge,England),2001,128(6):871-881. |
| [22] | Zhou YX,Mo SL,Wang RH,et al.Corn baked by burning coal triggered overexpression of osteopontin in hepatocytes of rats following fluorosis[J].ToxicolInd Health,2012,28(3):195-202. |
 2015, Vol. 31
2015, Vol. 31


