中国目前水污染情况严重,据预测,2015年废水排放量将达到810亿吨[1]。目前水污染主要包括工业污染源、农业污染源和生活污染源。工业污染源为水域的重要污染源,它具有量大、面广、成分复杂、毒性大、不易净化、难处理等特点;农业污染源包括牲畜粪便、农药、化肥等。生活污染源主要是城市生活中使用的各种洗涤剂和污水、垃圾、粪便等,多为无毒的无机盐类,生活污水中含氮、磷、硫多,致病细菌多[2]。研究表明,河道中浮游细菌的组成与生物量的变化与水环境质量密切相关,进一步了解水中的微生物种类和组成,有助于利用微生物进行水化净化和修复,从而达到控制水污染的目的[3]。当今,变性梯度凝胶电泳(denaturing gradient gel electrophoresis ,DGGE)技术广泛应用于环境科学、污染防治、环境微型生物群落多样性和动态分析的研究中[4]。我们以浙江省杭州市常见的3个污染水体为对象,利用DGGE检测不同污染源的水中细菌多样性及组成,为修复水环境技术提供理论依据。
1 材料与方法 1.1 样品采集根据目前的水体污染情况,本实验有选择性采集生活污染源、畜禽粪便污染源和化工污染源,实验分为7组:(1)滨文河生活污水;(2)老虎洞村河生活污水;(3)萧山养牛场旁边河道畜禽粪便污水;(4)珊瑚沙养牛场旁边河道畜禽粪便污水;(5)浦沿化工厂旁边河道化工污水;(6)萧山印染厂旁边河道化工污水;(7)未污染水(虎跑山泉)。鉴于以上水域的流动性均不大,采样时,将干净的空瓶盖上塞子,塞子上系一根绳,瓶底系一铁砣,沉入离水面0.2~0.5 m处,然后拉绳拔塞让水灌满瓶后取出。每个河道采样10份,共采集70份水样。
1.2 主要仪器与试剂DcodeTM DGGE电泳仪(美国Bio-Rad公司);Nikon YS100光学显微镜(日本尼康公司);PCR system 2700 型基因扩增仪(美国Bio-Rad公司);Gel Doc 2000凝胶成像系统(美国Bio-Rad公司);智能生化培养箱(宁波海曙赛福实验仪器厂);IXUS 105 Cannon数码相机(日本佳能公司);DYY-6B稳压稳流电泳仪(北京市六一仪器厂)。DNA纯化试剂盒(Axygen,美国),E.coli DH 5α菌株、rTaq酶(日本Takara公司)。
1.3 传统平板法培养细菌根据目前国标规定的平板计数法,在玻璃平皿内,接种1 mL水样或稀释水样于加热液化的营养琼脂培养基中,冷却凝固后在37 ℃培养24 h,培养基上的菌落数或乘以水样的稀释倍数即为细菌总数。采用革兰氏染色法对菌落染色并镜检。
1.4 PCR-DGGE检测水体细菌的多样性采用十六烷基三甲基溴化铵法提取水体微生物总基因组DNA,用Axygen纯化试剂盒纯化后于-20 ℃冰箱保存。将获得的基因组DNA作为模板进行PCR扩增,引物是对大多数细菌的16S rRNA 基因V3 区具有特异性的F357GC 和R518[9]。PCR反应的体系和条件、电泳后割胶回收、克隆及测序,具体方法均参照文献[5]。
1.5 生物信息学分析利用Quantity One 4.4 (美国BIO-RAD公司)软件将DGGE图谱转化为相应的数字信号,对各样品条带的迁移率、灰度及数量进行定量分析。采用Shannon指数比较各个样品的多样性[6],运用Blastn程序将测定得到的16S rDNA的部分序列与GenBank中核酸数据进行同源比对,并与在GenBank中搜索得到进化相似的16S rDNA进行比对分析,然后在RDPⅡ(ribosomal database project Ⅱ)数据库中对序列进行种属鉴定,利用Paup v.4.0软件构建系统发育树。系统发育分析时排除碱基缺失位点,用邻接法(neighbor-joining analysis)构建系统发育树,距离矩阵按照Kimuras双参数模型进行计算,Bootstrap检验进行1 000次取样。
1.6 统计分析采用SPSS 20.0软件进行方差分析,P < 0.05为差异有统计学意义。
2 结 果 2.1 不同污染源水体的理化性质滨文河附近为生活区,其大部分生活污水经常未经处理直接排入河道,导致水体富营养化,颜色泛绿,藻类富集,水有明显异味;位于萧山老虎洞村的河贯穿村中,其污染源也主要为生活污水,水体较透明,水无异臭味,但见水上常有些生活垃圾等漂浮物;浦沿化工厂和萧山印染厂水2个化工污染源的水体颜色均为黑色,有很浓的异臭味;萧山养牛厂的水体颜色较黑,有较浓的粪臭味;珊瑚沙养牛厂旁的水质较浑浊,有些微臭味;相比之下,虎跑山泉的水质清澈,口尝甘甜,无臭味及肉眼可见物。滨文河的pH最高,达8.04,呈碱性;其次是萧山印染厂为7.98;萧山养牛场为7.69;浦沿化工厂为7.52;珊瑚沙养牛场为7.49;而虎跑山泉的水pH最低,接近中性,为7.25。从污染源看,工业废水的平均pH值最高,其次分别为生活污水和畜牧养殖废水,虎跑最低。
2.2 可培养细菌的差异用传统培养方法,检测到浦沿化工厂污水中细菌总数最高,达821 CFU/mL,萧山养牛场河道为502 CFU/mL,萧山印染厂为136 CFU/mL,珊瑚沙养牛场为52 CFU/mL,老虎洞村河为31 CFU/mL,滨文河为28 CFU/mL,虎跑山泉最低,仅5 CFU/mL。
通过选择性培养基对大肠埃希菌Escherichia、葡萄球菌Staphylococus、沙门菌Salmonella及粪链球菌Streptococci进行培养筛选,结果显示,所有污染源的水体中均培养出了大肠埃希菌和葡萄球菌;生活污水中未检测到沙门菌;化工污水中未检测到粪链球菌;未污染的虎跑山泉这4种菌均未检测到。
2.3 不同污染水源细菌群落多样性差异 2.3.1 细菌Shannon指数(图 1)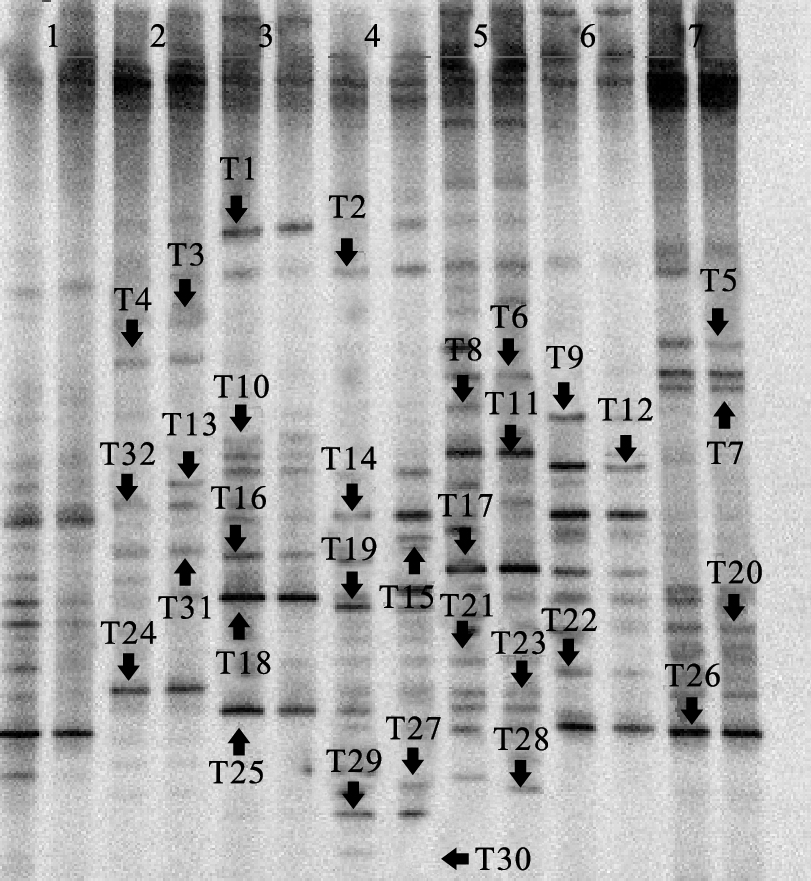 | 注:1:浦沿化工厂化工污水;2:老虎洞村河生活污水;3:珊瑚沙养牛场养殖污水;4:萧山养牛场养殖污水;5:虎跑山泉未污染水;6:滨文河生活污水;7:萧山印染厂化工污水;T1-T30为割胶回收的条带。 图 1 不同污染水源细菌群落多样性DGGE图谱 |
利用PCR-DGGE技术进行水体细菌多样性检测,从图 1中可以看到,同种水体样本的条带基本相同,说明DGGE的重复性较好。不同污染源水体样本之间,其DGGE条带具有明显差异。根据DGGE计算细菌多样性发现,不同污染源水体的Shannon指数存在差异,其中,萧山养牛场污水和珊瑚沙水库的养牛场中多样性指数最高,分别为2.88和2.70;说明畜禽粪便污染的水体更适合细菌的生长;紧接着是萧山印染厂的化工污水(2.57);老虎洞村河道2.54;浦沿化工厂2.42,滨文河2.23,虎跑山泉最低,为2.20。此外,从表面看,滨文河比老虎洞村河的污染更严重,水体更浑浊,但细菌多样性指数却更低,表明污染程度和细菌的多样性不呈正比。
2.3.2 聚类分析(图 2)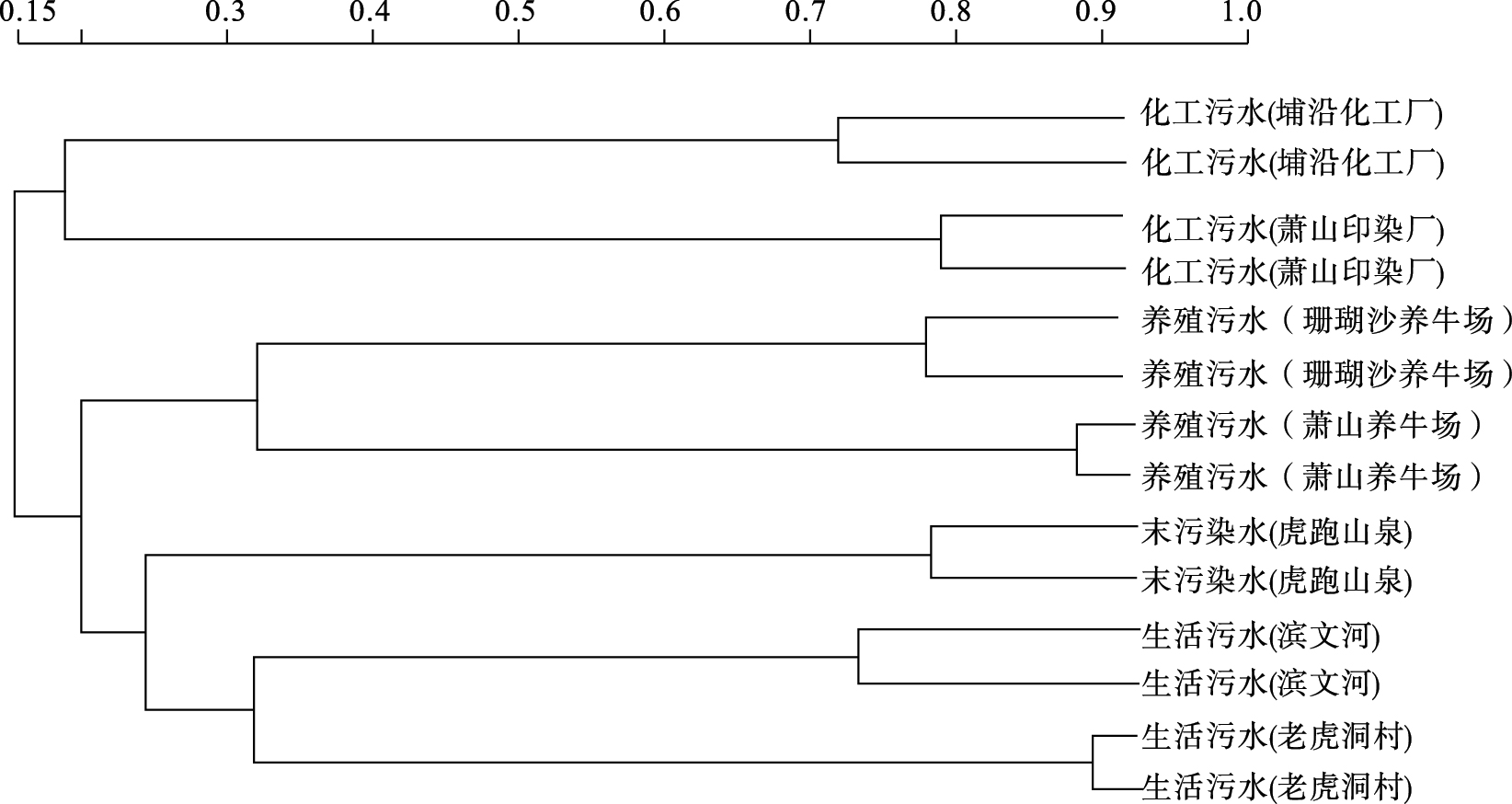 | 注:图中最上面的刻度线代表类间距离。 图 2 不同污染水源细菌多样性聚类分析 |
采用类平均法(UPGMA法)对不同污染源的细菌总数及多样性进行聚类分析,从图 2中可以看出,污染源相同的水体基本聚为一类,其中,化工污染明显不同于其他污染而单独聚为一类。养殖产生的畜禽粪便污水水体中的细菌群落基本相同而聚为第2类。滨文河与老虎洞村河同属于生活污水,聚为第3类,虎跑山泉单独聚类。
2.3.3 细菌群落组成差异(图 3)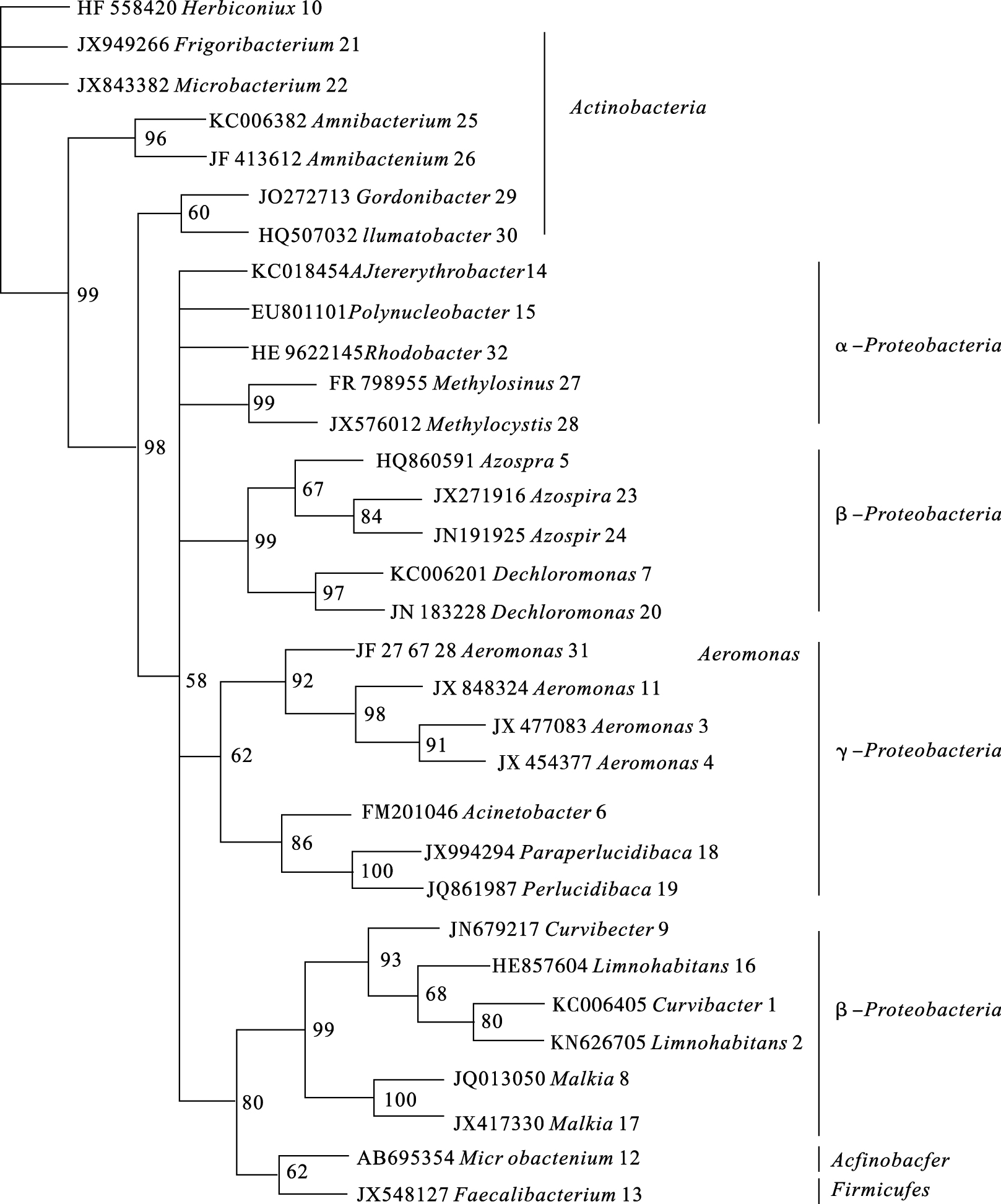 | 图中每种细菌名称后面的阿拉伯数字代表对应的DGGE条带,例如:HF558420 herbiconiux 10,其中HF558420代表该菌的序列号,10代表T10。 图 3 不同污染源水体细菌群落系统发育树分析 |
为了进一步了解污染水体中细菌群落的组成,我们将在DGGE图谱中清晰且明亮的32个条带进行割胶回收,进行分子克隆后进行测序,在NCBI和GenBank数据库中比对结果,如图 3所示,32条带主要隶属于变形菌门Proteobacteria(23条,71.9%)、放线菌门Actinobacteria(8,25%)以及厚壁菌门Firmicutes(1,3%)。条带长度均在165~195 bp,相似度为98%~100%。结合系统发育树发现,变形菌主要包括α-、β-和γ-变形菌,其中有5个克隆为α-变形菌、11个β-变形菌,7个γ-变形菌。研究每种污染源水体中的细菌种类发现,T5(uncultured bacterium clone C-84,HQ860591)和T7(uncultured rhodocyclaceae bacterium clone D7N55,KC006201)为化工污染水中所特有,均隶属于β-变形菌。条带T3(Aeromonas media strain S1_060,JX477083)、T4(uncultured Aeromonas sp.clone PP2-M01,JX454377)为老虎洞村生活污水的特有条带,均为γ-变形菌的气单胞菌属Aeromona。条带T10(Herbiconiux ginsengi isolate 30-RHI-6,HF558420)、T29(uncultured bacterium clone 38LB-10,JQ272713)、T30(uncultured bacterium clone Pohang_WWTP_ 3389,HQ507032)畜牧养殖场污水中所特有的条带,这些条带均隶属于放线菌门,其中T29和T30为放线菌门Gordonibacter属。 3 讨 论
本研究结果表明,不同污水其细菌种类有明显差异,与El-Lathy[7]研究结果相似。此外,同样是化工污染,浦沿化工厂和萧山印染厂的细菌总数差距较大,这说明这2个化工厂的污染物质有差异,从而影响了细菌的生长。同样是养牛厂的畜禽粪便污染,萧山养牛厂的细菌总数是珊瑚沙水库的近10倍,可见萧山养牛厂的污染更严重,究其原因,可能是珊瑚沙水库在附近,提高了养牛场河道水体的自净化能力。相比之下,2个生活污水源细菌总数差异不大。但根据肉眼可见,滨文河由于流动性差导致富营养化、藻类富集致水体绿色有异味,而老虎洞村的河道虽然有生活污水排入,但由于在山脚下,水的流动性提高了水体的自净化能力。
比较传统培养法所测细菌总数和DGGE检测法的细菌多样性指数发现,二者排序不完全相同。浦沿化工厂河道中的可培养细菌总数最高,而Shannon指数偏低。这也从另一方面说明,某个环境中可培养的细菌最多,并不代表其所有的细菌最多。而未污染水虎跑山泉的可培养细菌数和不可培养细菌数均表现为最低,说明水体不管是什么污染源都可能导致细菌的增殖。
曾巾等[8]在分析太湖和玄武湖沉积物中细菌群落的垂直分布时,通过多变量分析手段证明pH和有机物含量是影响细菌群落组成的主要因素。由于污染物的输入导致水体pH比对照高,而pH对水中生物包括水体微生物的生长相当重要。虎跑山泉的水无臭味及肉眼可见物,符合国家生活饮用水标准。pH在7.52~7.69时可培养的细菌数最多,同样为畜牧养殖污水、珊瑚沙养殖厂污水中的细菌数远远小于萧山养牛厂,而萧山印染厂的细菌数也远小于浦沿化工厂,这可能与水体pH相关。许多研究都认为人类各种活动会影响水体pH值,例如养鱼会使有机质降解及水体热分层,造成的底部溶氧量减少,pH 降低;轻工业活动产生的废水,其pH会较高[9]。陈丽华等[10]研究闽江水域发现,可培养细菌数与pH值显著相关(P < 0.01),这与我们实验结果一致。
不同污水中由于人类活动会改变水体环境,造成水体细菌群落分布改变。本研究检测发现污染水中的优势菌群主要为变形菌、放线菌和厚壁菌变形菌门,与吴兰[11]、周丽华[12]的研究结果一致。王猛等(2013)[13]对西安、乌鲁木齐、合肥和无锡等4个城市中污水处理厂的活性污泥中细菌群落多样性进行分析发现,其优势细菌主要为芽孢杆菌和变形菌,可见变形菌是污水和污泥中的绝对优势菌群。有研究发现芽孢杆菌(反硝化细菌)可以有效抑制它的生长,而富含氮磷元素的生活污水恰好为反硝化细菌的生存提供了良好的环境,这可能就是为什么生活污水中没有沙门菌存在。此外,不同的污水中均有特异性细菌,例如,化工污水中有特有的β-变形菌。生活污水特有菌为γ-变形菌的气单胞菌属,研究发现气单胞菌能引起多种水产动物疾病,可通过水产品来危害人类身体健康,特别是嗜水气单胞菌已引起水产界、医学界和兽医学界的高度重视[14]。畜牧养殖场中所特有放线菌门Gordonibacter属,其中Gordonibacter pamelaeae被认为可能会引起菌血症,严重影响人类生命安全[15]。窦娜莎等[16]研究认为,假单胞菌属能利用有机物作为碳源生长,因此富含有机物的工业废水和生活污水中变形菌占有的比例较大。
本研究利用传统培养和DGGE检测发现不同的污染源直接影响水体理化性质及细菌群落分布,不仅找到一些常见共有致病菌,也有特有的细菌。当然,随着环境微生物检测技术的发展,DGGE因其检测的局限性,已逐渐被高通量测序技术所取代。在接下来的工作中,有必要利用高通量测序对污染水体微生物进行更全面的检测。并在此基础上,利用枯草芽孢杆菌、硝化细菌、光合细菌和酵母菌等益生菌以及其他生物除污技术来净化各种污水的水质,为浙江五水共治乃至全国污水处理提供一定的理论支持。
| [1] | Xie F,Zhu T,Zhang F,et al.Using Bacillus amyloliquefaciens for remediation of aquaculture water[J].Springer Plus,2013,2(1):1-5. |
| [2] | 章世莹,闫沛红.一起学校自制饮用水污染事件调查[J].中国公共卫生,2012,28(3):401-402. |
| [3] | 姜彩虹,张美玲,陶琰洁.上海市内不同水质的河道春季浮游细菌群落结构分析[J].微生物学通报,2009,36(4):522-527. |
| [4] | 吴利,余育和,冯伟松.PCR-DGGE技术在环境微型生物群落研究中的应用[J].合肥师范学院学报,2010,28(6):103-108. |
| [5] | Shi JY,Yuan XF,Lin HR,et al.Differences in soil properties and bacterial communities between the rhizosphere and bulk soil and among different production areas of the medicinal plant Fritillaria thunbergii[J].International Journal of Molecular Sciences., 2011,12: 3770-3785. |
| [6] | Luo HF,Qi HY,Zhang HX.Assessment of the bacterial diversity in fenvalerate-treated soil[J].World Journal of Microbiology and Biotechnology,2004,20:509- 515. |
| [7] | El-Lathy MA,El-Taweel GE,El-Sonosy WM,et al.Determination of pathogenic bacteria in wastewater using conventional and PCR techniques[J].Environmental Biotechnology,2009,5(2):73-80. |
| [8] | 曾巾,杨柳燕,肖琳,等.太湖不同湖区无机氮转化潜力[J].生态与农村环境学报,2008,24(1):63-67. |
| [9] | 冯彩艳,闫海鱼,俞摇奔,等.网箱养鱼对水库水体甲基汞的影响[J].生态学杂志,2012,31(6):1438-1446. |
| [10] | 陈丽华,苏德森,吕新,等.闽江水域的细菌数量及其与COD和pH值之间的关系初探[J].福建农业学报,2009,24(5):463-466. |
| [11] | 吴兰,葛刚,龚世杰,等.鄱阳湖水体细菌群落组成及遗传多样性[J].环境科学研究,2009,22(10):1145-1149. |
| [12] | 周丽华,陈士超,邓志瑞,等.太湖沉积物中的可培养细菌:细菌多样性初步分析[J].湖泊科学,2009,21(1):27-35. |
| [13] | 王猛,李如刚,肖毅宏,等.城市生活污水处理厂活性污泥中细菌群落结构组成研究[J].化学与生物工程,2013,30(8):28-31. |
| [14] | Lu H,Zhang G,Dai X,et al.Phytosynthetic bactreia treatment of synthetic soybean wastewaster:direct degradation of macromolecules[J].Bioresource Technology, 2010,101(19):7672-7674. |
| [15] | Woo PCY,Teng JLL,Lam KKM,et al.First report of Gordonibacter pamelaeae bactereia[J].Journal of Clinical Microbiology,2010,48(1):319-322. |
| [16] | 窦娜,王琳.16S rDNA克隆文库法分析Biostyr曝气生物滤池处理城市污水的细菌多样性研究[J].环境科学学报,2011,31(10):2117-2124. |
 2015, Vol. 31
2015, Vol. 31


