高血脂症是一种常见而多发的代谢性疾病,是引起心脑血管动脉粥样硬化的重要危险因素[1],随着人们饮食结构改变,高脂血症患病率正在逐年升高。调查表明高脂血症患病率为49.8%,其中,男性患病率为55.3%,女性患病率为40.0%,整体来看高脂血症的患病率处于较高水平[2]。因此,寻找绿色健康食品原料,开发研制具有调血脂作用的功能食品,对人群高脂血症的预防和改善具有重要意义。美藤果(Plukenetia Volubilis L.)为大戟科多年生木质藤本植物,又名印加果、星油藤、南美油藤。原生长在海拔80~1 700 m的南美洲安第斯山脉地区,在南美洲印加地区土著人中食用了上千年[3, 4]。美藤果成熟后采收,破瓣、脱外壳得黑色种籽,再经脱黑色壳得种仁,通过粉碎、压榨、过滤除杂等工艺制得美藤果油[5]。作为国家新资源食品[6],美藤果油富含93%不饱和脂肪酸,主要为α-亚麻酸和α-亚油酸,分别占脂肪酸总量的47%和36%,高于常见的油料作物[7]。研究表明美藤果油具有调节血脂、预防心脑血管疾病功效[8]。本研究以高脂饲料诱导高脂血症鹌鹑为动物模型,探讨美藤果油的调节血脂作用及对载脂蛋白影响,为美藤果油的开发、利用提供科学依据。 1 材料与方法 1.1 实验动物
健康迪法克种鹌鹑,8周龄,雄性,体重160~200 g,由北京伍德岭鹌鹑养殖场提供。分笼饲养,自由饮食,12 h交替照明,温度23~25 ℃,湿度40%~70%。基础饲料由北京伍德岭鹌鹑养殖场提供,高脂饲料是在基础饲料中拌入 1%胆固醇和16%猪油制成。 1.2 主要试剂与仪器
美藤果油(西双版纳印奇生物资源开发有限公司,批号:20140220),其中亚麻酸和亚油酸含量分别为48.4%和37.6%;紫苏油软胶囊(湖北李时珍药业集团,批号:20140120);总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)试剂盒(北京利德曼生化股份有限公司);载脂蛋白AI(apolipoprotein AI,ApoAI)、载脂蛋白B(apolipoprotein B,ApoB)试剂盒(中生北控生物科技股份有限公司)。Beckman-cx4型全自动生化仪(美国贝克曼库尔特有限公司); 7160全自动生化仪(日本日立公司);TGL-16A台式高速冷冻离心机(长沙平凡仪器仪表有限公司);CM1850冰冻切片机(北京中仪光科科技发展有限公司)。 1.3 模型建立
鹌鹑适应性饲养1周后,按体重随机区组法分为2组,10只鹌鹑给予基础饲料作为对照组,50只给予高脂饲料作为高脂组,连续4周。4周后,鹌鹑禁食不禁水12 h,右侧颈静脉取血0.5 mL,测定血清TC含量。 1.4 分组与处理
高脂组鹌鹑根据空腹TC水平随机分为5组,分别为模型组、紫苏油组及美藤果油高、中、低剂量组。对照组饲喂基础饲料,其余各组饲喂高脂饲料;同时,对照组、模型组灌胃给予玉米油,美藤果油高、中、低剂量组分别灌胃给予1.00、0.50、0.25 g/kg美藤果油,紫苏油组鹌鹑灌胃给予0.50 g/kg紫苏油,灌胃容量5 mL/kg,每天1次,连续4周。各组鹌鹑每周称重,观察一般生长状况,4周后,鹌鹑禁食不禁水12 h,右侧颈静脉取血3 mL,静置,3 500 r/min,离心10 min,分离血清,用于血脂含量检测。处死鹌鹑后,迅速剖取肝脏组织,浸泡于4%的多聚甲醛溶液中固定,备用。 1.5 指标与方法 1.5.1 鹌鹑血清中血脂及载脂蛋白含量检测
按照试剂盒说明书操作。 1.5.2 鹌鹑肝脏病理组织观察
新鲜组织固定于4%多聚甲醛>24 h,依次梯度酒精脱水,将浸好蜡的组织于包埋机内包埋,蜡块置于石蜡切片机上切片,片厚4 μm,60 ℃ 烘箱内烤片。苏木素-伊红染色(hematoxylin-eosin staining,HE),于400倍光学显微镜下观察肝脏病理组织结构,图像采集分析。 1.6 统计分析
定量数据以x±s表示,采用SPSS 20.0软件进行统计分析,检验数据正态性和方差齐性,当数据满足正态分布且组间方差齐时,应用单因素方差分析比较组间差异;否则采用非参数检验(秩和检验)方法,以P<0.05为差异有统计学意义。 2 结 果 2.1 美藤果油对高脂血症鹌鹑一般生长发育影响(表 1)
实验期间,各组鹌鹑生长发育状态良好;与对照组比较,模型组、美藤果油各剂量组、紫苏油组鹌鹑体重均未见明显变化。
| 表 1 美藤果油对高脂血症鹌鹑体重影响(x±s,n>=10) |
与对照组比较,模型组鹌鹑血清TC、TG、LDL-C含量均升高,HDL-C含量降低,差异均有统计学意义(P<0.01);与模型组比较,紫苏油组、美藤果油1.00、0.50 g/kg剂量组鹌鹑血清TC、TG、LDL-C含量均降低,HDL-C含量升高,差异均有统计学意义(P<0.05)。
| 表 2 美藤果油对高脂血症鹌鹑血脂水平影响(mmol/L,x±s,n=10) |
| 表 3 美藤果油对高脂血症鹌鹑血清中载脂蛋白影响(g/L,x±s,n=10) |
对照组鹌鹑肝组织结构完整、清晰,肝小叶结构正常,未见纤维组织增生,汇管区结构完整(图 1A);模型组鹌鹑肝小叶结构消失,汇管区结构模糊,未见纤维结缔组织增生,肝细胞重度脂肪变性,肝细胞内脂肪空泡密集散布于整个胞浆中,将细胞核挤向胞膜下,状似脂肪细胞(图 1B);紫苏油组(图 1C)和美藤果油1.00 g/kg组(图 1D)鹌鹑肝脏切片观察显示,肝小叶结构上保持完整,肝细胞条索清晰,汇管区结构完整,未见纤维组织增生,部分肝细胞发生脂肪变性,肝细胞内可见脂肪空泡,未见大量肝细胞的水样变性及坏死。
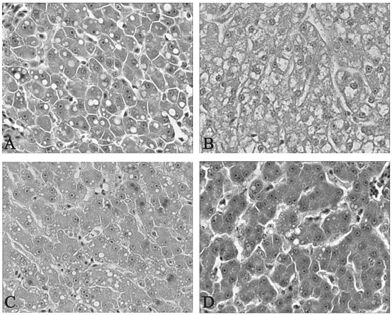 | 注:A:对照组;B:模型组;C:紫苏油组;D:美藤果油1.00 g/kg组。 图 1 美藤果油对高脂血症鹌鹑肝脏病理影响(HE,×400) |
高脂血症常表现为血液中TC、TG、LDL-C浓度升高及HDL-C浓度降低[9]。TC是指血液中所有脂蛋白所含胆固醇之总和,胆固醇是构成细胞膜的主要成分,血中胆固醇含量异常升高导致在血管壁堆积,从而引起心血管疾病。高脂血症是动脉粥样硬化(atherosclerosis,AS)和冠心病(coronary heart disease,CHD)发病的最重要的脂类危险因素,选择理想的高脂血症动物模型是研究脂质代谢紊乱的关键。研究表明鹌鹑对食源性诱发高脂血症极为敏感,喂饲含 1%胆固醇、14%猪油的高脂饲料,2~3 周即可形成高脂血症,8~10 周可形成粥样硬化斑块[10]。
研究表明,饮食脂肪酸对血脂代谢、CHD及AS的发生具有重要作用,尤其是多不饱和脂肪酸(poly-unsaturated fatty acids,PUFAs)对血脂有正向调节作用,有利于降低心血管疾病发生的危险度[11]。PUFAs不仅可降低血浆TC、TG和LDL-C水平,而且可升高HDL-C,降低CHD和AS的发生。本研究采用高脂饲料喂食鹌鹑复制高脂血症模型,结果显示,美藤果油和紫苏油可明显降低鹌鹑血清中TC、TG和LDL-C含量,同时可明显升高血清HDL-C含量,美藤果油中剂量组与紫苏油组效果接近,这可能与其不饱和脂肪酸的含量及每日摄入量有关,美藤果油和紫苏油的不饱和脂肪酸含量接近,均能达到>93%。
肝脏作为合成和贮存TC的器官,当血液中胆固醇升高时易在肝脏内堆积,引起脂肪肝等疾病[12]。肖颖等[13]发现高脂血症患者服用富含不饱和脂肪酸的坚果后血清TC、LDL-C、ApoB明显降低,ApoAI升高。HDL-C能将动脉壁上以及外周组织的胆固醇逆向转运至肝脏中进行代谢排出。ApoAI 是 HDL-C最主要的蛋白成分,约占 HDL-C 总蛋白的 70%,其浓度与HDL-C水平呈正相关,是脂代谢关键酶—卵磷脂胆固醇转移酶(lecithin cholesterol transferase,LCAT)的激活剂,而 LCAT 在胆固醇的逆向转运中起主要作用,提高 ApoAI 水平可激活 LACT,加强胆固醇的逆向转运,从而降低胆固醇水平[14]。LDL-C由肝脏合成并分泌到血液,起到转运肝脏胆固醇至血液及全身组织的作用。ApoB主要存在于 LDL-C中,是 LDL-C 的主要载脂蛋白,参与 LDL-C 受体识别、标记及调节周围胆固醇的代谢,在运输内源性胆固醇的代谢中起主要作用,其携带的胆固醇在动脉壁沉积,导致粥样硬化的发生[15]。本研究结果显示,美藤果油1.00 g/kg组鹌鹑血清中ApoAI含量升高、ApoB含量降低。这可能是美藤果油调节高脂血症鹌鹑血脂代谢的机制之一。
肝脏是内源性血脂和脂蛋白合成及其代谢的主要器官,血脂主要在肝脏合成,包括胆固醇、胆固醇脂、TG、磷脂等。正常肝内脂肪中一半为TG。肝脏不断将进入肝内的脂肪合成TG,然后以脂蛋白(主要是极低密度脂蛋白)胆固醇形式释放入血循环。如果肝内合成及运转平衡失调则会使TG在肝内堆积而形成脂肪肝[16]。本研究结果显示,美藤果油1.00 g/kg组鹌鹑肝脏中脂肪变性、肝细胞脂肪空泡明显减轻。提示美藤果油可以改善肝脏的脂肪代谢,有助于高血脂症的辅助治疗。其具体机制值得进一步探讨。
| [1] | 马儒林,郭淑霞,李妍,等.新疆哈萨克族成人血脂异常及其影响因素[J].中国公共卫生,2012,28(8):1009-1013. |
| [2] | 张敬华,艾然.沈阳地区体检人群高脂血症分析[J].中国公共卫生,2014,30(12):1595-1596. |
| [3] | Cai ZQ.Shade delayed flowering and deceased photosynthesis,growth and yield of Sacha Inich(Plukenetia volubilis)plant[J].Ind Crops Prod,2011,34(1):1235-1237. |
| [4] | Guillén MD,RUIZ A,Cabo N,et al.Characterization of Sacha inchi(Plukenetia volubilis L.)oil by FTIR spectroscopy and 1H-NMR.Comparison with linseed oil[J].J Am Oil Chem Soc,2003,80(8):755-762. |
| [5] | 张思佳,黄璐,熊周权,等.美藤果油研究进展[J].粮食与油脂,2013,26(6):4-6. |
| [6] | 中华人民共和国国家卫生和计划生育委员会.关于批准茶树花等7种新资源食品的公告(卫生部公告2013年第1号)[EB/OL].[2013-01-04].http://www.nhfpc.gov.cn/sps/s7891/201301/50f91734cc56444b8c084f0d0468a690.shtml. |
| [7] | Fanail C,Dugo L,Cacciola F,et al.Chemical characterization of Sacha Inchi(Plukenetia volubilis L.)oil [J].J Agric Food Chem,2011,59(24):13043-13049. |
| [8] | Garmendia F,Pando R,Ronceros G.Effect of Sacha Inchi oil(Plukenetia volúbilis L.)on the lipid profile of patients with hyperlipoproteinemia [J].Rev Peru Med Exp Salud Publica,2011,28(4):628-632. |
| [9] | 胡慧明,陈素红,吕圭源,等.参芍降脂片对高脂血症小鼠血脂水平及肝功能的影响[J].中药药理与临床,2011,27(2):113-114. |
| [10] | 刘雪梅,吴符火.几类高脂血症动物模型的比较[J].中西医结合学报,2004,2(2):132-134. |
| [11] | 李霞,袁凤来,袁丽萍,等.多不饱和脂肪酸调血脂作用研究进展[J].安徽医药,2007,11(10):867-869. |
| [12] | You M,Considine RV,Leone TC,et al.Role of adiponectin in the protective action of dietary saturated fat against alcoholic fatty liver in mice[J].Hepatology,2005,42(3):568-577. |
| [13] | 肖颖,王军波,闫少芳,等.富含单不饱和脂肪酸的坚果对高脂血症患者血脂水平的影响[J].中国公共卫生,2002,18(8):931-932. |
| [14] | Baroukh N,Ostosa MA,Vergnes L,et a1.Expression of human apolipoprotein A-I/C-III/A-IV gene cluster in mice reduces athemgenesis in response to a high fat-high cholesterol diet [J].FEBS Lett,2001,502:16. |
| [15] | 吴符火,刘雪梅,郭素华.养心草胶囊调血脂机制的实验研究[J].中国中西医结合杂志,2006,26(2):131-134. |
| [16] | 赵丽萍,古英.易善复胶囊对脂肪肝大鼠血脂及血流变影响的实验研究[J].内蒙古医学杂志,2007,39(7):804-806. |
 2015, Vol. 31
2015, Vol. 31
