心肌缺血再灌注在临床中较为多见,一般而言,多数患者在心肌缺血再灌注的情况下,组织器官功能可自我调节得到恢复,但有些患者特别是老年患者在发生缺血后再灌注,不仅不能够使组织以及器官相关功能得到恢复,反而有可能会加重心脏特别是心肌的功能障碍以及相应结构的损伤,医学界把这种在缺血基础上发生恢复血流后组织发生的不可逆转的损伤称之为缺血再灌注损伤 [1]。近年来,随着分子生物学技术的发展,利用多项技术与新开发的药物,可以明显抑制心肌缺血再灌注损伤的程度,氢气饱和生理盐水(hydrogen saturated saline,HRS)技术即是其中之一。该技术抑制心肌缺血再灌注损伤发现于本世纪初,但其机理尚不十分清楚[2, 3]。本研究拟观察大鼠给予HRS后调控凋亡相关蛋白Bcl-xL、Bad、Bcl-2、Bax对大鼠心肌缺血再灌注损伤的影响,为心肌缺血再灌注的临床治疗提供理论依据。结果报告如下。 1 材料与方法 1.1 实验动物与分组
雄性SD大鼠36只(新乡医学院提供),许可证号:SCXK(桂)2009-0002,体重为380~450 g。大鼠在缺血再灌注手术前适应性喂养2周后,随机分为假手术组、缺血再灌注损伤组、HRS处理组3组,每组为12只。其中,假手术组分离动脉但不结扎;缺血再灌注损伤组再灌注的同时经腹腔注射生理盐水10 ml/kg大鼠体重;HRS处理组于再灌注同时经腹腔注射HRS 10 ml/kg大鼠体重。大鼠造模时结扎左冠状动脉前降支,再灌注时间为2 h。 1.2 主要试剂
多克隆抗 Bcl-xL、Bad、Bcl-2、Bax(美国Abcam公司);单克隆抗体β-actin(美国Santa Cruz公司);二抗(中山金桥有限生物公司);总RNA提取试剂盒(美国SunShineBio公司)。 1.3 血液动力学检测
采用右颈总动脉导管法行血液动力学检测,电生理记录仪记录左心室舒张压(left ventricular diastolic pressure,LVDP)以及左心室内压最大上升速率(dp/dtmax)。 1.4 病理学观察
动物麻醉后,迅速打开胸腔,取出心脏,剪心脏心尖处一小块立即置于中性福尔马林溶液中,其余取出后立即置于-80 ℃超低温冰箱保存备用。病理学检查时取出组织,酒精脱水,石蜡包埋、切片,切片作苏木精-伊红染色(hematoxylin-eosin staining,HE)后光镜下观察心脏病理学改变。 1.5 聚合酶链反应(polymerase chain reaction,PCR)
采用半定量PCR法测定大鼠心脏组织提取液中Bcl-xL、Bad、Bcl-2、Bax表达水平。具体方法为:直接用试剂盒提供的相应物品提取总RNA,之后根据引物说明书及常规法反转录合成cDNA行PCR反应,产物电泳后凝胶图像采集仪对电泳条带进行扫描,以β-actin作为内参,每组实验重复3次。引物由生工生物(上海)股份有限公司设计,序列如下:Bcl-xL引物上游:5′-CCCAGAAAGGATACAGCTGG-3′,下游:5′-GCGATCCGACTCACCAATAC-3′,产物长度448 bp;Bcl-2引物上游:5′-TGGGCAGA-AGATAGACCGGA-3′,下游:5′-ACAACCTCAGCCCGTCACAG-3′,产物长度362 bp;Bad引物上游:5′-ACCACAAGTCCATGCCATCAC-3′,下游:5′-T-CCCACACCCTTTTTGGGCA-3′,产物长度433 bp;Bax引物上游:5′-CAGAACAGGCTCGAGAGTGT-3′,下游:5′-TCACGGAGGAAGTCCAGTGT-3′,产物长度264 bp;β-actin引物上游:5′-ATGTGGCAC-CACACCTTCTACAATGTGCG-3′,下游:5′-CGT-CATACTCCTGCTTGCTGATCCACTGC-3′,产物长度502 bp。 1.6 蛋白表达
取心肌组织100 mg用匀浆机匀浆后,总蛋白提取试剂盒提取总蛋白,二辛可宁酸(bicinchonininc acid,BCA)定量后每组取样本60 μg蛋白用8%聚丙烯酰胺凝胶电泳,电泳后转膜、脱脂牛奶封闭2 h,一抗4 ℃过夜,于次日取出洗膜3次后,加入二抗,再洗膜3次,暗室曝光后,采集图像,每组实验重复3次。 1.7 统计分析
数据以x±s表示,应用SPSS 18.0软件进行统计分析。组间比较采用方差分析,两两比较采用最小显著差法检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠心功能改变(表 1)
大鼠心脏缺血再灌注损伤2 h后,假手术组、缺血再灌注损伤组和HRS处理组比较,3组LVDP、dp/dtmax和梗死面积差异均有统计学意义(均P<0.05)。其中,假手术组LVDP和dp/dtmax均最高,HRS处理组均次之,缺血再灌注损伤组均最低;假手术组心脏无梗死,缺血再灌注损伤组心肌梗死面积较大,HRS处理组心肌梗死面积较小。
假手术组心脏没有梗死,细胞排列整齐(图 1A);缺血再灌注损伤组有明显的心肌梗死,同时心肌细胞排列明显紊乱(图 1B);HRS处理组梗死面积较缺血再灌注损伤组明显减少,细胞也趋于整齐化(图 1C)。
假手术组、缺血再灌注损伤组和HRS处理组比较,3组Bcl-xL、Bcl-2、Bad、Bax mRNA表达差异均有统计学意义(均P<0.05)。其中,假手术组Bcl-xL、Bcl-2、Bad、Bax mRNA表达均最高,HRS处理组均次之,缺血再灌注损伤组均最低。
假手术组、缺血再灌注损伤组和HRS处理组比较,3组Bcl-xL、Bcl-2、Bad、Bax 蛋白表达差异均有统计学意义(均P<0.05)。其中,假手术组Bcl-xL、Bcl-2、Bad、Bax 蛋白表达均最高,HRS处理组均次之,缺血再灌注损伤组均最低。
心肌缺血在临床中多为心肌缺氧所引起,一般不会造成心脏较大的损害,只是造成单纯的极少部分心肌细胞坏死以及心肌暂时性的功能受损等,但如果灌注时间较长,则会给患者带来极大的危害。这主要是由于血液中的氧合血红蛋白在长时间灌注后,可与心肌中受损或坏死细胞产生的溶解底物发生反应,进而导致心脏中产生过多的氧自由基,最终造成了对心肌的损伤[4]。心肌缺血在临床中较为常见的有3种类型,分别为心肌顿抑、再灌注性心律失常和再灌注心肌坏死,此3种类型均与心肌细胞的凋亡密切相关[5]。
bcl-2家族蛋白是研究最早的一类与凋亡密切相关的蛋白,也是人体中分布最广泛的一类蛋白,此类家族蛋白按其对细胞凋亡的不同作用可分为三大类:第1类为bcl-2、Bcl-xl等具有BH-4保守结构区域的蛋白,对细胞起凋亡起抑制[6];第2类为Bax、Bad、Bcl-xs等具有BH1-3结构区域的蛋白,对细胞凋亡起促进作用[7];第3类为Bid、Bik等具有BH3结构区域的蛋白,对细胞凋亡起促进作用[8]。bcl-2基因位于18q21,翻译后可形成26 kd的bcl-2α和21 kd的bcl-2β 2种蛋白,而发挥作用的为bcl-2α蛋白,Bax基因定位于染色体19q13,其分泌后可以与bcl-2通过形成同源或异源二聚体来调节细胞凋亡。一般而言,当Bax形成同源二聚体时诱导细胞凋亡,形成异源二聚体时则抑制细胞凋亡,Bcl-xl与bcl-2是同源蛋白,但Bcl-xl抑制细胞凋亡具有独立的作用,而Bcx以及Bad则相反能诱导细胞凋亡,另caspase-3也与Blc-2互为抑制,他们在细胞凋亡中起着不可替代的作用[9, 10]。
关于凋亡与抗凋亡因子的研究,在癌细胞中研究较多[11],此外在骨质增生[12]、表皮破损后的修复[13]以及脏器受到损伤后的修复[14]中均有大量报道,同时其在心肌缺血中的研究国内外也有较多报道[15, 16],但关于HRS是否可以抑制本病中相关凋亡蛋白的研究目前报道较少。本研究采用经典的结扎大鼠左冠状动脉前降支的方法建立急性心肌缺血再灌注损伤模型,造模时随机分为假手术组、缺血再灌注损伤组以及HRS处理组。关于HRS剂量的选择,本研究未进行剂量梯度设计,剂量的给予根据国外文献[3, 6]中提到的剂量和时间给予最佳剂量(10 mL/kg)和再灌注时间(2 h)。研究结果显示,HRS处理组心肌梗死面积居于假手术组和缺血再灌注损伤组之间,提示HRS可以降低心肌缺血后再灌注损伤。3组Bcl-xL、Bcl-2、Bad、Bax mRNA和蛋白表达比较,假手术组Bcl-xL、Bcl-2、Bad、Bax mRNA和蛋白表达均最高,HRS处理组均次之,缺血再灌注损伤组均最低。提示HRS可通过调控Bcl-xL、Bad、Bcl-2、Bax凋亡相关蛋白的表达较为有效地减轻大鼠心肌缺血再损伤,进而保护心肌细胞。
![]()
表 1 大鼠造模后心脏常规指标比较
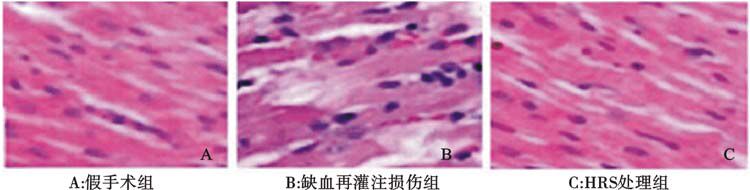
图 1 心肌缺血再灌注损伤各组大鼠心脏组织病理学变化(HE染色,×200)
![]()
表 2 不同组别大鼠心脏提取液中Bcl-xL、Bcl-2、Bad、Bax mRNA表达比较
![]()
表 3 不同组别大鼠心脏提取液中Bcl-xL、Bcl-2、Bad、Bax蛋白表达比较
| [1] | Dianat M,Hamzavi GR,Badavi M,et al.Effects of losartan and vanillic acid co-administration on ischemia-reperfusion-induced oxidative stress in isolated rat heart[J].Iran Red Crescent Med J,2014,16(7):e16664. |
| [2] | Montero MF,Saurim R,Bonservizi WG,et al.Heart injury following intestinal ischemia reperfusion in rats is attenuated by association of ischemic preconditioning and adenosine[J].Acta Cir Bras,2014,29(Suppl2):67-71. |
| [3] | Wang G,Jiang L,Song J,et al.Mipu1 protects H9c2 myogenic cells from hydrogen peroxide-induced apoptosis through inhibition of the expression of the death receptor Fas[J].Int J Mol Sci,2014,15(10):18206-18220. |
| [4] | Yang M,Chen J,Zhao J,et al.Etanercept attenuates myocardial ischemia/reperfusion injury by decreasing inflammation and oxidative stress[J].PLoS One,2014,9(9):e108024. |
| [5] | 薛富善,孙海燕,李平,等.细胞凋亡与心肌缺血再灌注损伤[J].中国医药导刊,2007,9(4):335-339. |
| [6] | Glory A,Bettaieb A,Averill-Bates DA,et al.Mild thermotolerance induced at 40 ℃ protects cells against hyperthermia-induced pro-apoptotic changes in Bcl-2 family proteins[J].Int J Hyperthermia,2014,30(7):502-512. |
| [7] | Sarkar R,Mukherjee A,Mukherjee S,et al.Curcumin augments the efficacy of antitumor drugs used in leukemia by modulation of heat shock proteins via HDAC6[J].J Environ Pathol Toxicol Oncol,2014,33(3):247-263. |
| [8] | Gérecová G,Kopanicová J,Jaká P,et al.BH3-only proteins Noxa,Bik,Bmf,and Bid activate Bax and Bak indirectly when studied in yeast model[J].FEMS Yeast Res,2013,13(8):747-754. |
| [9] | Anilkumar U,Prehn JH.Anti-apoptotic BCL-2 family proteins in acute neural injury[J].Front Cell Neurosci,2014,8:281. |
| [10] | Park SH,Ham S,Kwon TH,et al.Luteolin induces cell cycle arrest and apoptosis through extrinsic and intrinsic signaling pathways in mcf-7 breast cancer cells[J].J Environ Pathol Toxicol Oncol,2014,33(3):219-231. |
| [11] | Song X,Kim SY,Zhang L,et al.Role of AMP-activated protein kinase in cross-talk between apoptosis and autophagy in human colon cancer[J].Cell Death Dis,2014,5:e1504. |
| [12] | Cardelli M,Zirngibl RA,Boetto JF,et al.Cartilage-specific overexpression of ERRγ results in chondrodysplasia and reduced chondrocyte proliferation[J].PLoS One,2013,8(12):e81511. |
| [13] | Shin S,Kum H,Ryu D,et al.Protective effects of a new phloretin derivative against UVB-induced damage in skin cell model and human volunteers[J].Int J Mol Sci,2014,15(10):18919-18940. |
| [14] | Dang VT,Tanabe K,Tanaka Y,et al.asting enhances TRAIL-mediated liver natural killer cell activity via HSP70 upregulation[J].PLoS One,2014,9(10):e110748. |
| [15] | Chen L,Phillips MI,Miao HL,et al.Infrared fluorescent protein 1.4 genetic labeling tracks engrafted cardiac progenitor cells in mouse ischemic hearts[J].PLoS One,2014,9(10):e107841. |
| [16] | Al-Amran FG1,Manson MZ,Hanley TK,et al.Blockade of the monocyte chemoattractant protein-1 receptor pathway ameliorates myocardial injury in animal models of ischemia and reperfusion[J].Pharmacology,2014,93(5-6):296-302. |
 2015, Vol. 31
2015, Vol. 31
