地方性氟中毒(endemic fluorosis)是由于一定地区的环境中氟含量过多,而致生活在该环境中的居民经饮水、食物和空气等途径长期摄入过量氟所引起的以氟骨症和氟斑牙为主要特征的慢性全身性疾病,又称为地方性氟病。慢性氟中毒对机体骨骼、牙齿的骨相损害已得到确认。肝脏作为人体重要的解毒器官和能量代谢场所,是慢性氟中毒时受损最严重的器官之一,研究表明,高氟可引起肝脏组织结构异常、功能和代谢变化,在低剂量氟中毒时,肝细胞发生退行性变、增生并伴有间质纤维化[1, 2]。缺口(Notch)信号通路在调节细胞分化、增殖、凋亡等一系列生理、病理过程中起重要作用。Notch信号通路在肝脏发育和肝脏疾病的发生、发展中具有调控作用。本研究通过观察过量氟所致大鼠肝脏Notch、Hes1信号通路变化,旨在探讨慢性氟中毒对大鼠肝脏损害机制,结果报告如下。 1 材料与方法 1.1 主要试剂与仪器
氟化钠(NaF)分析纯(天津市致远化学试剂有限公司)、二氨基联苯胺显色试剂盒(广州森达生物有限公司)、磷酸盐缓冲液(phosphate-buffered saline,PBS)、柠檬酸盐(北京中杉金桥生物技术有限公司)、兔抗鼠Notch1、Hes1多克隆抗体(美国GeneTex公司)、山羊抗兔IgG 抗体(H+L)、G 蛋白耦联物、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)(美国Bio-Rad公司)、氧化应激试剂盒(南京建成有限公司)。OLYMPUS CH20显微镜(德国 Leica公司),BIOMIAS-2001高清晰度图像分析系统(四川大学图像图形研究所),ELX800UV 酶标仪(美国Bio-Rad公司)。 1.2 动物分组及处理
选用4~5周龄,体重80~100 g健康Sprague-Dawley(SD)大鼠36只(第三军医大学大坪医院医学实验动物中心),许可证号:SCXK(渝)2007-0005。按体重将大鼠随机分为3组,每组12只,雌雄各半。对照组:饮用自来水(含氟量<1 mg/L);低、高氟组:分别自由饮用含氟5、50 mg/L自来水;各组大鼠饲养在屏障环境中,饲以常规饲料(贵阳医学院实验动物中心提供,含氟量<1 mg/kg),自由采食、饮水,连续6个月。收集24 h尿液测尿氟含量;股动脉放血处死大鼠,离心管收集血液,3 000 r/min离心10 min,取血清 -80 ℃冰箱保存;取部分肝组织4%中性甲醛固定,余肝组织-80 ℃冰箱保存待测;取股骨测定骨氟。 1.3 方法与指标 1.3.1 大鼠氟斑牙观察
染氟结束时,观察大鼠氟斑牙发生情况;Dean氟斑牙分度标准[3]:0度:牙釉质半透明,表面光滑有光泽;Ⅰ度:牙齿表面黄、白相间,白垩条纹清晰;Ⅱ度:牙齿表面无光泽,粉笔样白色斑;Ⅲ度:牙齿表面出现小沟、裂纹、或部分脱落,牙齿呈锯齿状严重缺损。 1.3.2 尿、骨氟含量测定
尿氟含量采用氟离子选择电极法测定;将股骨软组织剥离灰化、炭化后用氟离子选择电极法测定骨氟含量。 1.3.3 大鼠肝脏病理形态学观察
采用苏木素-伊红(hematoxylin-eosin staining,HE)染色法,取适量4%中性甲醛浸泡的肝组织做石蜡切片,脱蜡至水洗后苏木精染色2 min,1%盐酸酒精分化20 s,1%碳酸锂反蓝30 s,伊红染色30 s,梯度酒精脱水,透明、封片;光镜下观察肝脏组织的病理形态学改变。 1.3.4 大鼠肝脏Notch1、Hes1与Bcl-2、Bax蛋白表达
(1)免疫组化法:石蜡切片,60 ℃烤片2 h,常规脱蜡,高压修复5 min,自然冷却,PBS洗3次,每次3 min,3%H2O2孵育20 min,PBS洗3次,封闭液孵育30 min,滴加1:100一抗(Notch1、Hes1、Bcl-2、Bax多克隆抗体)4 ℃过夜,依次加二抗及辣根过氧化物酶分别孵育25 min,显色,流水终止反应;苏木素复染,脱水、透明、封片。每组切片均设立空白对照,用PBS代替一抗作为阴性对照;用BIOMIAS-2001分析软件进行图像分析,每组12张,每张切片在400倍光镜下取5个视野,每个视野取5个阳性区域计算出Notch1、Hes1、Bcl-2、Bax基因阳性产物积分光密度(IOD)平均值,IOD值高低与阳性表达强弱成正比。(2)蛋白印迹法:调整样品的蛋白量进行SDS-PAGE,将电泳分离的蛋白转移到聚偏氟乙烯膜上,TBST缓冲液(Tris buffered saline with Tween-20)洗膜5 min,室温下用5%脱脂奶粉(TBST溶解)封闭聚偏氟乙烯膜l h,加抗Notch1、Hes1(1:500)、Bcl-2、Bax(1:100)4 ℃孵育过夜,TBST洗脱3次,加入相应的Ⅱ抗IgG(1:2000),室温孵育l h,,漂洗3次。将聚偏氟乙烯膜用发光试剂显色,图片经图像分析仪分析,以平均光密度值表示所测蛋白的相对表达量。 1.3.5 肝细胞凋亡指数测定
采用原位末端转移酶标记法,实验步骤参照试剂盒说明书进行,细胞核呈棕黄色表示细胞凋亡阳性,每张切片选择5个高倍视野,计算阳性细胞数所占细胞数总的百分比即为凋亡指数(apoptosis index,AI)。 1.3.6 肝组织氧化应激指标测定
超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、 脂质过氧化物(lipid peroxidation,LPO)测定具体操作按试剂盒说明书进行。 1.3.7 血清肝功能检测
取-80 ℃保存备用血清各1 mL,采用自动生化仪检测各组大鼠血清中谷草转氨酶(aspartate transaminase,AST)、谷丙转氨酶(alanine transaminase,ALT)活性和总蛋白(total protein,TP)含量。 1.4 统计分析
应用SPSS 19.0软件进行统计分析,计量资料以(x±s)表示,多样本均数比较采用单因素方差分析,两两比较采用最小显著差法,方差分析前对数据进行正态性检验和方差齐性检验,2个变量间的相关性采用Pearson相关分析,P<0.05表示差异有统计学意义。 2 结 果 2.1 大鼠一般状况与氟斑牙发生情况
实验期间,对照组大鼠皮毛光滑,食欲良好,活跃,牙齿无明显病变,低、高氟组大鼠被毛失去光泽,活动度差;随着染氟时间延长,表现出精神萎靡,食欲减弱症状;染氟1个月左右,染氟组大鼠开始出现牙齿改变,6个月低氟组大鼠氟斑牙检出率为60%(5/12),高氟组大鼠氟斑牙检出率为80%(7/12)。 2.2 染氟对大鼠尿氟、骨氟含量影响
对照组、低、高氟组大鼠尿氟、骨氟含量分别为(1.74±0.11)、(1.89±0.12)、(2.19±0.17)mg/L与(1.65±0.10)、(2.10±0.16)、(2.21±0.10)mg/kg;与对照组比较,染氟组大鼠尿氟、骨氟含量明显升高,差异有统计学意义(P<0.05)。 2.3 染氟对大鼠肝脏组织病理形态学影响
光镜下观察显示,对照组大鼠肝脏细胞大小一致,细胞排列呈条索状,以中央静脉为中心呈放射状,小叶及汇管区无炎性细胞浸润;低氟组大鼠肝细胞肿大,呈轻度气球样变,少数肝细胞脂肪变性;高氟组大鼠肝脏可见肝索紊乱,肝细胞肿大明显,少数肝细胞轮廓不清,肝细胞膜消失或见核固缩。 2.5 染氟对大鼠肝脏细胞凋亡指数影响
对照组、低、高氟组大鼠肝脏细胞凋亡指数分别为7.5%、29.5%、37.5%;与对照组比较,染低氟组大鼠肝细胞凋亡指数明显升高,差异有统计学意义(P<0.05)。 2.6 染氟对大鼠肝功能指标影响(表 1)
与对照组比较,染氟组大鼠肝脏ALT和AST活性升高,而TP含量降低。提示,染氟组大鼠肝脏功能明显下降。
| 表 1 氟对大鼠肝功能影响(±xs,n=12) |
免疫组织化学结果显示,Notch-1、Hes1及Bcl-2、Bax在各组肝组织中均有表达,定位于细胞浆中,Hes1在少数胞核中亦有表达,呈淡黄色到棕褐色深浅不一的颗粒状,散在或团簇状分布;对照组大鼠肝组织中Bcl-2、Bax少量表达,仅在血管和胆管周围有少量Notch-1和Hes1蛋白表达;氟中毒大鼠肝组织中Notch1、Hes1及Bcl-2、Bax的阳性颗粒主要集中在汇管区周围肝细胞胞浆中,略呈棕黄色细颗粒状,血管和胆管周围Notch-1、Hes1阳性表达明显增加。蛋白印迹结果显示,与对照组比较,染氟组大鼠肝脏Notch1、Hes1及Bax蛋白表达量明显升高,Bcl-2蛋白表达量明显下降,呈一定剂量效应关系。
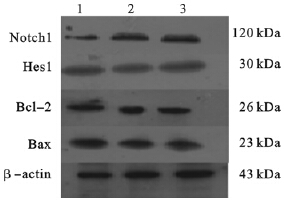 | 注:1:对照组;2:低氟组;3:高氟组。 图 1 染氟对大鼠肝组织中Notch1、Hes1、Bcl-2、Bax蛋白表达影响 |
| 表 2 大鼠肝脏中Notch1、Hes1、Bcl-2、Bax蛋白表达变化(x±s,n=12) |
与对照组比较,高氟组大鼠血清中LPO含量升高,GSH-Px活性明显降低,差异有统计学意义(P<0.05),低、高氟组大鼠血清中SOD活性明显降低,差异有统计学意义(P<0.05)。表明染氟组大鼠体内氧化-抗氧化系统平衡被改变。
| 表 3 染氟对大鼠血清中SOD、GSH-Px活性及LPO含量影响(x±s,n=12) |
本研究采用含氟量5、50 mg/L自来水喂养大鼠6个月后,染氟组大鼠均出现不同程度氟斑牙,尿氟、骨氟含量均明显高于对照组,肝脏出现病理形态学改变,表明氟中毒大鼠模型复制成功。本研究结果显示,氟能诱导大鼠肝脏细胞凋亡,随着染氟剂量增加,ALT、AST呈现增高趋势,而TP含量则下降,提示氟对大鼠肝脏功能具有一定影响;染氟组大鼠肝脏LPO含量升高,同时SOD、GSH-Px活性下降,提示氟作为一种细胞毒性物质,具有较强的诱导脂质过氧化作用,氧化应激可能是造成肝损伤的主要机制之一[4]。
研究表明自由基或其脂质过氧化产物易穿透核膜而直接损伤DNA,使调控基因遭到破坏,干扰细胞生长和死亡的平衡,导致细胞发生凋亡[5]。细胞在氧化应激状态下.脂质过氧化作用得到加强,产生大量自由基可使细胞凋亡进一步加重[6]。Bcl-2蛋白为细胞凋亡过程中的一种重要的抑制蛋白,Bax是Bcl-2家族中研究最广泛的促凋亡蛋白,Bcl-2过表达能够抑制多种因素诱导的多种细胞凋亡[7]。本研究结果显示,与对照组比较,染氟组大鼠肝脏Bcl-2表达降低而Bax表达升高,可能与肝细胞内发生氧化应激有关。
细胞出现凋亡时会引起Notch受体及下游成分失调的现象。在Notch信号通路激活时,Notch细胞内片段(NICD)能转移进入胞核细胞内效应分子[8]:一方面诱导下游靶基因如Hes和Hes相关蛋白基因家族(HERP)的表达[9]来发挥作用,另一方面Hes又可反过来调节Notch下游区的基因转录调控诸多与细胞增殖、凋亡等相关基因的表达,影响细胞生长和细胞分化等过程,发挥生物学效应[10, 11]。Notch信号通路在肝脏的发育过程中具有重要作用,特别是肝母细胞的分化及成熟肝脏损伤后肝细胞的再生过程,均有Notch信号通路的参与[12]。本研究结果表明,大鼠肝脏中Notch1 和Hes1表达随染氟剂量增加而上升。提示在低氟时,Notch信号通路表达水平相对较低,对肝细胞凋亡影响较小,其表达上调主要可能是组织损伤后的再生和修复信号;在高氟时,Notch信号通路表达明显上调,表明Notch信号分子的上调可能抑制细胞凋亡。杨阳等[13]研究表明Notch信号特异性阻断剂γ-分泌酶抑制剂(DAPF)对内皮细胞抗过氧化氢损伤有保护作用;Ding等[14]发现Notch信号的激活介导了细胞的凋亡过程,表明Notch信号通路在肾近端小管细胞中的抗氧化中起一定作用。本研究结果表明Notch信号通路中Notch1和Hes1表达量随染氟浓度升高而增加,提示,Notch信号通路可能成为氟中毒所致肝脏损伤的潜在治疗靶点。但过量氟如何影响Notch信号通路进而造成肝损伤具体机制有待进一步的深入研究。
| [1] | Iwona IS.Impact of fluoxetine on liver damage in rats[J].Pharmaeol Rep, 2011, 63(2):441-447. |
| [2] | Ekambaram P, Namitha T, Bhuvaneswari S, et a1.Therapeutic efficacy of Tamarindus indica to protect against fluoride-induced oxidative stress in the liver of female rats[J].Fluoride, 2010, 43(2):134-140. |
| [3] | 王连方.氟斑牙的几种“Dean氏分类法”浅析[J].地方病通报, 2007, 22(1):71-73. |
| [4] | 郭晓英, 孙贵范, 孙宪民, 等.氧化应激在亚慢性氟中毒大鼠肝脏损伤中的作用[J].中国公共卫生, 2003, 19(5):575-577. |
| [5] | 王爱国, 冉鹏, 周明辉, 等.氟中毒氧化应激与细胞凋亡关系的研究[J].中国公共卫生, 2002, 18(6):681-682. |
| [6] | Wang AG, Xia T, Chu QL, et a1.Effects of fluoride on lipidperoxidation, DNA damage and apoptosis in human embryohepatocytes[J].Biomed Environ Sci, 2004, 17(2):217-222. |
| [7] | Park HJ, Jeon YK, You DH, et al.Daidzein causes cytochromecmediated apoptosis via the Bcl-2 family in human hepatic cancer cells[J].Food Chem Toxicol, 2013, 8(22):542-549. |
| [8] | Zhu FX, Li T, Qiu FH, et al.Preventive effect of Notch sianaling inhibition by a γ-secretase inhibitor on peritioneal dialysis fluid-induced peritoneal fibrosis in rat[J].The American Journal Pathology, 2010, 176(2):650-659. |
| [9] | Kopan R, Llagan MX.The canonical notch signaling pathway:unfolding the activation mechanism[J].Cell, 2009, 137:216-233. |
| [10] | Purow BW, Haque RM, Noel MW, et al.Expression of Notch-1 and its ligands, Delta like-l and Jagged-1 is critical g1ioma cell survival and proliferation[J].Cancer Res, 2005, 65(6):2353-2363. |
| [11] | Schreck KC, Taylor P, Marchionni L, et a1.The Notch target Hes 1 directly modulates Gli1 expression and Hedgehog signaling:a potential mechanism of therapeutic resi stance[J].Clin Cancer Res, 2010, 16(24):6060-6070. |
| [12] | Ikawa T, Kawamoto H, Goldrath AW, et al.E-proteins and Notch signaling cooperate to promote T cell lineage specification and commitment[J].Exp Med, 2006, 203(5):1329-1342. |
| [13] | 杨阳, 梁振兴, 王宁, 等.γ-分泌酶抑制剂对血管内皮细胞抗过氧化氢损伤的保护作用及其机制[J].中华外科实验杂志, 2013, 30(5):887-889. |
| [14] | Ding X, Zhu F, Li T, et a1.Numb protects renal proximal tubular cells from puromycin aminonucleoside-induced apoptosis through inhibiting Notch signaling pathway[J].Int J Biol Sci, 2011, 7(3):269-278. |
 2015, Vol. 31
2015, Vol. 31


