人参为中国传统补气类中药之一,因其成分复杂药用功效也很多。人参皂苷Rg1为人参三醇类皂苷,主要存在于人参和三七中,含量少活性高,具有抗炎抗氧化,抑制心肌肥厚等广泛的药理作用[1,2]。研究发现人参皂苷Rg1具有抗肝纤维化作用[3],可以通过核因子-κB(nuclear factor-kappa B,NF-κB)通路抑制伴刀豆球蛋白-A引起的转氨酶升高,炎症因子分泌增加,降低淋巴细胞侵润[4],对过度运动引起的肝氧化应激损伤也具有一定的保护作用[5]。而对糖尿病引起的肝损伤目前研究较少。2型糖尿病为胰岛素抵抗和胰岛β细胞损伤为特征的代谢性疾病,在糖尿病的慢性并发症中,肝脏为长期血糖过高累及的靶器官之一。因此,本研究采用高脂饮食和链脲佐菌素相结合的方法复制大鼠2型糖尿病模型,观察人参皂苷Rg1对糖尿病肝损伤的影响,结果报告如下。
1 材料与方法 1.1 实验动物SD大鼠50只,雌雄不限,体重200~220 g,由辽宁医学院实验动物中心提供,动物生产许可证号:SCKK(辽)2009-0004。
1.2 主要试剂人参皂苷Rg1(宝鸡市辰光生物科技有限公司),链脲佐菌素(streptozotocin,STZ)(美国Sigma公司);谷丙转氨酶(alanine transaminase,ALT)、谷草转氨酶(asparate aminotransferase,AST)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、肿瘤坏死因子(tumor necrosis factor-α,TNF-α)和白细胞介素-6(interleukin-6,IL-6)试剂盒(南京建成生物工程研究所)。
1.3 分组与处理模型建立:50只大鼠适应性喂养1周后,随机选择10只作为对照组,喂普通饲料(12%脂肪、60%碳水化合物和28%蛋白质),另40只大鼠喂高脂高糖饲料(40%脂肪、42%碳水化合物和18%蛋白),8周后禁食12 h,大鼠尾静脉注射30 mg/kg STZ生理盐水溶液,对照组注射同体积生理盐水。1周后禁食过夜(12 h),尾静脉取血,空腹血糖≥7.8 mmol/L,随机血糖≥11.1 mmol/L即为2型糖尿病建模成功。40只造模成功大鼠随机分为模型组,人参皂苷Rg1(2、4、8 mg/kg)组,于成模后1周灌胃给予人参皂苷Rg1,连续8周,对照组和模型组给予等体积生理盐水。
1.4 指标与方法1.4.1 血糖测定
灌胃结束后,大鼠尾静脉取血,用血糖仪测定大鼠空腹血糖。
1.4.2 肝功能指标测定灌胃结束后,大鼠麻醉,仰卧位固定,心脏穿刺取血,分离血清,按试剂盒说明操作测定血清AST、ALT含量。
1.4.3 肝组织病理观察取肝脏组织迅速固定于4%多聚甲醛溶液中,石蜡包埋;石蜡横断面连续切片5~6 片,厚度约5 μm,切片常规脱蜡脱水,苏木精-伊红(hematoxylin-eosin,HE)染色,普通光学显微镜观察肝脏组织病理改变。
1.4.4 大鼠血清生化指标测定按试剂说明书操作,测定各组大鼠血清中TNF-α、IL-6、SOD、丙二醛含量。
1. 5 统计分析实验数据均以x±s表示,采用SPSS 13.0统计软件进行单因素方差分析及最小显著差法进行组间两两比较,P<0.05为差异有统计学意义。
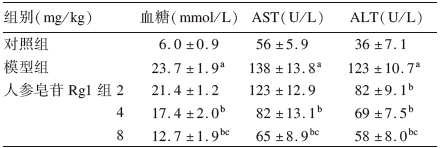
2 结 果 2.1 人参皂苷对2型糖尿病大鼠血糖、肝功影响(表 1)与对照组比较,模型组大鼠血糖水平、AST 和ALT活性均升高,提示建模成功,且模型大鼠肝功能已出现损害;与模型组比较,4、8 mg/kg人参皂苷Rg1组大鼠血糖及血清中AST、ALT活性均下降(P<0.01)。
| 表 1人参皂苷对糖尿病大鼠血糖及肝功影响(x±s,n=10) |
对照组大鼠肝组织结构清晰,胞浆深染,汇管区无炎性细胞浸润(图 1A);糖尿病模型组大鼠肝小叶内细胞索结构紊乱,肝细胞肿胀,体积增大,局部有炎症细胞浸润(图 1B);人参皂苷Rg1(8 mg/kg)组与模型组相比,肝组织结构清晰,脂肪组织减少,浸润的炎细胞减少(图 1C)。
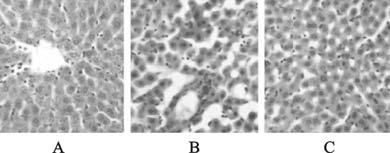 | A:对照组;B:模型组;C:8 mg/kg人参皂苷Rg1组。 图 1 人参皂苷Rg1对糖尿病大鼠肝组织病理形态学影响(HE,×200) |
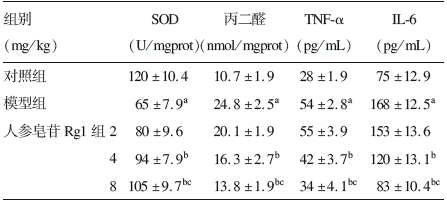
与对照组比较,2型糖尿病大鼠丙二醛、TNF-α、IL-6含量均增加,而SOD活力降低(均P<0.01);与模型组比较,4、8 mg/kg人参皂苷Rg1组大鼠丙二醛、TNF-α、IL-6含量均下降、SOD活力升高(均P<0.01)。
| 表 2人参皂苷对糖尿病大鼠血清生化因子影响(x±s,n=10) |
糖尿病性肝损伤,作为非酒精性脂肪肝的一种,已经引起越来越多学者的关注,约有20%的患者可能发展为肝硬化或肝癌。糖尿病性肝损害病理主要表现为肝内脂肪组织浸润、脂肪性肝炎、肝纤维化,后期常发展为肝硬化。本研究采用高脂饮食和STZ相结合的方法诱导大鼠2型糖尿病模型,HE染色显示部分肝组织细胞索结构紊乱、肝细胞肿胀、体积增大、局部有炎症细胞浸润,提示有肝损伤发生,血清中AST、ALT活性增加,表明肝功能受损;结果表明人参皂苷Rg1组大鼠血清中AST、ALT活性降低、肝组织形态学改变减轻。提示人参皂苷Rg1对糖尿病性肝损伤具有一定的改善作用。
糖尿病的发病机制复杂,大量研究显示氧化应激和炎症反应为糖尿病及其并发症的主要原因[6 ,7]。代谢紊乱时高糖可诱导氧化应激反应发生,活性氧簇(reactive oxygen species,ROS)大量生成。ROS包括大量的超氧阴离子、羟自由基等加重胰岛β-细胞凋亡损伤,还可以激活c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)、NF-κB通路加重胰岛素抵抗[8,9]。在这一过程大量增加的TNF-α和IL-6可通过JNK、NF-κB通路使胰岛素受体底物(IRS)丝氨酸磷酸化,破坏胰岛素信号通路,加重胰岛素抵抗[10]。因此,抑制氧化应激、抑制炎症反应对糖尿病的治疗至关重要。人参皂苷Rg1具有抗炎抗氧化的药理作用,本研究结果显示,人参皂苷Rg1在改善肝功能的同时对2型糖尿病引起的大鼠血清中SOD活力降低、丙二醛含量增加以及血清中炎症因子TNF-α和IL-6升高具有一定的拮抗作用。提示人参皂苷Rg1对糖尿病肝损伤的保护作用机制可能与其抗炎抗氧化作用有关。
| [1] | He Q,Sun J,Wang Q,et al.Neuroprotective effects of ginsenoside Rg1 against oxygen-glucose deprivation in cultured hippocampal neurons[J].J Chin Med Assoc,2014,77(3):142-149. |
| [2] | 王琰,张佩,梁灵君,等.人参皂苷对肿瘤坏死因子-α致心肌肥大抑制作用[J].中国公共卫生,2014,30(1):77-79. |
| [3] | 董向前,段丽平,梁兵,等.人参皂苷 Rg1 和 Rb1 抗肝纤维化的体视学研究[J].山东大学学报, 2012,50(1):85-88. |
| [4] | Cao L,Zou Y,Zhu J,et al.Ginsenoside Rg1 attenuates concanavalin A-induced hepatitis in mice through inhibition of cytokine secretion and lymphocyte infiltration[J].Mol Cell Biochem,2013,380(1-2):203-210. |
| [5] | Korivi M,Hou CW,Huang CY,et al.Ginsenoside-Rg1 protects the liver against exhaustive exercise-induced oxidative stress in rats[J].Evid Based Complement Alternat Med,2012:932165. |
| [6] | Evans JL,Maddux BA,Goldfine ID.The molecular basis for oxidative stress-induced insulin resistance[J].Antioxidants and Redox Signaling,2005,7(7-8):1040-1052. |
| [7] | Donath MY,Shoelson SE.Type 2 diabetes as an inflammatory disease[J].Nature Reviews Immunology,2011,11(2):98-107. |
| [8] | Evans JL,Goldfine ID,Maddux BA,et al.Are oxidative stress-activated signaling pathways mediators of insulin resistance and β-cell dysfunction?[J].Diabetes,2003,52(1):1-8. |
| [9] | Scivittaro V,Ganz MB,Weiss MF.AGEs induce oxidative stress and activate protein kinase C-β(II)in neonatal mesangial cells[J].American Journal of Physiology,2000,278(4):F676-683. |
| [10] | Gratas-Delamarche A,Derbré F,Vincent S,et al.Physical inactivity,insulin resistance,and the oxidative-inflammatory loop[J].Free Radical Research,2014,48(1):93-108. |
 2015, Vol. 31
2015, Vol. 31