2. 广西中医药大学第一附属医院
乙型肝炎是由乙型肝炎病毒(hepatitis B virus,HBV)引起的、以肝脏炎性病变为主的一种传染性疾病,最终可能发展成为肝硬化及肝癌,严重威胁人们的健康[1]。中草药具有多种成分、多个作用靶点的特点,在治疗乙肝时展现出毒副作用小、不易复发等优势,在防治乙肝方面发挥着重要作用。满天星为伞形科植物天胡荽Hydrocotyle sibthorpioides Lam.的全草,常用于治疗急性黄疸型肝炎、急性肾炎等[2]。目前,许多中医治疗证实满天星具有治疗黄疸肝炎的疗效,并建议用于治疗HBV感染[3]。2012年9月,本研究以广西麻鸭为对象,研究满天星提取物对鸭乙肝病毒表面抗原/e抗原(hepatits B surface antigen/hepatits B E antigen,HBsAg/HBeAg),鸭乙型肝炎病毒DNA(DHBV-DNA),谷丙转氨酶/谷草转氨酶(alanine aminotransferase/aspertate aminotransferase,ALT/AST)水平及肝脏病理变化等的影响,分析其抗乙肝作用及其可能机制,为开发满天星提取物应用于乙肝治疗提供实验依据。
1 材料与方法 1.1 材料广西麻鸭(广西畜牧良种养殖场)1日龄,雌雄不拘,体重(50±6)g,50只。满天星(南宁千金子中药有限公司)由广西中医药大学第一附属医院药学部副主任药师鉴定,标本储存于广西医科大学药学院植物标本室。拉米夫定(苏州葛兰素史克制药有限公司); HBsAg和HBeAg酶联免疫检测试剂盒(上海荣盛生物科技有限公司)。实时荧光定量PCR仪(美国Bio-Rad公司)。
1.2 满天星活性成分的提取及化学结构鉴定10 kg满天星药材用80 L 80%乙醇进行提取,每次1.5 h,共3次,合并提取液,真空回收乙醇,得到893.7 g粗提物,然后依次用石油醚、氯仿和水饱和正丁醇萃取。水饱和正丁醇层萃取物(367.2 g)溶解在甲醇中,过滤,回收乙醇,甲醇重结晶,得到黄色粉末粗产物(195.4 g),接着上硅胶柱(200~300目)进一步分离,采用氯仿和甲醇(0~100%甲醇,2 500 mL/馏分)混合物进行梯度洗脱,用薄层色谱收集相同组份,得到12个组分,其中,第8组分上羟丙基葡聚糖凝胶和制备性高效液相色谱进一步纯化,最后得到白色晶体(81.6 g)。通过理化性质和波谱分析鉴定该化合物。
1.3 积雪草苷对鸭急性毒性实验16只1日龄雏鸭随机分为积雪草皂苷组和正常对照组,每组8只。2组动物灌胃给予积雪草苷(20 mg/kg)或生理盐水14 d,每日1次。在实验过程中观察动物的生命体征,包括重量、羽毛的颜色/光泽、步态、进食情况[4]。
1.4 麻鸭乙肝动物模型的建立[5]1日龄雏鸭腹腔注射0.2 mL DHBV-DNA 强阳性病毒血清,接种7 d后,分别从胫静脉采血约0.2~0.3 mL,4 000 r/min离心5 min得血清样本,-20 ℃保存备用。采用PCR法检测筛选出感染阳性鸭。
1.5 实验分组及给药经PCR法检测筛选出感染阳性鸭作为实验动物进行药物治疗试验。将50只鸭随机分为5组,每组10只,即模型对照组(灌胃给予等量的生理盐水),阳性对照组(灌胃给予200 mg/kg拉米夫定,3TC)[6],积雪草苷高、中、低剂量组(分别灌胃给予20、10和5 mg/kg积雪草苷)。积雪草皂苷的给药剂量是参考了以前的研究[7]。各组给予相应药物,每日一次共14 d。实验期间动物自由取食和饮水,并于用药前,用药7、14 d及停药后第3 d分别从胫静脉采血,每只0.5 mL,分离血清,于-20 ℃保存备用。
1.6 检测血清鸭乙肝病毒表面抗原(DHBsAg)和鸭乙肝病毒e抗原(DHBeAg)水平采用商业试剂盒(ELISA法)检测血清 DHBsAg 和 DHBeAg 的水平,实验操作严格按照试剂盒说明书进行。
1.7 荧光定量PCR法检测血清DHBV-DNA[5](1)DHBV-DNA提取:采用直接加热法。每次取血清100 μL,沸水浴10 min,10 000 r/min离心5 min。(2)加样:2×实时荧光定量试剂盒(SYBR Premix Ex TaqTM)12.5 μL,10 umol/L上游引物1.0 μL,10 umol/L下游引物1.0 uL,加无菌双蒸水至23 μL,血清提取物2.0 μL。(3)荧光定量PCR反应条件:95 ℃变性10 s,55 ℃退火20 s,72 ℃延伸30 s,共反应45个循环。扩增过程及数据的储存和分析均由仪器及自带的软件自动完成。
1.8 血清ALT和AST测定分别检测各个时间点鸭血清ALT及AST的变化情况,操作参照试剂盒说明书进行。
1.9 鸭肝脏组织病理学检查于停药后3 d,将实验动物麻醉处死,立即摘取肝脏,各取小块肝组织固定于10%福尔马林中,石蜡包埋切片,用苏木精-伊红染色,光镜观察。
1.10 统计分析采用SPSS 11.5 软件进行分析,治疗前、后比较采用配对资料t 检验,组间比较采用方差分析,组间肝组织病理学程度差异采用Mann-Whitney检验进行评价,P<0.05为差异有统计学意义。
2 结 果 2.1 积雪草苷对鸭的急性毒性实验灌胃给予积雪草苷治疗14 d后,积雪草苷组在体重、羽毛颜色/光泽、步态、进食情况、精神状态和对刺激的反应等方面与正常对照组之间差异无统计学意义,提示积雪草苷对鸭没有毒性。
2.2 积雪草苷对血清HBsAg和HBeAg水平影响(表 1)与模型组比较,阳性对照组与积雪草苷高、中剂量组用药7 d后,均可使鸭血清DHBsAg及DHBeAg的滴度明显降低(均P<0.05),且随着药物浓度和作用时间的增加,其抑制作用逐渐增强,呈现明显的量效和时效反应关系; 停药3 d后,阳性对照组即有反跳现象,积雪草皂苷高中剂量组仍持续有效。
| 表 1 积雪草皂苷对鸭血清DHBsAg、DHBeAg表达的抑制作用(x±s,n=10) |
与模型组比较,积雪草苷高中剂量组在给药7、14 d 和停药后3 d鸭血清DHBV-DNA 拷贝数明显降低(P<0.05); 与给药前比较,积雪草苷各治疗组鸭血清DHBV-DNA 水平下降程度与用药剂量及用药时间相关,并且积雪草苷高剂量组停药后没有出现明显的反跳现象。小剂量组在治疗过程中和停药后DHBV DNA水平变化不明显。阳性对照组用药后,血清DHBV-DNA拷贝数开始明显下降,第14 d 下降到最低值,停药后3 d拷贝数即明显回升,病毒含量变化总体表现为用药时持续下降,停药即出现反跳的规律。
| 表 2 积雪草皂苷对鸭血清DHBV-DNA复制影响(×107 copy/mL,n=10) |
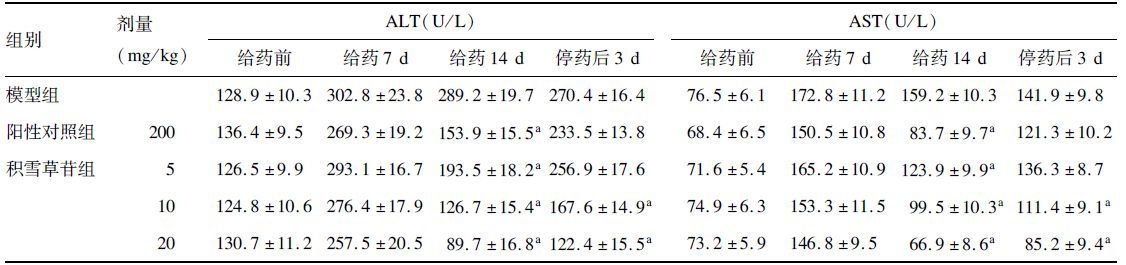
各大组动物ALT、AST水平均在第7 d 达到高峰。阳性对照组及积雪草苷各剂量组在给药后血清ALT与AST均较模型组下降,其中,高剂量组于第14 d 和停药后3 d 下降更为明显显(P<0.05)。
| 表 3 积雪草皂苷对鸭血清ALT、AST活性的影响(x±s,n=10) |
镜下观察可见,模型组的肝细胞显示大量不同程度的空泡变性、坏死和严重的脂肪变性,治疗后阳性对照组和积雪草苷高剂量组炎症有不同程度减轻,结构基本完整,变性肝细胞减少;积雪草苷中低剂量组炎症改善不明显。
3 讨 论本研究采用静脉感染DHBV建立鸭乙肝动物模型,研究满天星提取物积雪草皂苷对鸭乙型肝炎病毒诱导肝损伤的保护作用。国外多用先天感染乙肝病毒的北京鸭雏鸭或康贝尔鸭作为乙型肝炎的动物模型,这种模型的优点是带病毒的时间长[8]。国内亦有运用先天感染DHBV鸭进行实验[9],然而先天感染的缺点是无法获得大量先天性感染DHBV的雏鸭,一般鸭群中雏鸭自然感染DHBV率都不高,所需费用很大。后天感染亦存在带病毒时间短且毒种的收集和保存有一定难度等不足。本课题组成功建立了广西麻鸭乙肝动物模型,且实验证实该品种麻鸭易感染,其病程较规律,病毒血症持续时间较长且较稳定,无明显的自然转阴现象,具有良好的稳定性和可靠性,利用该模型进行了大量抗乙肝中药的筛查研究工作[ 5, 10, 11, 12 ]。
本研究结果表明,与模型组比较,积雪草苷高、中剂量组在治疗第7、14 d,鸭血清HBsAg/HBeAg和DHBV-DNA水平明显下降,且停药后仍维持在较低水平,提示一定剂量的积雪草苷在体内具有明显的抑制DHBV复制作用,且疗效与用药剂量及用药时间相关。拉米夫定(阳性对照)抑制DHBV起效较快,在治疗第14 d各项指标均降低至较低水平,但停药后又有所回升。积雪草苷组与阳性对照组比较,虽然起效较慢,但其抑制DHBV作用平稳而持久。提示积雪草苷组作用机制与拉米夫定可能有所不同。肝脏苏木精-伊红染色病理检查发现,积雪草苷组与阳性对照组鸭肝脏炎症有不同程度减轻,病理改变有一定程度改善。在抗肝损伤方面,肝功能ALT与AST检测显示,积雪草苷高、中剂量组具有改善鸭肝功能的趋势,高剂量组作用明显,提示皂苷还具有保护鸭肝细胞、抗肝损伤的作用。
综上所述,积雪草苷具有抑制DHBV复制、减轻病毒性肝损伤等作用,为临床上用于治疗乙型肝炎提供了理论基础,但积雪草苷抗HBV作用机制尚待进一步研究。
| [1] | 张定凤.乙型肝炎抗病毒治疗的前瞻[J].中华肝脏病杂志, 2006,14(7):483-489. |
| [2] | 宋德平.区别金钱草正品与同名异物的临床应用[J].中国民间疗法, 2004,12(8):38-39. |
| [3] | 熊墨龙,涂鸣汉,胡鹏, 等.天胡荽愈肝片治疗乙型黄疸型肝炎的临床观察[J].中国医药导刊, 2009,11(9):1512-1512. |
| [4] | Li H,Tian D,Wu H,et al.The effect of Gankang Suppository on duck hepatitis B virus,serum biochemistry and liver histology in ducklings[J].Journal of Huazhong University of Science and Technology[Medical Sciences], 2008,28:421-425. |
| [5] | 黄仁彬,黄权芳,张士军, 等.六月青总皂苷抗鸭乙型肝炎病毒作用研究[J].中药药理与临床, 2010,26(1):37-39. |
| [6] | Wang S,Li J,Huang H,et al.Anti-hepatitis B virus activities of astragaloside IV isolated from radix Astragali[J].Biological and Pharmaceutical Bulletin, 2009,32(1):132-135. |
| [7] | Zhang L,Li H,Gong X,et al.Protective effects of asiaticoside on acute liver injury induced by lipopolysaccharide/D-galactosamine in mice[J].Phytomedicin, 2010,17(10):811-819. |
| [8] | Bishop N,Civitico G,Wang YY,et al.,Antiviral strategies in chronic hepatitis B virus infection:I.establishment of an in vitro system using the duck hepatitis B virus model[J].Journal of Medical Virology,1990, 31(2):82-89. |
| [9] | 徐庆,宋云娟,李丽亚, 等.荔枝核总黄酮的抗鸭乙型肝炎病毒作用[J].世界华人消化杂志, 2005,13(17):2082-2085. |
| [10] | 丁华,林兴,黄权芳, 等.六月青皂苷抗鸭乙型肝炎病毒及保护肝细胞的研究[J].中国新药杂志, 2011,20(2):167-169. |
| [11] | 林兴,黄权芳,张士军, 等.山芝麻抗鸭体内乙肝病毒及保肝作用的实验研究[J].华西药学杂志, 2012,27(2):134-137. |
| [12] | 张士军,陈兆霓,李勇文, 等.六月青乙醇提取物对鸭乙型肝炎病毒抑制作用[J].中国公共卫生, 2009,25(5):543-543. |
 2015, Vol. 31
2015, Vol. 31