大豆异黄酮(soybean isoflavone,SIFs)是大豆生长过程中形成的一类次生代谢物,它是以 3-苯丙吡喃酮为母核的一类非营养素化合物,包含染料木素(别称染料木黄酮、金雀异黄素、三羟异黄素)、黄豆苷(二羟异黄酮、黄豆苷元)、大豆黄素(glycitein)及相应的糖苷结合物[1]。大豆中的含量尤为丰富,每100 g 大豆约含 14~153 mg SIFs。SIFs是一种天然的植物雌激素,其结构与内源性雌二醇(17p-estradiol,E2)相似,这种结构相似性使大豆异黄酮可以与内源性雌激素E2竞争结合雌激素受体(estrogen receptor,ER),发挥雌激素效应或抗雌激素效应。虽然SIFs对健康具有一定保护作用[2 ,3],但随着大豆异黄酮在食品工业(尤其保健食品)中的广泛应用,人们的接触量越来越大,SIFs对生命早期生殖系统的潜在毒性作用日益受到关注。因此,本研究以幼龄小鼠为观察对象,探讨断乳至性成熟期持续暴露于大豆异黄酮对卵巢发育的影响,结果报告如下。
1 材料与方法 1.1 实验动物刚断乳雌性ICR小鼠48只,体重(10±2)g,由上海斯莱克实验动物中心提供,许可证号:SCXK(沪)2012—0002,饲养环境为(22±2)℃,湿度为(50±20)%,置于垫以消毒锯木屑的塑料笼,自由饮水进食。
1.2 主要试剂与仪器大豆异黄酮(郑州荔诺生物科技有限公司),甲醛溶液(上海实验试剂有限公司),苏木素、伊红(福州迈新生物技术开发有限公司);Olympus-BioReport图像拍摄系统(日本Olympus公司);2135石蜡切片机(德国莱卡公司);TS-121生物组织自动脱水机、BM-VIII生物组织包埋机(孝感市宏业医用仪器有限公司)。
1.3 动物分组与处理48只小鼠随机分为4组,即对照组,低、中、高剂量大豆异黄酮组(大豆异黄酮50、100、200 mg/kg),对照组给予等量蒸馏水,每日灌胃1次,灌胃容量10 mL/kg,持续5周,每日观察小鼠活动及阴门开放情况,记录第1次阴门开放时间;禁食12 h称重,眼球取血,分离血清待测;颈椎脱臼法处死小鼠,尽可能剔除卵巢周边结缔组织和脂肪组织,在生理盐水中漂洗,将小鼠卵巢用滤纸吸干,电子天平称重;取每组左侧卵巢置于10%多聚甲醛中固定,连续切片,进行苏木素-伊红染色(hematoxylin-eosin staining,HE),计算卵泡构成比。
1.4 指标与方法隔天称1次体重,记录至实验结束;记录小鼠处死前体重及双侧卵巢湿重,计算卵巢系数[卵巢系数(mg/g)=卵巢重量(mg)/小鼠体重(g)];每天观察各组小鼠阴门开放情况,记录每组小鼠阴门开放的日龄;采用化学发光法测定血清中孕酮(P4)和雌二醇(E2)水平;小鼠卵巢组织经固定、包埋,每隔30张取1张切片,每只10张切片,经HE染色,显微镜下观察每张切片的全部视野(×200),计数各级卵泡数量,计算各级卵泡构成比。
1.5 统计分析采用 SPSS 19.0 软件包进行数据分析。定量数据采用单因素方差分析;各组间两两比较采用q检验。各组卵泡构成比比较采用χ2检验(Chi-square test),检验水准α=0.05。
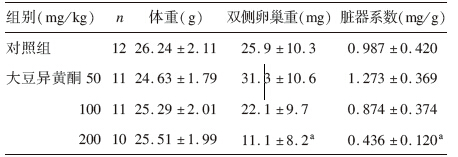
2 结 果 2.1 大豆异黄酮对小鼠体重及卵巢系数影响(表 1)实验期间各组小鼠毛色光泽、进食饮水、粪便、尿液均未见异常,因灌胃操作原因高剂量组死亡2只,而中低剂量组各死亡1只。与对照组比较,各剂量大豆异黄酮组小鼠体重无明显变化;与对照组比较,高剂量大豆异黄酮组小鼠双侧卵巢重量及卵巢系数均降低,差异有统计学意义(F=10.598、14.729,P<0.05)。
| 表 1 大豆异黄酮对小鼠体重、卵巢重量及系数影响(x±s) |
与对照组比较,高剂量大豆异黄酮组小鼠血清雌二醇水平明显降低,差异有统计学意义(P<0.05),各剂量大豆异黄酮组小鼠血清孕酮水平无明显变化;各组小鼠阴门开放率均为100%。与对照组比较,中剂量大豆异黄酮组小鼠平均阴门开放时间提前,差异有统计学意义(P<0.05),而低、高剂量组与对照组比较差异无统计学意义(P>0.05)。
| 表 2 大豆异黄酮对小鼠阴门开放时间影响(x±s) |
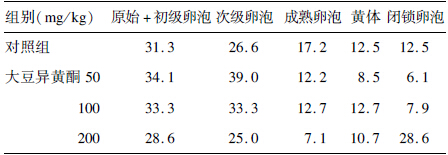
随着大豆异黄酮剂量增加,小鼠成熟卵泡比例呈下降趋势,而闭锁卵泡比例呈上升趋势;与对照组比较,高剂量大豆异黄酮组小鼠成熟卵泡构成比下降、闭锁卵泡构成比升高,差异有统计学意义(χ2=35.50、23.32,P<0.01)。
| 表 3 大豆异黄酮对小鼠卵巢各级卵泡构成比(%)影响 |
目前国内外关于大豆异黄酮安全性的研究报道较少。早期研究发现,采食含有异黄酮植物雌激素的牧草能引起母畜的生育障碍,采用适量的异黄酮植物雌激素喂饲幼牛,其增重速度加快[4]。针对大豆异黄酮存在的弱雌激素和抗雌激素双重活性[5],探讨大豆异黄酮对断乳后雌性小鼠卵巢发育影响,对大豆异黄酮的合理应用具有一定实际意义。本研究结果显示,高剂量大豆异黄酮组雌性小鼠卵巢重量及卵巢系数、血清雌二醇水平均明显低于对照组。提示由于大豆异黄酮发挥了抗内源性雌激素作用,使雌性小鼠体内内源性雌激素不能发挥其促进性器官发育的生理作用,从而抑制了卵巢发育,与已有研究结果一致[6]。
阴门开放是青春期开始的标志,体内雌激素水平会影响阴门开放时间。研究表明,环境内分泌干扰物在一定剂量时可以提前或推迟实验动物阴门开放时间[7 ,8]。本研究结果显示,与对照组比较,中剂量大豆异黄酮组小鼠阴门开放时间提前,而低、高剂量大豆异黄酮组小鼠阴门开放时间未出现明显变化;与低、高剂量大豆异黄酮组小鼠比较,中剂量大豆异黄酮组小鼠血清雌二醇水平有增加趋势,推测中剂量大豆异黄酮一方面可结合足够的雌激素受体发挥效应,另一方面又未对内源性的雌激素产生竞争性抑制,此时大豆异黄酮与体内雌激素可能表现出协同作用。本研究结果还显示,大豆异黄酮组小鼠成熟卵泡比例随着剂量增加呈下降趋势,而闭锁卵泡比例则呈上升趋势,尤以高剂量组变化更为明显,提示大豆异黄酮可能具有促进卵巢卵泡等细胞凋亡的作用,这与已有研究结果不一致[9,10]。这可能与较高剂量的大豆异黄酮表现出抗雌激素效应或者启动凋亡信号途径诱发颗粒细胞凋亡从而引发卵泡闭锁有关。具体机制有待于进一步研究。
| [1] | 颜瑞, 王恬. 大豆异黄酮抗氧化作用研究进展[J]. 家畜生态学报, 2010, 31(4):96-100. |
| [2] | Hcnfrey CDN.Phytoestrogens and human health effects:weighing up the current evidence[J].Wat Toxins,1998, 6:51-59. |
| [3] | Cos P,Bruyne TD,Apers S,et al.Phytoestrogens:recent developments[J].Planta Med,2003,69:589-599. |
| [4] | 黄金明, 王根林, 柳尧波.植物雌激素对动物生殖及生殖内分泌的影响[J].动物医学进展, 2003, 24(3):18-21. |
| [5] | 郑元林,韩正康,陈杰, 等.大豆黄酮对绵羊肝脏氮代谢及其有关激素水平的影响[J].南京农业大学学报,2001,24(3):57-60. |
| [6] | Matagne V,Rasier G,Lebrethon MC,et al.Estradiol stimulation of pulsatile gonadotropin releasing hormone secretion in vitro:correlation with perinatal exposure to sex steroids and induction of sexual precocity in vivo[J].Endocrinology,2004,145(6):2775-2783. |
| [7] | 李海斌,李君,姚三巧.氯氰菊酯对雌性大鼠生殖器官的影响[J].环境与健康杂志,2008,25(8):708-710. |
| [8] | John A.Endocrine disrupters and female reproductive health[J].Best Pract Resclil1 Endocrinol Metab,2006,20(1):63-75. |
| [9] | 孙晓芳,段斐.大豆异黄酮对去卵巢大鼠阴道上皮Bcl-2 mRNA影响[J].中国公共卫生,2009,25(3):373-374. |
| [10] | 张涛,迟晓星,郭艳萍, 等.大豆异黄酮对大鼠卵巢Bcl-2和Bax蛋白表达影响[J].中国公共卫生,2011,27(3):337-338. |
 2015, Vol. 31
2015, Vol. 31