氟过量对人体损害主要集中在骨性系统和非骨性系统,其中以骨相损害为重,随着氟中毒病研究的不断深入,氟对非骨相组织的毒性作用逐渐被人们重视。肾脏是体内氟的主要排泄器官,进入机体的氟约85%随尿排出,所以氟中毒时肾脏是非骨相损害的主要靶器官之一。研究发现染氟后肾小管上皮细胞有明显的形态变化,肾小管功能出现障碍[ 1, 2, 3, 4 ]。越来越多的证据表明,氟中毒发病机制与Wnt经典信号传导通路关系密切[5]。本研究通过观察慢性染氟对大鼠肾小管上皮细胞Wnt通路中相关分子表达影响,探讨Wnt通路在氟中毒肾脏损伤发病机制中的作用,结果报告如下。
1 材料与方法 1.1 主要试剂与仪器兔抗鼠多克隆抗体Wnt4、E-粘钙蛋白(E-cadherin)(美国Santa Cruz公司),β-连环蛋白(β-catenin)(美国Gene Tex公司);SP-9000三步法免疫组化试剂盒、二氨基联苯胺显色试剂盒(北京中杉金桥生物技术有限公司);总RNA提取试剂Trizol(美国Invitrogen公司),Supermix(SYBR Green)(美国Bio-Rad公司)。5810-R型台式冷冻离心机(德国Eppendorf Germany公司);Real-time PCR仪(美国Bio-Rad公司)。
1.2 实验动物分组与处理选取4~5周龄,健康SD大鼠36只(第三军医大学大坪医学动物实验中心),许可证号:SCXK(渝)2007-0005,体重80~100 g,雌雄各半。将大鼠随机分为对照组(饮水含氟量<1 mg/L),低、高氟组(饮水加氟量5、50 mg/L),每组12只,饲料均为常规饲料(贵阳医学院实验动物中心)。用不同浓度的含氟水饲养大鼠8个月,确定氟中毒模型建立成功后,在处死大鼠前1 d,将大鼠置于代谢笼中,收集24 h尿液,股动脉放血处死大鼠后,一侧肾立即投入中性甲醛固定液中,充分固定,另一侧肾及血清于-80 ℃冰箱保存备用。
1.3 指标与方法 1.3.1 大鼠一般状况观察与体内氟含量检测实验期间,观察大鼠氟斑牙发生情况,氟斑牙分度标准为:I度:牙表面黄、白相间,白垩条纹清晰;Ⅱ度:牙表面呈无光泽粉笔样白色斑;III度:牙表面出现小沟、裂纹或部分脱落,牙齿呈锯齿状严重缺损。每15 d测量大鼠体重。采用氟离子选择电极法测定尿氟及骨氟含量,应用自动血生化分析仪检测血清肌酐(Cr)、尿素氮(BUN)含量。
1.3.2 大鼠肾组织Wnt通路因子蛋白表达测定采用免疫组化(SP-9000 三步法),石蜡切片脱蜡至水,柠檬酸高压修复5 min,自然冷却至室温,3%过氧化氢孵育20 min,滴加山羊血清(A液)封闭37 ℃水浴箱孵育30 min后倾去不洗,滴加1:50稀释一抗4 ℃过夜。次日取出复温30 min后,滴加二抗(B液),37 ℃水浴箱孵育30 min,滴加辣根过氧化物酶(C液)37 ℃水浴箱孵育20 min;显色,流水终止反应;苏木素复染,脱水、透明、封片。用磷酸盐缓冲液代替一抗作为空白对照,β-catenin以胞浆和胞核内出现棕黄色或棕褐色颗粒为阳性,Wnt4、E-cadherin阳性表达定位于细胞浆。每张切片于显微镜下随机观察5个高倍视野,每个视野取5个区域测其平均灰度,灰度值高则表达强,计算Wnt4、β-catenin、E-cadherin阳性细胞数。
1.3.3 大鼠肾组织Wnt通路因子mRNA表达水平测定按照Trizol总RNA提取试剂说明书提取大鼠肾组织总RNA,在DU 640蛋白质核酸定量分析仪上读取RNA浓度(数值)及OD260/OD280比值(1.8~2.0)之间,cDNA的合成按照逆转录扩增试剂盒操作程序合成。利用Primers软件设计目的基因引物,由上海生工公司合成(表 1)。PCR反应体系为:SYBR Green I染料5 μL;上下游引物(10 mol/L)各0.5 μL,共1.0 μL;cDNA模板(100 ng)1 μL;灭菌双蒸水3.0 μL;总反应体积为10 μL。阴性对照用1.0 μL灭菌双蒸水代替cDNA模板。反应条件为:95 ℃30 s;95 ℃5 s.61 ℃ 1 s,72 ℃30 s,40个循环;72 ℃10 min。以SYBR Green I为荧光标记,以β-actin为内参照。反应结束,软件直接生成Ct值,计算出2-△△ct,将对照组设定为1,对待测因子mRNA表达进行相对定量。
| 表 1 RT-PCR引物序列 |
数据采用(±s)表示,采用SPSS 17.0软件进行统计分析,实验数据若方差齐,用单因素方差分析;组间两两比较采用最小显著差法,方差不齐采用非参数检验,P<0.05为差异有统计学意义。
2 结 果 2.1 染氟对大鼠一般状况及组织中氟含量影响(表 2)对照组大鼠皮毛光滑,食欲良好,活跃,牙齿无明显病变;随染氟时间延长,低氟组大鼠出现精神萎靡,食欲减退,活动度下降;高氟组大鼠上述表现更明显,且皮毛无光泽。各组大鼠体重随饲养时间延长均增加,各组间大鼠体重差异无统计学意义(P>0.05)。染氟组大鼠氟斑牙总检出率为83.3%(20/24),低氟组为75%(9/12),高氟组为91.7%(11/12);与对照组比较,低、高氟组大鼠尿氟、骨氟含量明显升高(P<0.05),染氟组大鼠血清肌酐及尿素氮明显高于对照组(P<0.05)。
| 表 2 染氟对大鼠尿氟、骨氟、血清肌酐及尿素氮含量影响(x±s,n=12) |
光镜观察可见对照组大鼠肾脏无明显变化(图 1A);低氟组大鼠肾脏皮髓质交界处和髓质的肾小管上皮细胞可见细胞水肿,部分肾小管管腔狭窄(图 1B);高氟组大鼠肾脏皮髓质交界处及髓质出现明显肿胀,肾小管管腔狭窄变形,间质充血明显(图 1C)。未见明显肾间质纤维化。
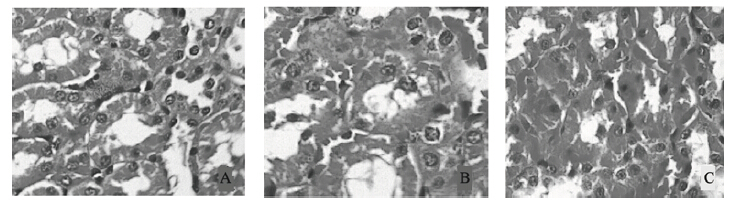 | 注:A对照组、B低氟组、C高氟组S 图 1 染氟对大鼠肾组织病理形态学影响(HE,×40) |
免疫组化显示,Wnt4着色于大鼠肾组织的肾小管上皮细胞胞质中,呈棕褐色,随染氟剂量增加,阳性表达逐渐增多;β-catenin主要着色于肾组织的肾小管上皮细胞胞膜及胞质中,随染氟剂量增加,β-catenin在胞质和胞核表达明显增强(P<0.05);E-cadherin主要着色于肾小管上皮细胞胞膜及胞浆,随染氟剂量增加,表达明显降低(P<0.05)。
| 表 3 染氟对大鼠肾组织中Wnt4通路因子蛋白表达影响(x±s,n=12) |
随染氟剂量增高,大鼠肾组织中Wnt4和β-catenin mRNA表达逐渐增加,E-cadherin mRNA表达逐渐降低,差异均有统计学意义(P<0.05)。
| 表 4 染氟对大鼠肾组织中Wnt4通路因子mRNA表达影响(x±s,n=12) |
地方性氟中毒是地球化学性疾病,长期以来严重危害人们生活质量和生活水平[6]。近年来,对于氟中毒,不仅仅局限于氟对骨性系统研究[7],更多学者从流行病学或动物实验角度,证实过量的氟对机体软组织系统均可造成广泛性损伤[8 ,9]。肾脏作为氟排泄的主要器官,进入机体的氟约有85%随尿排出,所以氟中毒时肾脏是非骨相损害的主要靶器官之。
本研究结果显示,随着氟摄入量增加,氟中毒大鼠氟斑牙发生率增加,且骨氟、尿氟含量较对照组明显增高,表明氟中毒大鼠模型建立成功;氟中毒组大鼠肾小管上皮细胞可见细胞水肿,部分肾小管管腔狭窄,间质充血明显,随着染氟浓度增高,肾小管上皮细胞损伤改变加重;氟中毒组大鼠血清中肌酐、尿素氮含量明显高于对照组,提示染氟组大鼠肾功能出现一定程度损害。由此可见,过量的氟可引起大鼠肾脏组织结构的改变,并导致肾脏功能受损。研究表明Wnt/β-catenin信号通路在肾脏损伤的发生、发展过程中起着重要作用[10]。正常机体肾脏中Wnt信号是沉默的,胞浆内β-catenin大部分与E-cadherin结合,对维持同型细胞的黏附、防止细胞迁移发挥作用。少部分被糖原合成酶激酶一腺瘤性息肉病基因蛋白(APC)一轴蛋白(axin)构成的β-catenin复合体所降解,使β-catenin保持较低水平,Wnt信号通路处于关闭状态[11,12]。当Wnt通路被激活后,Wnt蛋白与细胞膜上的跨膜受体结合,激活胞内的散乱蛋白,β-catenin降解、复合体失活,β-catenin磷酸化减少,进入细胞核内的β-catenin增多,与T细胞因子(T cell factor,TCF)/淋巴增强因子/(lymphoid enhancer factor,LEF)结合,形成转录激活复合体,引起特定基因如E-cadherin的表达减弱,α-平滑肌肌动蛋白(α-SAM)增强等,促进肾小管上皮细胞间充质转分化(EMT)的发生,引起肾小管损伤。Surendran等[13]利用单侧输尿管结扎方法造成大鼠肾小管间质性肾纤维化模型,发现多种Wnt蛋白表达增强,并诱导促进纤维化的靶基因表达。肾移植患者于移植后3、12个月肾活检发现:若移植后3个月时出现肾小管上皮细胞β-catenin由胞膜向胞质转移现象,并伴随肾脏EMT标志性蛋白之一波形蛋白表达增高的患者,12个月再次肾活检时肾脏纤维化指数更高,肾小管间质纤维化进展更快。提示,Wnt参与了肾间质纤维化过程。β-catenin 是Wnt信号通路中的关键调控点,在肾脏中,它分布于肾单位的各个部分,可与E-、N-、P-、K-、R-、OB-、VE-cadherin等(除KsP-cadherin)结合,构成上皮细胞、间质细胞、内皮细胞等多种细胞的粘附连接。E-cadherin为重要的细胞黏附分子,是一类建立细胞间紧密连接,维持细胞极性,保持组织结构完整的钙依赖性跨膜糖蛋白[14]。
本研究结果显示,在慢性染氟条件下,大鼠肾小管上皮细胞中Wnt4 mRNA和蛋白表达均增加,且E-cadherin阳性表达随染氟剂量增加逐渐减少,而β-catenin阳性表达逐渐增加,提示染氟后的大鼠肾脏肾小管发生了EMT。本研究结果未观察到染氟大鼠肾脏纤维化表现,可能与观察时间较短和染氟浓度较低有关。EMT作为肾纤维化发生发展的重要步骤和中心环节,对评定慢性氟中毒肾病进展及判断预后具有重要的实用价值,可作为临床早期检测氟中毒肾脏发生纤维化的可靠指标。
| [1] | Shashi A, Singh JP, Thapar SP.Toxical effect of fluoride on rabbit kidney[J].Fluoride, 2002, 35(1):38-50. |
| [2] | 边晓燕, 张守臣, 王志成, 等.实验性氟中毒大鼠肝、肾组织的超微结构观察[J].电子显微学报, 2000, 19(3):227-228. |
| [3] | 阿斯木古丽克力木, 刘开泰, 连军, 等.维生素C、E对氟中毒大鼠肝、肾、脑组织超微结构的影响[J].中国地方病学杂质, 2008, 27(4):378-382. |
| [4] | 朱周福, 胡尚林, 张骞, 等.鸡慢性氟中毒部分器官病理学变化研究[J].畜禽业, 2005, 1:52-55. |
| [5] | 陈锡山, 于燕妮, 易韦, 等.氟对大鼠成骨细胞Wnt3a、β-链蛋白mRNA和蛋白表达的影响[J]中华地方病病理学杂志, 2013,3(32):140-145. |
| [6] | 李广生, 徐辉.当前氟中毒机制研究中的几个问题[J].中国地方病学杂志, 2006, 25(2):119-120. |
| [7] | 邓超男, 于燕妮.细胞核转录因子-κB 与地方性氟中毒骨骼病变[J].中国公共卫生, 2010, 26(11):1448-1449. |
| [8] | 刘艳洁, 高勤, 官志忠.氟中毒对大鼠脑组织Ras-Erk1/2 通路及转录因子CREB 的影响[J].中国地方病防治杂志, 2011, 26(2):88-90. |
| [9] | 周谊霞, 于燕妮, 官志忠, 骨桥蛋白与氟中毒肝损害关系研究进展[J].中国公共卫生, 2009, 25(11):1337-1338. |
| [10] | 赖玮婧, 廖宇捷, 刘芳, 等.Wnt信号转导通路与肾脏发育的关系[J].中华肾脏病杂志, 2012, 28(2):972-975. |
| [11] | Waltzer L, Bienz M.The control of beta-catenin and TCF during embryonic development and cancer[J].Cancer Metastasis Rev,1999, 18:231-246. |
| [12] | He TC, Sparks AB, Rago C, et a1.Identification of c-myc as a target of APC pathway[J].Science, 1998, 281:1438-1441. |
| [13] | Surendran K,Schiavi,Hruska KA.Wnt-dependent beta-catenin signaling is activated after unilateral ureteral obstruction and recombinant secreted fizzled related protein 4 alters the progression of renal fibrosis[J].J Am Soc Nephrol,2005,16(3):667-675. |
| [14] | Prozialeek WC, Lamar PC, Appelt DM.Differential expression of E-cadherin,N-catenin and beta-eatenin in proxim a land distal segments of the rat nephron[J].BMC Physiology, 2004, 4(10):112-115. |
 2015, Vol. 31
2015, Vol. 31


