流脑是由脑膜炎奈瑟菌引起的起病急,病情发展迅速,如果治疗不及时很快引起死亡的急性呼吸道传染病。建立特异、快速的脑膜炎奈瑟菌(Neisseria meningitidis,Nm)检测与分群方法,提高病原菌的检出率,有效控制传染源,是控制流脑流行的最有效的途径。传统细菌分离培养、染色镜检、生化鉴定和血清学分群等检测方法不但费时费力,且检测结果受抗生素使用及其他非特异性因素的影响,检出率低。而Nm至少包括13个血清群,全球90%以上的流脑病人均有A、B、C、Y和W135群引起[1]。本研究采用多重PCR方法同时检测及鉴别Nm的A、B、C、Y和W135 5个血清群,结果报告如下。
1 材料与方法 1.1 标准菌株及样本Nm各群的阳性对照质控菌株(中国药品生物制品检定所)分别为29019(A群)、29061(B群)、29012(C群)、29303(Y群)和29057(W135群)。阴性对照菌株为肺炎链球菌、金黄色葡萄球菌、流感嗜血杆菌和乳糖奈瑟氏菌(江西省疾病预防控制中心传染病所实验室分离并保存)。70份Nm分离株(江西省近年流脑临床患者、暴发疫情及带菌者调查中带菌者分离鉴定)23份疑似流脑病人脑脊液标本(江西省市县级疾病预防控制中心)。
1.2 试剂与培养基营养琼脂、多粘菌素B、万古霉素(北京陆桥有限公司)。卵黄双抗平板、巧克力双抗平板本实验室自配。API NH 鉴定试剂(法国梅里埃公司),脑膜炎奈瑟菌单克隆抗体诊断血清(美国BD公司)。Taq酶、10×PCR buffer、dNTP Mixture、Marker(100 bp DNA Ladder)、Marker(500 bp)、6×Loading Buffer(宝生物工程(大连)有限公司)。PCR引物(上海生工公司合成)。PCR引物根据参考文献[2, 3, 4]设计(表 1)。
| 表 1 扩增Nm各群所用引物 |
扩增仪(美国Bio-Rad公司)、自动凝胶成像仪(美国Bio-Rad公司)、电泳仪(中国上海天能科技有限公司TANONEPS-100)、超净工作台(中国苏净安泰SW-CJ-2FD)、培养箱(日本EYELA SLI-1200)、高速冷冻离心机(德国SIGMA 3-18K)、生物安全柜(美国Thermo公司)。
1.4 方法 1.4.1 PCR检测方法挑取菌落于100 μL去离子水于eppendorf管中,放于金属裂解仪中100 ℃ 15 min 后,12 000 r/min 离心5 min,取上清即为PCR 扩增模板。将脑脊液吸取100 μL于 eppendorf管中,放于金属裂解仪中100 ℃ 15 min 后,12 000 r/min 离心5 min,取上清液用于PCR 扩增。反应总体积25 μL,在200 μL 管中依次加入:10×buffer 2.5 μL;dNTPS(每种dNTP 溶液浓度为2.5 mmoL/L) 2 μL ;引物每条1 μL(终浓度1 μmoL/L) ;Taq 酶0.5 μL(5 U/μL);超纯水8 μL ;模板2 μL 。以阳性对照质控菌株作阳性对照,肺炎链球菌、金黄色葡萄球菌、流感嗜血杆菌和乳糖奈瑟氏菌作阴性对照。反应程序:94 ℃ 5 min,变性模板DNA ;然后94 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,35个循环;最后72 ℃延伸10 min 。PCR产物用3%琼脂糖凝胶电泳,500 bp 和100 bp DNA Ladder Marker作参照。
1.4.2 传统的细菌培养法和血清凝集法取50 μL 脑脊液直接接种于巧克力培养基,37 ℃ 5%~10% CO2环境中培养18~24 h,观察细菌生长情况,挑取可疑菌落作氧化酶试验、革兰染色筛选,再采用API NH生化鉴定至种,采用A、B、C、Y、W135各群单克隆抗体血清分型。血清凝集分群按常规玻片凝集方法进行。
2 结果 2.1 PCR检测结果70株Nm经多重PCR检测结果为8株A群,12株B群,48株C群和2株W135群,68株与血清分群结果一致。2株血清未能分群的菌株多重PCR检测结果为C群。检出率分别为100%和97.14%。23例流脑疑似病人的脑脊液标本5份检出NmC群siaD(C) 基因,1份检出NmA群Orf-2基因,1份检出NmB群siaD(B)基因。
2.2 传统的细菌培养法和血清凝集法结果(图 1)23例流脑疑似病人的脑脊液标本作细菌培养,4份脑脊液标本培养出可疑脑膜炎奈瑟氏菌。经染色均为革兰阴性双球菌,氧化酶试验阳性,葡萄糖、麦芽糖均(+),蔗糖、乳糖、果糖均(-),血清学分群鉴定确认4株可疑菌株均为C群脑膜炎奈瑟氏菌,与多重PCR检测结果一致。多重PCR和病原分离培养检出率分别为30.43%和17.39%。Nm菌各群的特异基因均能准确的确定实验所检测的Nm菌株的血清群,作为对照的其他群Nm和阴性对照的金黄色葡萄球菌、肺炎链球菌、流感嗜血杆菌及乳糖奈瑟氏菌菌株均为阴性。
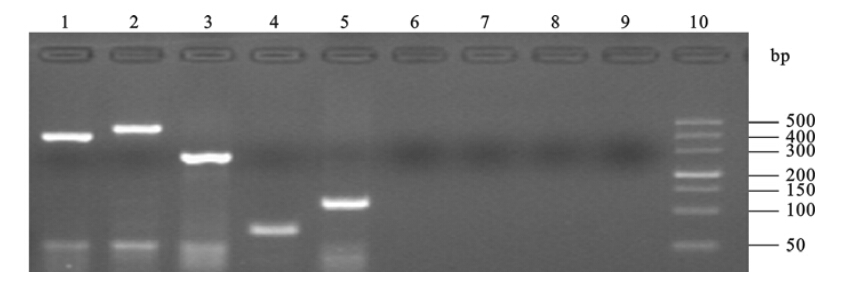 | 注:10:Marker;1~9依次为:NmA、NmB、NmC、NmY、NmW135、肺炎链球菌、金黄色葡萄球菌、流感嗜血杆菌和乳糖奈瑟氏菌 图 1 多重PCR Nm各群的阳性对照质控菌株和阴性对照菌株扩增情况 |
中国流脑的流行一直以A群为主,2003年以后开始出现C群流脑的暴发和局部地区的流行,近年来一些地区也出现了B群、X群、W135群等感染病例的报道[5, 6, 7]。A群和C群Nm感染可以通过疫苗接种进行预防,但是其它血清群的Nm尚无相应的疫苗,目前只能通过提前用药进行预防,因此,为了采取正确的防治措施,在流脑的诊断中有必要对Nm进行分群检测,这也有助于掌握Nm的血清群流行情况,以便针对性地接种或研发疫苗。快速检测和鉴定病原菌及分群,是及时有效地诊断、控制与预防流脑传播的重要手段。经典的检测方法包括增菌、分离培养、生化或血清学鉴定。这些方法操作繁琐、费时,也受到许多因素的影响,容易造成漏检。而且,对于那些在采样之前接受过抗生素治疗的病例,病原分离率会有一定程度的降低,另外,样品质量、培养条件、诊断血清的质量等一些因素也能影响培养阳性率。普通PCR[8]对Nm的鉴定及分群是传统方法的一个飞越,但是对Nm的鉴定及分群时需要对每个血清群配置一个反应体系,即一个实验仅能对一个靶基因进行分析,操作时比较麻烦。虽然有人研发了荧光PCR[9, 10, 11],但是此方法对设备的要求较高,购买昂贵,实验室难以普及。
多重PCR以其突出的优越性得到了广泛的应用,自1988年Chamberlian等[12]首次提出这一概念起,多重PCR技术已被广泛应用于核酸诊断的许多领域,包括基因敲除分析[13]、突变和多态性分析[14]、定量分析以及RNA检测等。在感染性疾病领域,多重PCR技术也己经显示出它的价值。普通PCR及多重PCR对Nm基因分群的目的是了解其血清群,大多数情况下,与血清分群结果一致,但也有少数菌株,因为群特异性基因中有缺失、插入或滑移错配,使其荚膜不能正常表达,表现为血清不可分群,而这种基因序列的改变未能通过基因分群体现出来,因此出现了基因群与血清群不一致的情况[15, 16]。
| [1] | Stephens DS.Conquering the meningococcus[J].FEMS Microbiol Reviews,2007,31:3-14. |
| [2] | Borrow R,Claus H,Guiver M,et al.Non-culture diagnosis and serogroup determination of meningococcal B an d C infection by a sialyltransferase(siaD) PCR ELISA[J].Epidemiol Infect,1997,118:111-117. |
| [3] | Fraisier C,Stor R,Tenebray B,et al.Use of a new single multiplex PCR-based assay for direct simultaneous characterization of six Neisseria meningitidis serogroups[J].Journal of Clinical Microbiology,2009:2662-2666. |
| [4] | Mlling P,Jacobsson S,Backman A,et al.Direct and rapid identification and genogrouping of meningococci and porA amplification by Light Cycler PCR[J].J Clin Microbiol,2002,40:4531-4535. |
| [5] | Shao Z,Li W,Ren J,et al.Identification of a new Neisseria meningitidis serogroup C clone from Anhui province,China[J].Lancet,2006,367(9508):419-423. |
| [6] | 汤健闻,梁华庆,吕冬艳.1962-2005年百色市流脑流行趋势分析[J].应用预防医学,2006,12(2):102-103. |
| [7] | 徐丽.我国流脑发病的形势与预防[J].疾病监测,2002,(2):74. |
| [8] | 熊长辉, 杨梦, 袁辉, 等.PCR 技术在流行性脑脊髓膜炎诊断中的应用研究[J].中国热带医学, 2009, 9(9):1660-1661. |
| [9] | Thomas JD,Hatcher CP,Satterfield DA,et al.sodC-based real-time PCR for detection of Neisseria meningitidis[J].PLoS One 2011,6:319-321. |
| [10] | Mothershed EA,Sacchi CT,Whitney AM,et al.Use of real-time PCR to resolve slide agglutination discrepancies in serogroup identification of Neisseria meningitidis[J].Clin Microbiol,2004,42:320-328. |
| [11] | 杨艳, 汪川, 苏红卫, 等.脑膜炎奈瑟菌荧光定量PCR法检测[J].中国公共卫生, 2009,25(9):1086-1087. |
| [12] | Chamberlain JS,Gibbs RA,Rainer JE,et al.Deletion screening of the Duchenne muscular dystrophy locus via multiplex DNA amplification[J].Nucleic Acids Res,1988,16(23):41-56. |
| [13] | Gannon VP,King RK,Kim JY,et al.Rapid and sensitive method for detection of shiga-like toxin producing Escherichia coli in ground beef using the polymerase chain reaction locus via multiplex DNA amplification[J].Appl Environ Microbiol,1992,58(12):3809-3815. |
| [14] | Rithidech KN,Dunn JJ,Gordon CR.Combining multiplex and touchdown PCR to screen murine microsatellite polymorphisms[J].Biotechniques,1997,23(1):36,40,42,44. |
| [15] | Dolan-Livengood JM,Miller YK,Martin LE,et al.Genetic basis for nongroupable Neisseria meningitids[J].Infect.Dis,2003,187:1616-1628. |
| [16] | Wber MV,Claus H,Maiden MC,et al.Genetic mechanisms for loss of encapsulation in polysialyltransferase-gene-positive meningococci isolated from healthy carriers[J].Med Microbiol,2006,296(7):475-84. |
 2015, Vol. 31
2015, Vol. 31


