酸性鞘磷脂酶(acid sphingomyelinase,ASM)是一类可作用于磷酸二酯键的溶酶体酶,水解细胞膜表面或溶酶体中的鞘磷脂生成神经酰胺(ceramide)和磷酰胆碱,而神经酰胺作为第二信使与细胞凋亡、分化、增殖、自噬、衰老等多种生物学进程密切相关[1,2]。国内外对生物样品中ASM活性检测已有相关报道[3,4,5]。以3H标记的鞘磷脂为反应底物,通过测定水解产物的放射活性,间接推算ASM活性[3],还可采用试剂盒测定ASM活性,以Amplex Red染料进行荧光标记后相对定量测量[4],此方法成本较高、荧光易淬灭,不适合进行大批量样品的测量。本研究以荧光标记衍生物为检测对象,建立一套反向颗粒填充柱分离、荧光检测器检测的分析方法,并对测试条件和仪器各项参数指标进行优化,结果报告如下。
1 材料与方法 1.1 实验动物选取健康SPF级昆明小鼠12只,体重为18~22 g(长沙市开福区东创实验动物科技服务中心),实验动物生产许可证号:SCXK(湘)2009-0012号。喂养条件,温度25 ℃、湿度50%、自由饮食饮水、14 h光照和10 h黑夜,实验前观察2周。
1.2 主要试剂与仪器BODIPY® FLC12-Sphingomyelin(美国Invitrogen公司);B12-Ceramide(美国Cayman Chemical公司);Igepal-630(美国Sigma公司);甲醇、乙醇(色谱纯,美国Tedia公司);氯化锌、乙酸铵、磷酸(分析纯,天津科密欧公司)。高效液相色谱仪(日本岛津公司);Milli-Q超纯水机(美国Millipore公司);Q5000型高精度超微量紫外分光光度计(美国Quawell公司);电动玻璃匀浆机(宁波新芝公司);低温高速离心机(上海力康公司)。
1.3 色谱分析条件高效液相色谱仪,配SIL-20A型自动进样器、LC-20AT泵、RF-20A荧光检测器;色谱柱参数,ACQUITY BEH C18柱(1.7 μm,2.1 mm×30 mm);1.5 mL自动进样瓶(带内插管);荧光检测器设置,激发波长505 nm,发射波长540 nm;流动相配制,甲醇:13 mmol/L乙酸钠溶液(V ∶V)=95∶5;流速0.8 mL/min;进样量为10 μL。
1.4 标准曲线制备分别取B12-Cer标准应用液(浓度为10 μmol/L)0、40、80、120、160、640、1 280、2 500、5 000 μL,置于10 mL容量瓶中,甲醇定容,使终浓度为0、40、80、120、160、640、1 280、2 500、5 000 nmol/L。每个标准品重复进样3次,以峰面积为Y轴,B12-Cer含量为X轴绘制标准曲线。
1.5 生物样品前处理小鼠颌下静脉丛取全血约500 μL,肝素钠抗凝,4 000 g离心5 min,取上清,置于-20 ℃待测;使用代谢笼收集小鼠24 h尿,4 ℃保存待测;小鼠禁食过夜,4%水合氯醛麻醉后,U型切口剪开小鼠腹腔,取约1 g肝组织,用生理盐水漂洗2遍,拭干称重后剪碎,冰浴制成10%肝组织匀浆,4 000 r/min离心5 min,取上清置于-20 ℃待测。
1.6 荧光底物孵育与样品检测取3 μL组织匀浆放入干净的0.5 mL离心管中,加入3 μL已配制好的ASM反应底物(100 μmol/L B12-Spm、0.2 mmol/L ZnCl2、0.2% Igepal CA-630、0.2 mol/L乙酸钠,pH=5.0),充分混匀,37 ℃孵育2 h。待反应结束后,取5 μL孵育液加入95 μL乙醇中,终止反应。混匀,12 000 g离心5 min,取上清液,置于1.5 mL带内插管的自动进样瓶,上机测试。
2 结 果 2.1 B12-Spm和B12-Cer标准峰出峰时间和色谱图(图 1)B12-Spm在ASM激活水解作用下,生成带有荧光基团的B12-Cer,底物(B12-Spm)和产物(B12-Cer)的保留时间分别为1.711和0.948 min。
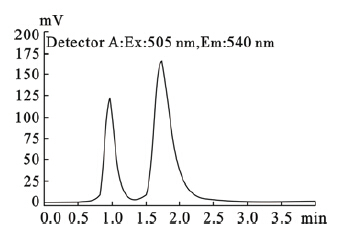 | 图 1 B12-Spm 和B12-Cer的标准色谱图 |
选取不同荧光底物孵育时间0.5、1、2、4、8、12 h,选取不同荧光底物孵育温度4、37、70 ℃,测定肝组织匀浆的ASM活性。结果显示,荧光孵育2 h内B12-Cer检出量上升最快,之后达到平台期,而37 ℃孵育效果优于4 ℃和70 ℃。最终确定本方法最优孵育时间为2 h,孵育温度为37 ℃。
2.3 标准曲线、检出限和最低检出浓度B12-Cer响应灵敏,基线噪声低,线性关系好。标准曲线为y=536.76x+18 559,R2=0.998 8,根据色谱条件和仪器参数,结合相关文献[6]分析,以3倍信噪比确定方法检出限为5.86 nmol/L(S/N=3),以10倍信噪比确定方法定量限为19.53 nmol/L(S/N=10)。
2.4 方法精密度、稳定性与准确性试验测定3个浓度120、2 500、5 000 nmol/L的重现峰,重复测量6次。峰面积相对标准偏差(relative standard deviation,RSD)为2.2%~4.7%。将浓度为2 500 nmol/L B12-Cer标准液于室温避光放置6、12、24、48、72 h后检测,荧光信号强度在24 h之前只有1%衰减,72 h达3%。分别取小鼠3 μL血浆、尿液和肝组织匀浆各2份,其中1份加入120 nmol/L的B12-Cer标准液,测定样品回收率,结果显示小鼠血浆、尿液和组织匀浆的加标回收率分别为87.3%、78.4%、83.6%。
2.5 生物样品中ASM活性测定结果(图 2)正常成年昆明小鼠血浆中ASM活性为(927.40±189.62)nmol/(μL·h),24 h尿液中ASM活性为 (122.88±49.84)nmol/(μL·h),10%肝细胞匀浆中ASM活性为(422.51±65.81)nmol/(μL·h)。
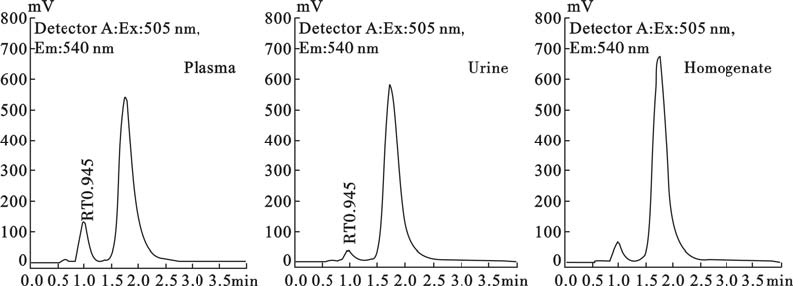 | 图 2 成年小鼠血浆、尿液和肝组织匀浆中ASM活性高效液相色谱图 |
本方法最大优点是4 min即可完全分离B12-Cer和B12-Spm,且使用自动进样器提高了检测效率。既往的ASM活性测定方法耗时较长,单个样品通常要>6 h,而本方法有效的避免了人力和时间的浪费,可用于大规模人群普查。方法检出限可精确测量到纳摩尔级别,检出率高。稳定性检测结果显示,孵育荧光底物24 h内上机测试,产物荧光强度衰减很少。取同样体积(3 μL)生物样品,ASM活性在血浆中更易检出,而尿中则较低,这可能与正常生理状态下,ASM不易透过肾小管过滤有关。近年来生物医学领域的研究不再局限于核酸、蛋白水平,对于小分子脂类的研究越来越深入,同时更多的关注蛋白表达后对酶活性的功能改变[7]。高效液相色谱法,对仪器设备要求不高,操作流程快、简便,结果准确、可靠,用于检测生物样品中ASM活性效率高、成本低,可适用于大规模的人群筛查、生物标志物的开发等。
| [1] | Truman JP,Al Gadban MM,Smith KJ,et al.Acid sphingomyelinase in macrophage biology[J].Cell Mol Life Sci,2011,68(20):3293-3305. |
| [2] | Hou Q,Jin J,Zhou H,et al.Mitochondrially targeted ceramides preferentially promote autophagy,retard cell growth,and induce apoptosis[J].J Lipid Res,2011,52(2):278-288. |
| [3] | 董悦生,杨峻山,张华,等.微生物来源酸性鞘磷脂酶抑制剂NF-0265A的研究[J].中国药学杂志,2005,40(22):1752-1754. |
| [4] | Zhang L,Xu SC,Zhang GB,et al.Roles of acid sphingomyelinase activation in neuronal cells apoptosis induced by microwave irradiation[J].J Radiat Res Radiat Process,2009,27(6):354-359. |
| [5] | He X,Chen F,Dagan A,et al.A fluorescence-based,high-performance liquid chromatographic assay to determine acid sphingomyelinase activity and diagnose types A and B Niemann-Pick disease[J].Anal Biochem,2003,314(1):116-120. |
| [6] | 匡莹,仇峰,杨美华.枸杞果酒中赭曲霉毒素A液相质谱串联法测定[J].中国公共卫生,2012,28(11):1520-1522. |
| [7] | 郑玉建,吴军,夏荣香,等.染砷大鼠肝脏砷形态与甲基转移酶关系[J].中国公共卫生,2013,29(3):361-363. |
 2015, Vol. 31
2015, Vol. 31


