轮状病毒属于弧肠病毒科,为双股RNA病毒,由11个不连续的RNA节段组成,分别编码病毒蛋白VPl-4、VP6、VP7和非结构蛋白NPl-NP5,与轮状病毒抗原性有关的是VP6、VP7和VP4这3种结构蛋白。根据VP6抗原性的不同,将轮状病毒分为A~G 7个组。A组主要感染婴幼儿,B组主要感染成人,C组主要引起散发病例,D、E、F、G组主要感染各种动物。VP7和VP4是病毒的主要中和抗原,可诱导机体产生中和抗体,分别决定轮状病毒的G基因型和P基因型。迄今为止,利用逆转录-聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)和核苷酸序列分析等方法至少已鉴定出24个G基因型和33个P基因型[1]。为了解辽宁省A组轮状病毒的感染情况,为轮状病毒的预防控制提供科学依据,于2012年采集辽宁省沈阳、大连、丹东、阜新4个市门诊及住院疑似病毒性腹泻患者粪便标本135份,对其进行A组轮状病毒检测及G、P基因分型。结果报告如下。
1 材料与方法 1.1 标本采集在辽宁省沈阳、大连、丹东、阜新4个市共采集门诊及住院疑似病毒性腹泻患者的粪便标本135份。标本在2~4 ℃冷藏运输,-80 ℃条件下冷冻保存。
1.2 标本处理与核酸提取取约200 μL的粪便标本加到2.0 mL EP管中,加入磷酸盐缓冲生理盐水(phosphate buffered saline,PBS)标本处理液800 μL,用漩涡振荡器剧烈震荡3次,每次10 s,静止10 min,8 000 r/min离心5 min,吸取上清液保存在-80 ℃冰箱备用。病毒RNA提取按Rneasy Mini Kit 操作说明从粪便上清液中提取,提取纯化后的RNA保存在-80 ℃冰箱中备用。
1.3 A组轮状病毒酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测操作按A组轮状病毒ELISA检测试剂盒(ProSpectTM Rotavirus Kit)说明书进行。在试剂盒微孔滴定板中每孔加入100 μL便悬液上清,设置阳性、阴性对照;每孔加100 μL酶结合物,室温孵育60 min;用稀释的洗液洗板5次,每孔加入100 μL底物,室温孵育10 min,再加入100 μL终止液,在30 min内进行A450读数,临界值=阴性对照A450值+0.10,A450值大于临界值的样本判定为阳性结果。
1.4 试剂和引物A组轮状病毒ELISA检测试剂盒(ProSpectTM Rotavirus Kit)购自英国OXOID公司,一步法PCR试剂(OneStep RT-PCR kit)、RNA提取试剂盒(Rneasy mini kit)和PCR产物纯化试剂盒(QIAquick PCR Purification Kit)均购自德国QIAGEN公司。A组轮状病毒引物参考文献[2]合成。VP4基因特异性引物为:con3:5'-TGGCTTCGCCATTTTATAGACA-3',con2:5'-ATTTCGGACCATTTATAACC-3';产物大小为877bp。VP7基因测序引物为:9con1:5'-TAGCTCCTTTTAATGTATGG-3',9con2:5'-GTATAAAATACTTGCCACCA-3';产物大小为905bp[2]。引物合成由北京三博远志生物技术有限责任公司完成。
1.5 A组轮状病毒G/P分型以提取到的病毒RNA为模板,分别应用引物9con1/9con2和con3/con2进行RT-PCR扩增反应。VP7基因扩增反应条件为:45 ℃逆转录30 min,95 ℃预变性12 min,94 ℃变性1 min,45 ℃退火1 min,72 ℃延伸1 min,40个循环,72 ℃延伸5 min。VP4基因扩增反应条件为:45 ℃逆转录30 min,95 ℃预变性12 min,94 ℃变性1 min,50 ℃退火1 min,72 ℃延伸1 min,40个循环,72 ℃延伸5 min。扩增的特异性片段经1.5%琼脂糖凝胶电泳鉴定;阳性RT-PCR产物经回收纯化后送北京三博远志生物技术有限公司测序;测序结果在GenBank中进行Blastn碱基比对分析;以C组轮状病毒为外群(outgroup),采用Mega 3.1软件中的邻位相连法(Neighbor-joining)构建VP7基因遗传进化树,确信限度估计设为1000。
2 结 果 2.1 A组轮状病毒ELISA检测结果沈阳、大连、丹东、阜新4个市135份粪便标本中,A组轮状病毒阳性标本21份,其中沈阳18份,大连2份,丹东1份,阜新未检出。沈阳的18份阳性标本均来自<5岁的婴幼儿,而大连和丹东阳性标本均来自成人。
2.2 A组轮状病毒G/P分型结果(图 1)VP7基因扩增19份阳性,VP4基因扩增21份阳性,有2份标本VP4基因扩增阳性但VP7基因扩增阴性。VP7基因序列测序结果在GenBank中进行Blastn碱基比对显示,15株A组轮状病毒VP7基因与韩国序列号为JQ253571的G9型参考株碱基序列高度同源,同源性均高达99%。2株与序列号为GU985262的G3型参考株核苷酸碱基序列高度同源,1株与序列号为JF460817的G2型参考株核苷酸碱基序列高度同源,1株与序列号为GU985236的G1型参考株核苷酸碱基序列高度同源。VP4基因序列测序结果比对显示,其中20株与序列号为JN 849139.1、HM 007185.1、GQ 996785.1、JN706518.1、HM130990.1和JF790335.1的P[8]型基因核苷酸序列同源性为98%~99%,且毒株彼此之间核苷酸同源性较高,均达到99%以上。1株与序列号为KC443546.1的P[4]基因核苷酸同源性为99%。19株A组轮状病毒VP7基因碱基序列与参考株VP7基因序列共同构建VP7基因遗传进化树(图 1)。其中15株与G9型A组轮状病毒参考株共同构成VP7基因系统发生树的一个大分支。2株与G3型参考株、1株与G2型参考株、1株与序列号为G1型参考株各自独立的进化分支。
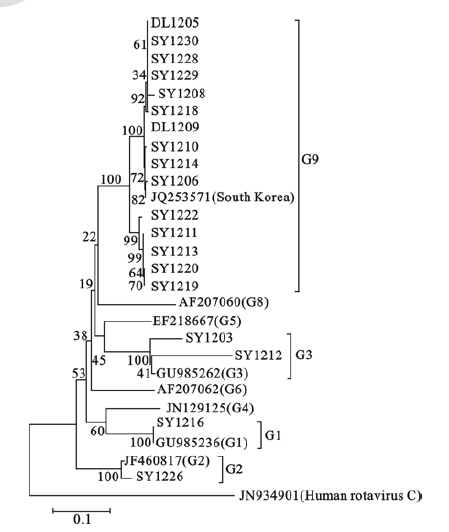 | 图 1 VP7基因核苷酸序列系统发生树分析 |
A组轮状病毒是引起婴幼儿腹泻的主要病原体。在全球范围内,每年约有61万名儿童死于A组轮状病毒引起的腹泻,<5岁儿童几乎均感染过A组轮状病毒[3]。70~80年代的有关资料显示世界各地A组轮状病毒的检测阳性率为11%~70%。国内部分地区90年代A组轮状病毒检出率40%~60%[4]。本研究中,A组轮状病毒阳性率为15.6%,较以往的报道阳性率较低,推测可能与标本的年龄分布有关,A组轮状病毒主要感染婴幼儿,而有一部分标本来自成人;也有可能是此次检测标本的例数较少。从发病年龄上看,本研究中辽宁省腹泻患者粪便标本中共检测出A组轮状病毒阳性标本21份,其中18份来自<5岁的患儿,符合A组轮状病毒主要感染婴幼儿的流行特征。
在A组轮状病毒中,最常见的G基因型是G1、G2、G3和G4。中国上世纪90年代A组轮状病毒感染以G1型为主,而到2001年G3型取代了G1型成为我国主要流行株[5,6]。自1987年美国费城首次报道G9型A组轮状病毒感染住院患儿,近年来,越来越多的报道显示G9型A组轮状病毒已逐渐成为一些国家和地区的优势流行基因型别,成为继G1~G4型之后全球第5个常见的优势流行基因型,G9型A组轮状病毒也因此被加入到全球轮状病毒流行株的监测工作中[7,8]。自1994年在国内报道第1例G9型A组轮状病毒感染以来,近年国内检出的G9型A组轮状病毒有增长趋势,检出的地区范围也在扩大,北京、昆明、兰州、长春、武汉等地区均已检测到G9型A组轮状病毒[8]。辽宁省2006—2007年腹泻患儿A组轮状病毒监测中,G3型为优势流行基因型,占44.8%,并未检测出G9型A组轮状病毒[2]。本次研究表明,在辽宁省沈阳和大连市首次检出了G9型A组轮状病毒,其中G9型在沈阳已成为优势流行基因型,处于绝对优势地位。大连、丹东和阜新市因标本多来自成人,A组轮状病毒检测阳性率较低,尽管如此,仍在大连的2份成人标本中检测到G9型A组轮状病毒。
目前在世界范围内常见的P基因型主要是P[8]型和P[4]型,本研究A组轮状病毒P分型结果主要以P[8]型为主共20株,P[4]型仅为1株,与辽宁省2006—2007年进行的腹泻患儿A组轮状病毒监测P基因分型结果基本一致[2]。本次研究结果显示,A组轮状病毒G基因型以G9型为主,P基因型以P[8]型为主,流行优势G/P基因型组合为G9P[8]15株,G3P[8]仅为2株。可以推测辽宁地区轮状病毒基因型可能正处于G3P[8]到G9P[8]的转变中,这种A组轮状病毒流行优势株随不同年份而发生改变也见于我国的其他地区[9]。
综上所述,辽宁省A组轮状病毒很可能处在由过去G3型占主导向现在G9型占主导的过渡转变阶段,而一个地区某种病毒基因型发生变化,往往容易引起暴发流行,因此今后需要进一步加强在全省范围内A组轮状病毒的监测和检测力度,及时作出预警,降低暴发流行风险。
| [1] | AbeM,Ito N,Masatani T,et al.Whole genome characterization of new bovine rotavirus G21P[29] and G24P[33] strains provides evidence for interspecies transmission[J].J Gen Virol,2011,92(4):952-960.. |
| [2] | 王作虪,韩悦,安淑一,等.辽宁省腹泻患儿中人轮状病毒和人星状病毒的检测[J].中国卫生检验杂志,2009,19(3):643-645. |
| [3] | Van Doorn LJ,Kleter B,Hoefnagel E,et al.Detection and genotyping of human rotavirus VP4 and VP7 genes by reverse transcriptase PCR and reverse hybridization [J].J Clin Microbiol,2009,47(9):2704-2712. |
| [4] | 曾玫,朱启,钱渊,等.上海地区儿童腹泻病轮状病毒感染的研究[J].中国实用儿科杂志,2004,19(4):217-218. |
| [5] | 廖虹瑜,张梦妍,陈喜凯,等.成都地区婴幼儿腹泻轮状病毒的基因分型研究[J].四川大学学报: 医学版,2011,42(4):511-514. |
| [6] | 王金文,刘彩霞,杨爱平,等.腹泻患儿A群轮状病毒G血清型和P基因型分析[J].中国公共卫生,2011,27(3):296-298. |
| [7] | Centers for Disease Control and Prevention(CDC).Rotavirus surveillance-worldwide,2001-2008[J].MMWR,2008,57(46):1255-1257. |
| [8] | 董慧谨,钱渊,张文,等.北京地区2007—2008 年G9 型A组人轮状病毒VP7和VP4基因分析[J].中华流行病学杂志,2009,30(11):1179-1183. |
| [9] | 李春英,雷霞,于琼,等.呼和浩特市婴幼儿腹泻轮状病毒基因亚型分析[J].中国公共卫生,2012,28(1):81-82. |
 2015, Vol. 31
2015, Vol. 31


