2. 云南省肿瘤医院昆明医科大学第三附属医院
糖尿病是目前国内外常见的疾病,糖尿病肾病(diabetic nephropathy,DN)是糖尿病最为严重的并发症之一,也是临床上糖尿病致残、致死的主要原因之一。近年来,不少学者在探索DN的病因和防治时,提出抗炎治疗措施。槲皮素(quercetin,Que)是一种天然的黄酮类化合物,因具有广泛的药理作用,愈来愈受到人们的重视,它是具有多靶点作用和综合治疗优势的中药单体。研究表明,槲皮素可以降低链脲佐菌素诱导的糖尿病大鼠肾脏肥大指数,保护DN肾功能[1]。本研究拟在细胞水平观察槲皮素对高糖诱导大鼠肾脏近端小管上皮细胞(proximal tubule epithelial cells,PTEC)肥大的影响,为槲皮素防治DN的临床应用提供理论依据。 1 材料与方法 1.1 实验动物
健康Wistar 大鼠(河南省实验动物中心),许可证号:SYXK(豫)2010-0011,清洁级,体重(250±20)g,30只。 1.2 主要试剂与仪器
纯度≥98%槲皮素、纯度≥99.5%D-(+)-葡萄糖(美国Sigma公司);1640 培养基、Ⅱ型胶原酶(美国Gibco 公司);胎牛血清(杭州四季青生物工程有限公司);3H-亮氨酸(中国科学院上海应用物理研究所);链霉亲和素-生物素复合物(streptavidin-biotin complex,SABC)小鼠IgG试剂盒及二氨基联苯胺显色试剂盒(武汉博士德公司);[γ-32P]ATP(北京福瑞生物工程公司核酸研究室);细胞间黏附分子1(intercellular cell adhesion molecule-1,ICAM-1)、白细胞介素1β(interleukin-1β,IL-1β)、甘露糖结合凝集素(mannose-binding lectin,MBL)、考马斯亮蓝蛋白测定试剂盒(南京建成生物工程研究所);单核细胞趋化蛋白-1(monocyte chemotactic protein 1,MCP-1)小鼠抗大鼠单克隆抗体(美国Santa Cruz公司);β-actin(北京博奥森生物公司)。紫外分光光度计(日本岛津公司);流式细胞仪(美国Becton-Dickinson 公司);全自动酶联免疫吸附仪(芬兰Thermo Labsytom公司),Power-pac200电泳仪(美国BIO-RAD公司),Trans-Blot电泳湿转仪(美国BIO-RAD公司),液体闪烁计数器(上海核所日环光电仪器有限公司)。 1.3 原代PTEC培养与鉴定
Wistar大鼠30只,麻醉后按照杜飞等[2]改良的Doucet手工微分离法分离大鼠肾脏单根近端小管,将全部分离的单根近端肾小管混入2 mL 1640培养瓶中,置于37 ℃、5%CO2的培养箱中原代培养,于第3天更换第1次培养液,7~8 d细胞基本铺满瓶底。采用免疫细胞化学法鉴定细胞。 1.4 分组与处理
待PTEC生长至基本铺满瓶底,将其消化并接种于96孔板,24 h后更换为无血清1640低糖培养液,培养24 h使细胞同步化,然后将细胞分为5组:对照组(1640培养基),高糖组(含30 mmol/L D-葡萄糖),槲皮素低、中、高剂量组(高糖+5、15、30 mg/L),每组设6个复孔,作用72 h后取样检测。 1.5 指标与方法 1.5.1 细胞体积测定
细胞经0.25%胰蛋白酶消化至多数细胞形态变成圆形后,加入少量培养液终止消化,并用磷酸盐缓冲液(phosphate buffered saline,PBS)清洗2次,上流式细胞仪检测,以前向角散射光(FSC)强度表示细胞体积。 1.5.2 3H-亮氨酸掺入量检测
加入不同浓度槲皮素培养48 h后,每孔加入3H-亮氨酸(2.5μCi),24 h后收集细胞,以1 mol/L NaOH 溶解细胞,再加入1 mol/L HCl 中和,加入5 mL 闪烁液,液闪仪检测,掺入量以cpm/105细胞表示。 1.5.3 细胞蛋白质含量测定
收集细胞后,弃培养液,PBS清洗2次,加入1 mol/L NaOH 待细胞完全溶解后,再加入1 mol/L HCl 中和。以考马斯亮蓝法测定蛋白含量,以μg/105细胞表示。 1.5.4 细胞钠钾ATP酶活性测定[2, 3]
钠钾ATP酶活性[μmol/(g·h)]=(X-B)/蛋白浓度×样本体积×孵育时间(h)×[γ-32P]ATP比活性。式中X为待测样本的液体闪烁计数值,B为空白对照管的液体闪烁计数值。 1.5.5 细胞培养基上清ICAM-1、IL-1β、MBL检测
取培养基中上清液,通过自动酶免分析仪测定ICAM-1、IL-1β、MBL水平,在550 nm光下读取吸光度(A)值,应用标准曲线计算含量。操作严格按照试剂盒说明书进行。 1.5.6 MCP-1蛋白表达
采用Western blot法测定,收集各组细胞,用苯甲基磺酰氟摄取蛋白质,测定总蛋白含量,10%聚丙烯酰氨凝胶电泳,转移至聚偏二氟乙烯膜上,封闭,加入一抗(1:1 000),4 ℃过夜,Tris 盐缓冲液加吐温-20洗膜3次,每次15 min。洗涤后二抗孵育(1:5 000),室温下摇动1 h,Tris-HCl缓冲液加吐温洗膜3次,每次15 min;电化学发光剂暗室曝光成像、拍照,IMAGE J软件计算积分光密度值(IOD)。 1.6 统计分析
实验数据以(x±s)表示,采用SPSS 13.0软件进行统计分析,多组间比较采用单因素方差分析、两两比较采用最小显著差t检验,P<0.05为差异有统计学意义。 2 结 果 2.1 槲皮素对高糖诱导PTEC细胞肥大、钠钾ATP酶活性影响(表 1)
与对照组比较,高糖组细胞体积增大,FSC明显右移,3H-亮氨酸掺入量和蛋白含量增加,钠钾ATP酶活性增加(P<0.05或P<0.01)。与高糖组比较,槲皮素15、30 mg/L组细胞体积减小,3H-亮氨酸掺入量与蛋白含量降低,钠钾ATP酶活性明显降低(P<0.05或P<0.01)。
| 表 1 槲皮素对高糖诱导PTEC细胞肥大、钠钾ATP酶活性影响(x±s,n=6) |
与对照组比较,高糖组细胞培养上清中ICAM-1、 IL-1β、MBL表达明显升高;与高糖组比较,槲皮素中、高剂量组PTEC培养上清中ICAM-1、 IL-1β、MBL水平明显降低(P<0.05或P<0.01)。
| 表 2 槲皮素对高糖诱导PTEC上清中炎症因子表达影响(x±s,n=6) |
与高糖组(0.68±0.03)比较,槲皮素 15、30 mg/L组PTEC的MCP-1蛋白表达[分别为(0.37±0.02)、(0.39±0.02)]明显降低(P<0.05或P<0.01),5 mg/L槲皮素组PTEC的MCP-1蛋白表达(0.58±0.02)无明显变化。
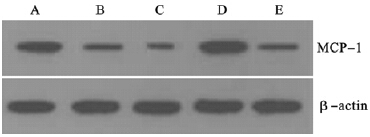 | 注:A、B、C:槲皮素5、15、30 mg/L组;D:高糖组;E:对照组。 图 1 槲皮素对高糖诱导PTEC的MCP-1蛋白表达影响 |
糖尿病肾病(DN)是糖尿病全身特发性微血管病变的肾脏表现。DN的早期代偿阶段表现为肾脏增生、肥大,且发现肾小管的病理改变在DN的发生、发展中有不容忽视的作用[4]。高糖培养细胞是目前体外复制糖尿病的一种重要手段[5, 6]。长期高糖环境导致肾固有细胞分泌多种炎症因子及促纤维化因子,进而使细胞肥大、增生,促进肾间质纤维化发生[7]。单核细胞浸润肾组织是DN发展的重要环节,合理调控MCP-1有助于减少炎症因子表达。MCP-1可促进ICAM-1、IL-1β、MBL等炎症介质释放,损伤血管内皮细胞[8]。本研究结果表明,槲皮素可以抑制MCP-1蛋白表达,降低细胞上清液ICAM-1、IL-1β、MBL等炎症介质释放。提示槲皮素对DN炎症发展具有明显的抑制作用。糖尿病时肾小管细胞生长异常与多个分子及信号通路、炎性反应和纤维化密切相关,导致早期肾脏增大,肾小管过度重吸收和肾小球高滤过,影响肾脏病变进程[4]。PTEC中钠与葡萄糖的转运过强,钠钾ATP酶活性及其亚单位表达明显升高,致使钠盐在此段过度重吸收是DN发病的关键[9, 10]。本研究结果显示,槲皮素可以抑制高糖诱导的PTEC钠钾ATP酶活性升高,提示其机制可能与抑制PTEC中MCP-1蛋白表达、降低炎症反应因子并稳定PTEC钠钾ATP酶活性有关,具体的途径还有待进一步研究。
| [1] | 王兴红,郑亚萍,魏芳.槲皮素对链脲佐菌素诱导糖尿病大鼠氧自由基和一氧化氮的影响[J].中国实验方剂学杂志,2013,19(5):244-247. |
| [2] | 杜飞,高原,王兴红,等.灯盏花素治疗糖尿病大鼠血清对近端小管上皮细胞氧化应激的影响[J].中国中西医结合肾病杂志,2008,9(2):168-169. |
| [3] | 余德芊,高原,刘晓红.大黄酸对高糖和血管紧张素Ⅱ诱导的大鼠近端肾小管上皮细胞大的影响[J].中药材,2010,33(4):570-574. |
| [4] | Kanwar YS,Sun L,Xie P,et al.A glimpse of various pathogenetic mechanisms of diabetic nephropathy[J].Annu Rev Pathol,2011,6:395-423. |
| [5] | Meek RL,Leboeuf RC,Saha SA,et al.Glomerular cell death and inflammation with high-protein diet and diabetes[J].Nephrol Dial Transplant,2013,28(7):1711-1720. |
| [6] | Tahara A,Tsukada J,Tomura Y,et al.Effects of high glucose on AVP-induced hyperplasia,hypertrophy,and type Ⅳ collagen synthesis in cultured rat mesangial cells[J].Endocr Res,2012,37(4):216-227. |
| [7] | Luis-Rodríguez D,Martínez-Castelao A,José Luis Górriz JL,et al.Pathophysiological role and therapeutic implications of inflammation in diabetic nephropathy[J].World J Diabetes,2012,3(1):7-18. |
| [8] | 车光昇,苏丹,李屹,等.菊苣多糖对链尿菌素大鼠糖尿病肾病保护作用[J].中国公共卫生,2011,27(3):340. |
| [9] | 刘文艳,刘晓舒,马越娇,等.复方中药组分对糖尿病大鼠肾脏保护作用[J].中国公共卫生,2013,29(12):1788-1789. |
| [10] | Nakhoul N,Batuman V.Role of proximal tubules in the pathogenesis of kidney disease[J].Contrib Nephrol,2011,169:37-50. |
 2015, Vol. 31
2015, Vol. 31
