阿尔茨海默病(Alzheimer′s disease,AD)是一种以神经纤维缠结与老年斑的出现为主要表现的神经系统退行性疾病[1]。而氧化应激与雌激素缺乏是AD发生的2个危险因素。研究发现,在去卵巢合并D-半乳糖注射大鼠的脑海马区,神经元数量减少,结构明显被破坏[2]。D-半乳糖联合双侧卵巢切除的大鼠,可作为AD的啮齿类动物模型[3]。β-淀粉样前体蛋白(β-amyloid precursor protein,β-APP)经β-分泌酶和γ-分泌酶切割后会产生不溶性的小片段,正常情况下,产生与清除二者平衡,一旦平衡被打破,Aβ 小肽寡聚化并沉积,导致一系列细胞和分子的变化继而引起神经元凋亡与神经机能障碍[4]。因AD没有特效治疗方法,利用植物化学物进行有效防治成为近年来的研究热点[5, 6]。白藜芦醇(resvertrol,Res)结构中含有多个酚羟基[7],具有强抗氧化作用,并且其化学结构与雌二醇相似,可以通过血脑屏障[8]。本文旨在观察白藜芦醇对AD大鼠空间记忆及海马组织中β-APP的表达影响,结果报告如下。 1 材料与方法 1.1 主要仪器与试剂
Morris水迷宫仪及分析软件(中国医学科学院药物研究所);白藜芦醇粉剂(西安和霖生物工程有限公司),Cat No.HL0216,纯度≥98%;D-半乳糖(美国Amreso公司),Cat No.0637;戊酸雌二醇片(法国DELPHARM Lille SAS公司)Cat No.250A;兔抗鼠β-APP多克隆抗体(英国Abcam公司),Cat No.ab15272,1:1 000。 1.2 实验动物
60只SPF级6月龄Wistar雌性大鼠,体重(220±20)g,由山西医科大学提供,许可证号:SCXK(晋)2009-0001,室温(25±2)℃,湿度(60±2)%,自然昼夜节律光照。 1.3 动物分组与模型建立
60只大鼠适应性喂养1周后,按体重随机分为模型组、白藜芦醇低、中、高剂量组、戊酸雌二醇组及假手术组,每组10只。模型组、白藜芦醇低、中、高剂量组及戊酸雌二醇组施双侧卵巢摘除术,术后恢复1周后,每天给予腹部D-半乳糖(100 mg/kg)注射,白藜芦醇低、中、高剂量组大鼠分别以20、40、80 mg/kg 白藜芦醇粉剂混悬液灌胃,戊酸雌二醇组灌胃0.8 mg/kg戊酸雌二醇混悬液,模型组与假手术组灌胃等量蒸馏水,持续12周。实验期间,大鼠自由摄食、饮水,每周称1次体重并调整灌胃量与注射量。 1.4 指标与方法 1.4.1 大鼠学习记忆能力测定
采用Morris水迷宫法,(1)定位航行实验:历时5 d,每天训练4次。训练开始时,将平台置于第2象限,将大鼠从池壁4个起始点(分别位于4个象限)的任一点面向池壁放入水池,录像记录大鼠找到平台时间(逃避潜伏期)和游泳路径,大鼠找到平台后或90 s内找不到平台(潜伏期记为90 s),则由实验者将其拿上平台,在平台上学习10 s后再进行下一次实验。以大鼠4次训练潜伏期的平均值作为大鼠当日的学习成绩。(2)空间探索实验:第6天撤除平台,将大鼠从第4象限入水点放入水中,所有大鼠为同一入水点,记录大鼠在1 min内穿越原平台的次数。 1.4.2 大鼠脑海马β-APP蛋白测定
采用Western blot法,Morris水迷宫实验结束后,处死大鼠,取各组大鼠新鲜脑海马组织,常规提取蛋白,用10%分离胶,4%浓缩胶,10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离蛋白样品,室温转膜60 min,5%脱脂奶粉封闭;加入1∶1 000稀释兔抗鼠β-APP多克隆抗体,4 ℃孵育过夜;二抗室温孵育3 h,电化学发光显色曝光,照像,以Actin作为内对照。胶片扫描后,用LabWorks软件分析各条带平均灰度值。 1.5 统计分析
数据以x±s表示,采用SPSS 13.0软件对数据进行统计分析,水迷宫数据采用两因素重复测量方差分析,Western blot结果进行单因素方差分析,组间两两比较用最小显著差法法,检验水准α=0.05。 2 结 果 2.1 白藜芦醇对AD大鼠空间记忆能力影响 2.1.1 定位航行实验(表 1)
各组大鼠逃避潜伏期随着训练天数的增加而缩短,且各组潜伏期差异有统计学意义(F=6.55,P<0.05);与假手术对照组比较,模型组大鼠逃避潜伏期在第1、5 d明显增加(P<0.05);在第1 d、第2 d和第5 d时,与模型组比较,白藜芦醇80 mg/kg组与戊酸雌二醇组大鼠逃避潜伏期明显缩短(P<0.05)。
| 表 1 白藜芦醇对各组大鼠逃避潜伏期影响(x±s,n=10) |
与假手术组比较,模型组大鼠在目标象限内停留时间明显缩短、穿越平台次数明显减少(P<0.05),与模型组比较,白藜芦醇各剂量组、戊酸雌二醇组大鼠在目标象限内停留时间明显延长、穿越平台次数明显增加(P<0.05)。
| 表 2 白藜芦醇对各组大鼠在目标象限停留时间与 穿越平台次数影响(x±s,n=10) |
蛋白印记分析结果显示,假手术组、模型组、白藜芦醇20、40、80 mg/kg组、戊酸雌二醇组大鼠海马组织中β-APP 相对表达水平分别为(0.39±0.023)、(0.82±0.078)、(0.57±0.054)、(0.38±0.055)、(0.28±0.043)、(0.27±0.057);与假手术组比较,模型组大鼠海马组织β-APP表达水平升高(P<0.05),与模型组比较,白藜芦醇20、40、80 mg/kg组、戊酸雌二醇组大鼠海马组织中β-APP 表达量明显下降(P<0.05)。
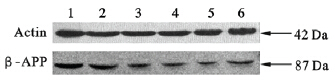 | 注:1:模型组;2~4:白藜芦醇低、中、高剂量组;5:戊酸雌二醇组;6:假手术组。 图 1 白藜芦醇对各组大鼠海马组织中β-APP蛋白表达影响 |
白藜芦醇是一种植物性多酚,在抗癌、预防心血管病方面均有明显作用[9],氧化应激与雌激素缺乏是AD发生的2个重要因素,白藜芦醇除具有抗氧化功能外,还可以通过与雌激素受体结合,激活雌激素应答基因转录,提高机体免疫、延缓机体衰老[10]。白藜芦醇还可避免雌激素替代疗法引起的子宫内膜癌等严重副作用[11]。本研究结果显示,白藜芦醇80 mg/kg及戊酸雌二醇对AD大鼠海马β-APP的表达与大鼠学习记忆功能均有明显改善,提示白藜芦醇有类雌激素样作用。
AD发病机制有多种学说,如胆碱能损伤学说, 炎症反应学说及氧化应激学说等[12]。在氧化应激 学说中,Aβ可促进氧自由基引发的脂质过氧化反应,形成脂褐质并沉积于细胞中,从而引发AD[13]。β-APP是Aβ的前体蛋白,经过酶的切割后产生不溶性片段Aβ,进而参与AD的发生过程。在β-APP形成Aβ的过程中,各种分泌酶的参与必不可少。β-APP在α-分泌酶和γ-分泌酶作用下完成非淀粉样途径;在β-分泌酶和γ-分泌酶参与下完成淀粉样途径,产生不溶性片段Aβ[4]。因此,推测白藜芦醇对AD大鼠学习记忆能力的改善作用可能与其降低海马β-APP蛋白表达有关。
| [1] | 刘甜甜, 赵海峰.植物化学物对阿尔茨海默病保护作用研究进展[J].中国公共卫生, 2013,29(5):772-775. |
| [2] | Zhao H,Niu Q,Li X,et al.Long-term resveratrol consumption protects ovariectomized rats chronically treated with D-galactose from developing memory decline without effects on the uterus [J].Brain Res,2012,1467:67-80. |
| [3] | Hua X,Lei M,Zhang Y,et al.Long-term D-galactose injection combined with ovariectomy serves as a new rodent model for Alzheimer's disease[J].Life Sci,2007,80:1897-1905. |
| [4] | 崔理立.针对阿尔茨海默病中Aβ42靶点的天然药物及其分子机制的研究[D].长春:吉林大学博士学位论文, 2012. |
| [5] | Villaflores OB,Chen YJ,Chen CP,et al.Curcuminoids and resveratrol as anti-Alzheimer agents [J].Taiwan J Obstet Gynecol,2012,51(4):515-525. |
| [6] | Jayasena T,Poljak A,Smythe G,et al.The role of polyphenols in the modulation of sirtuins and other pathways involved in Alzheimer' s disease [J].Ageing Res Rev, 2013,12(4):867-883. |
| [7] | Li Z,Pang L,Fang F,et al.Resveratrol attenuates brain damage in a rat model of focal cerebral ischemia via up-regulation of hippocampal Bcl-2 [J].Brain Res,2012,1450:116-124. |
| [8] | 彭晓琳.白藜芦醇数据库建立、深圳居民摄入量评估及生物效应、代谢学研究[D].武汉:华中科技大学博士学位论文,2011. |
| [9] | Signorelli P,Ghidoni R.Resveratrol as an anticancer nutrient:molecular basis,open questions and promises [J].J Nutr Biochem,2005,16:449-466. |
| [10] | 季华,吴玉珍,季强.白藜芦醇的生理功能及其应用前景[J].中国现代医学杂志,2011,21(14):1625-1629. |
| [11] | 张文众,李宁,李蓉.白藜芦醇的雌激素作用研究[J].中国食品卫生杂志,2008,20(3):214-216. |
| [12] | 付剑亮,邵福源.阿尔茨海默病发病机制研究进展[J].世界临床药物,2010,31(7):390-394. |
| [13] | 刘晓杰,杨威,祁金顺.氧化应激与阿尔茨海默病[J].生理学报,2012,64(1):87-95. |
 2015, Vol. 31
2015, Vol. 31


