2. 桂林医学院基础医学院研究所;
3. 桂林医学院基础医学院生理学教研室;
4. 桂林医学院基础医学院病理生理学教研室
膀胱癌是泌尿系统中最常见的恶性肿瘤之一,好发于40~60岁,发病率男性较女性高3倍,患者死亡率高。与膀胱癌有关的因素可能为吸烟、放射、化学毒物、药物。同时,生长因子、细胞因子以及激素等生物活性物质以及这些活性物质介导的信号转导途径发生异常,可引起某些基因的过度扩增,导致正常细胞接受了异常的增殖、分化和生长信号,最终促使细胞发生癌变[1, 2]。植物来源的芒柄花黄素,分离自红三叶草,为一种生物活性异黄酮,具有明显的生物功能和抗肿瘤作用[3]。本研究通过观察不同浓度芒柄花黄素作用于膀胱癌T-24和BIU-87细胞株后细胞增殖、凋亡变化,T-24细胞p38及Bcl-2蛋白表达水平变化,探讨芒柄花黄素对膀胱癌细胞增殖和凋亡的影响及可能机制,结果报告如下。 1 材料与方法 1.1 主要试剂
膀胱癌T-24与BIU-87细胞株(上海细胞生物研究所),芒柄花黄素(>98.0%)、荧光染料Hoechst 33258和噻唑蓝(thiazolyl blue tetrazolium bromide,MTT)(美国Sigma公司),V-FITC凋亡检测试剂盒(上海碧云天研究所),1640培养基、胎牛血清(美国HyClone公司),p-p38及Bcl-2兔抗人多克隆抗体(美国SantaCruz公司)。 1.2 细胞培养
使用含10%胎牛血清和1%青霉素/链霉素的1640培养基,将膀胱癌T-24与BIU-87 细胞在含5%CO2的37 ℃培养箱中常规培养传代。 1.3 指标与方法 1.3.1 T-24和BIU-87细胞增殖活性检测
采用MTT法,收集对数生长期细胞,调整细胞悬液浓度,按5×103个/孔密度接种于96孔板中,每孔加入100 μL细胞悬液;待细胞贴壁后分别加入含芒柄花黄素的完全培养基,每孔100 μL,使芒柄花黄素终浓度分别为20、40、80 μmol/L,另设对照组(加入等体积的完全培养基),每组设3个副孔;分别培养24、48、72 h后弃上清,每孔加入20 μL MTT溶液(5 mg/mL),37 ℃孵育4 h,弃培养液,每孔加入 150 μL二甲基亚砜,置摇床上低速振荡10 min,用酶标仪测定490 nm处吸光度(A)值,实验独立重复3次。 1.3.2 T-24与BIU-87凋亡率检测
采用流式细胞术,收集消化后细胞,调整细胞浓度,以1×106个/孔接种到6孔板中;待细胞贴壁后,加入含芒柄花黄素(20、40、80 μmol/L)的完全培养基,对照组(加入同体积完全培养基),每组设3个副孔,继续培养48 h后,收集细胞,用预冷的磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤3次,annexin V-FITC及碘化丙啶(50 μg/mL)室温避光染色15 min,用流式细胞仪检测细胞凋亡率。 1.3.3 T-24细胞凋亡形态学观察
采用Hoechst染色法,接种对数生长期细胞至6孔板,12 h贴壁后,每孔加入不同浓度芒柄花黄素的完全培养基,使终浓度为20、40、80 μmol/L,对照组加入完全培养基,继续孵育48 h后,吸尽培养液,先后加入固定液和Hoechst 33258染色液;荧光显微镜检测,激发波长350 nm,观察细胞核变化。 1.3.4 T-24细胞Bcl-2 mRNA表达检测
采用逆转录聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR),20、40、80 μmol/L芒柄花黄素处理T-24细胞48 h,用trizol提取T-24细胞总RNA,采用紫外分光光度计测总RNA纯度和含量,将总RNA逆转录为cDNA,加入目的基因引物进行扩增,扩增产物经1.0%琼脂糖凝胶电泳,凝胶分析系统记录分析;以β-actin为内参照,计算Bcl-2相对表达量。 1.3.5 T-24细胞p38及Bcl-2蛋白表达检测
采用Western blot法,20、40、80 μmol/L芒柄花黄素处理T-24细胞48 h后,裂解细胞,提取总蛋白,考马斯亮兰法检测样品蛋白浓度;以3:1体积比与上样缓冲液混合,取20 μL上样;浓缩胶电泳电压为80 V,分离胶为130 V,电泳4 h后用聚偏二氟乙烯膜半干转,转膜1.5 h,然后聚偏二氟乙烯膜用含5%脱脂奶粉的PBS封闭1 h,然后加入p-38抗体(抗体稀释度1:500)或Bcl-2抗体(抗体稀释度1:500)4 ℃过夜,Tris缓冲盐溶液洗膜10 min×3次,辣根过氧化物酶标记山羊抗兔IgG(稀释度1:5 000)室温反应1 h,超敏化学发光法显色,凝胶分析系统分析记录条带光密度,用图像分析系统分析,以相应蛋白条带的积分光密度值表示检测蛋白相对强度。 1.4 统计分析
数据以x±s表示,采用SPSS 19.0软件进行统计分析,各组间比较采用单因素方差分析与Dunnet-t检验,P<0.05为差异有统计学意义。 2 结 果 2.1 芒柄花黄素对T-24与BIU-87细胞增殖能力影响(表 1)
与对照组比较,芒柄花黄素处理组(20~80 μmol/L)T-24细胞与BIU-87细胞数目显著减少,细胞增殖能力受到明显抑制(P<0.05),其抑制作用呈剂量依赖性。
| 表 1 芒柄花黄素对T-24与BIU-87细胞增殖能力影响(A,x±s,n=3) |
结果显示,对照组T-24细胞较少出现细胞核裂解或细胞皱缩,而芒柄花黄素处理的T-24细胞中可见细胞核碎裂和细胞皱缩;与对照组比较,各剂量芒柄花黄素处理的T-24与BIU-87细胞凋亡率均明显升高,差异均有统计学意义(P<0.01)。
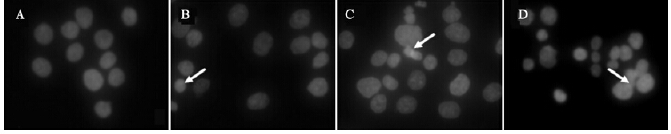 | 注:A:对照组;B、C、D:20、40、80 μmol/L芒柄花黄素组。 图 1 芒柄花黄素对T-24细胞凋亡影响(Hoechst染色,×200) |
| 表 2 芒柄花黄素对T-24与BIU-87细胞凋亡率影响(%,x±s,n=3) |
RT-PCR检测结果表明,经不同浓度芒柄花黄素(0、20、40、80 μmol/L)处理T-24细胞48小时后,T-24 细胞Bcl-2 mRNA表达水平分别为(0.873±0.031)、(0.856±0.048)、(0.701± 0.029)、(0.408±0.036);与对照组比较,40、80 μmol/L芒柄花黄素组T-24细胞Bcl-2 mRNA表达水平降低,差异均有统计学意义(P<0.01)。 2.4 芒柄花黄素对T-24细胞Bcl-2、p-38表达影响(图 2)
Western blot结果表明,对照组、20、40、80 μmol/L芒柄花黄素组T-24细胞Bcl-2与p-p38蛋白表达水平分别为(1.203±0.023)、(0.998±0.034)、(0.591±0.030)、(0.426±0.027)和(0.326±0.027)、(0.483±0.026)、(0.569±0.031)、(0.935±0.037),与对照组比较,各芒柄花黄素组T-24细胞Bcl-2蛋白表达水平下降,p-p38蛋白表达水平升高,差异均有统计学意义(P<0.01)。
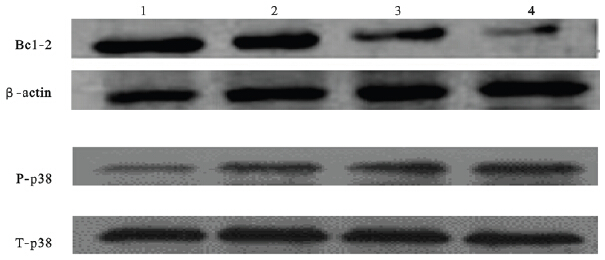 | 注:1:对照组;2~4:20、40、80 μmol/L芒柄花黄素组。 图 2 芒柄花黄素对T-24细胞Bcl-2、p-p38蛋白表达影响 |
抗凋亡是肿瘤细胞发生机制的重要环节[4]。在癌变过程中,癌细胞失控生长会逐渐形成恶性癌,并进一步侵入附近组织[5]。目前,临床应用的化疗方法疗效有限,且对体内主要器官可产生毒性[6, 7]。近年来,人们致力于寻求抑制肿瘤发生和转移的新天然药物[8]。芒柄花黄素是中药红三叶草的主要活性成分。研究表明,芒柄花黄素可以防止血管生成和癌转移,并在临床中已用于转移性结肠癌的治疗[9]。 MTT是一种比色分析,可反映细胞增殖能力[10],还可用于评估药物的细胞生长抑制效应[11]。本研究结果显示,芒柄花黄素作用72 h,明显著抑制膀胱癌T-24与BIU-87细胞增殖能力,并可促进T-24 细胞凋亡。B细胞淋巴瘤2(B cell lymphana 2,Bcl-2)是最重要的细胞凋亡调节蛋白之一,它具有 很强的抗凋亡特性[12]。Bcl-2蛋白与各种癌变,包括慢性淋巴细胞性白血病、乳腺癌、肺癌和前列腺癌有关[13]。本研究结果表明,经芒柄花黄素处理后,T-24细胞Bcl-2 mRNA水平与Bcl-2蛋白表达呈剂量依赖性下降,提示芒柄花黄素可能通过下调Bcl-2蛋白表达而诱导T-24细胞凋亡。
丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)是一组可被多种信号激活的丝/苏氨酸激酶,在细胞内经双重磷酸化活化后可调节细胞的多种生物活性,如促进增殖分化、诱导基因转录、抑制凋亡、调节周期等。MAPK信号转导通路非常保守,在细胞信号转导通路中,MAPK 处于细胞质部分的终末位置,活化后可以转到核内,调节基因表达。迄今为止,已发现 p38、ERK5、ERK 以及JNK4个亚族[14, 15, 16]。目前认为,p38激酶通路在炎症反应、细胞生长、细胞分化和细胞死亡诸多过程中起关键作用[17, 18],p38蛋白激酶的活化,有助于抑制细胞增殖和癌变[19]。本研究结果显示,经芒柄花黄素处理后,T-24细胞p38蛋白激酶表达呈剂量依赖性增高,提示,诱导p38蛋白激酶表达可能是芒柄花黄素诱导T-24细胞凋亡的主要机制之一。
| [1] | Umar A,Dunn BK,Greenwald P.Future directions in cancer prevention[J].Nat Rev Cancer,2012,12(12):835-848. |
| [2] | Shao H,Huang Q,Liu ZJ.Targeting Notch signaling for cancer therapeutic intervention[J].Adv Pharmacol,2012,65:191-234. |
| [3] | Yu J,Zhao P,Niu J,et al.Research on phytoestrogenic effect of formononetin[J].Zhongguo Zhong Yao Za Zhi,2010,35(22):3060-3064. |
| [4] | Sikora E,Bielak-Zmijewska A,Magalska A,et al.Curcumin induces caspase-3-dependent apoptotic pathway but inhibits DNA fragmentation factor 40/caspase-activated DNase endonuclease in human Jurkat cells[J].Mol Cancer Ther,2006,5(4):927-934. |
| [5] | Friedl P,Alexander S.Cancer invasion and the microenvironment:plasticity and reciprocity[J].Cell,2011,147:992-1009. |
| [6] | Peters BG.An overview of chemotherapy toxicities[J].Top Hosp Pharm Manag,1994,14:59-88. |
| [7] | Torrisi JM,Schwartz LH,Gollub MJ,et al.CT findings of chemotherapy-induced toxicity:what radiologists need to know about the clinical and radiologic manifestations of chemotherapy toxicity[J].Radiology,2011,258:41-56. |
| [8] | El-Bayoumy K,Sinha R.Mechanisms of mammary cancer chemoprevention by organoselenium compounds[J].Mutat Res,2004,551(1-2):181. |
| [9] | Auyeung KK,Law PC,Ko JK.Novel anti-angiogenic effects of formononetin in human colon cancer cells and tumor xenograft[J].Oncol Rep,2012,28:2188-2194. |
| [10] | Berridge MV,Herst PM,Tan AS.Tetrazolium dyes as tools in cell biology:new insights into their cellular reduction[J].Biotechnol Annu Rev,2005,11:127-152. |
| [11] | Van Meerloo J,Kaspers GJ,Cloos J.Cell sensitivity assays:the MTT assay[J].Methods Mol Biol,2011,731:237-245. |
| [12] | Luo S,Rubinsztein DC.Apoptosis blocks beclin 1-dependent autophagosome synthesis:an effect rescued by Bcl-xL[J].Cell Death Differ,2010,17:268-277. |
| [13] | Kang MH,Reynolds CP.Bcl-2 inhibitors:targeting mitochondrial apoptotic pathways in cancer therapy[J].Clin Cancer Res,2009,15:1126-1132. |
| [14] | Oeztuerk-Winder F,Ventura JJ.The many faces of p38 mitogen-activated protein kinase in progenitor/stem cell differentiation[J].Biochem J,2012,445(1):1-10. |
| [15] | De Luca A,Maiello MR,D'Alessio A,et al.The RAS/RAF/MEK/ERK and the PI3K/AKT signalling pathways:role in cancer pathogenesis and implications for therapeutic approaches[J].Expert Opin Ther Targets,2012,16 Suppl 2:S17-27. |
| [16] | del Barco Barrantes I,Nebreda AR.Roles of p38 MAPKs in invasion and metastasis[J].Biochem Soc Trans,2012,40(1):79-84. |
| [17] | 穆润清, 贺安宁, 王丽, 等.MAPK 和MPF 对小鼠受精卵有丝分裂期作用[J].中国公共卫生,2006, 22(5):594-595. |
| [18] | 杨学森, 龚茜芬, 张广斌, 等.电磁辐射对大鼠海马MAPK 信号通路的影响[J].中国公共卫生,2005,21(6):693-695. |
| [19] | Wagner EF,Nebreda AR.Signal integration by JNK and p38 MAPK pathways in cancer development[J].Nat Rev Cancer,2009,9:537-549. |
 2015, Vol. 31
2015, Vol. 31


