2. 沈阳军区总医院急诊医学部, 辽宁省重症创伤和器官保护重点实验室
环磷酰胺(cyclophosphamide,CP)作为抗肿瘤药物具有很强的心脏毒副作用,严重影响化疗的正常进行[1, 2, 3]。一些具有抗氧化作用的天然植物成分如藏红花素等[4]则对环磷酰胺引起的毒副作用具有一定保护作用。蓝莓(blueberry)属杜鹃花科(erieaceae)越橘属(Vaccinium,spp)多年生落叶或常绿灌木,含有丰富的花色苷(blueberry anthocyanins,BA),具有抗氧化、抗炎、提高免疫力、延缓衰老、抗癌、保护心血管等多种生理功能[5, 6, 7]。本研究旨在通过观察蓝莓花色苷对环磷酰胺所致大鼠心脏毒性的保护作用及机制,为开发抗环磷酰胺毒副作用的功能食品提供理论依据。 1 材料与方法 1.1 主要试剂与仪器
蓝莓花色苷(沈阳农业大学食品工程实验室制备),色价为54.10,水分含量为0.01%;注射用环磷酰胺粉针剂(江苏恒瑞制药有限公司);超氧化物歧化酶(superoxidase dismutase,SOD)、丙二醛(malondialdehyde,MDA)试剂盒(南京建成生物研究所);Bcl-2鼠单抗(1∶100)、Bax鼠单抗(1∶200)(美国sigma 公司)。Experion全自动电泳系统与GelDoc XR凝胶成像系统(美国BIO-RAD公司)。 1.2 实验动物
SPF级雄性SD大鼠60只,体重(180±20)g,购自上海西普尔-必凯实验动物有限公司,动物生产许可证号:SCXK(沪)2008-0016,大鼠引入后观察及适应7 d,动物饲养于悬吊式不锈钢饲养笼内,温度(20±2)℃,湿度(50±20)%,照明为12 h明暗交替,噪音60 dB以下;动物饲料为全营养饲料,经60 ℃灭菌。饮水经HT-R0500型净水系统制备,动物可自由摄食饮水。 1.3 分组与处理
将动物随机分成4组,每组15只,分别为对照组、环磷酰胺组、低、高剂量蓝莓花色苷组(分别灌胃给予20、80 mg/kg蓝莓花色苷),对照组和环磷酰胺组灌胃等量生理盐水,连续14 d,在第8天,环磷酰胺组与蓝莓花色苷组大鼠一次性腹腔注射100 mg/kg环磷酰胺;第15天,大鼠禁食12 h,巴比妥钠麻醉,腹腔静脉采血,3 000 g离心15 min分离血清;摘取心脏,取1/2 心脏,用预冷的生理盐水洗净残血,用液氮预冷后放置-80 ℃冰箱保存。其余心脏用10%中性福尔马林缓冲液固定,脱水、取材及包埋,制成切片,常规苏木素-伊红(hematoxylin-eosin staining,HE)染色,用于组织病理学评价。 1.4 指标与方法 1.4.1 血清心肌酶谱检测
采用日立-7180型自动生化分析仪测定(天门冬氨酸氨基转换酶(aspartate aminotransferase,AST)、肌酸激酶(creatine kinase,CK)、肌酸激酶同工酶(creatine kinase isoenzyme,CK-MB),乳酸脱氢酶(lactate dehydrogenase,LDH)活性。 1.4.2 心肌组织生化指标测定
心肌组织中MDA含量、SOD活性测定严格按照试剂盒说明书操作,蛋白质定量用考马斯亮蓝法。 1.4.3 心肌细胞中Bcl-2、Bax蛋白表达测定
采用Western blotting蛋白印迹法,提取对数生长期细胞蛋白,每孔加入20 μL,经聚丙烯酰氨凝胶电泳后,转膜2 h,将转膜后的硝酸纤维素膜置入缓冲液中漂洗后,把膜放入稀释的一抗中(Bcl-2鼠单抗1∶100、Bax鼠单抗1∶200),温和震荡3 h后置于4 ℃冰箱中过夜。回收一抗洗膜30 min,把膜置入相应稀释的二抗中。取电化学发光试剂A和试剂B各0.5 mL,混合后覆盖硝酸纤维素膜上,在暗室内同时放入X光胶片并作为方向标记,用底片扫描仪扫描X光,通过凝胶成像系统读取目的电泳带的密度扫描值,应用Quantity One 软件定量分析目的条带与Actin的灰度值并计算比值。 1.5 统计分析
计量资料以x±s表示,采用SPSS 18.0软件进行统计分析,多组间比较采用单因素方差分析,分析前行方差齐性检验,方差齐时用最小显著差法,方差不齐时用Tambane′s(q检验);不同组间组织病变发生率采用Fisher’s 确切概论法,P<0.05为差异有统计学意义。 2 结 果 2.1 蓝莓花色苷对大鼠心肌酶谱影响(表 1)
与对照组比较,环磷酰胺组大鼠心肌LDH、AST、CK与CK-MB活性均明显升高(P<0.05);与环磷酰胺组比较,蓝莓花色苷组大鼠LDH、CK与CK-MB活性下降,呈剂量-效应关系(P<0.05),蓝莓花色苷80 mg/kg组AST活性明显下降(P<0.05)。
| 表 1 蓝莓花色苷对大鼠心肌酶谱影响(U/L,x±s,n=15) |
与对照组比较,环磷酰胺组大鼠心肌SOD 活性显著降低,MDA含量明显升高(P<0.05);与环磷酰胺组比较,蓝莓花色苷20、80 mg/kg组大鼠心肌SOD活性升高,蓝莓花色苷80 mg/kg组大鼠心肌MDA 含量降低(均P<0.05)。
| 表 2 蓝莓花色苷对大鼠心肌SOD活性与MDA含量影响(x±s,n=15) |
心肌病理切片显示,对照组大鼠未见心脏损伤(图 1A);环磷酰胺组大鼠可见心肌细胞肥大,变性坏死、炎症细胞浸润,甚至出现心肌纤维断裂(图 1B);蓝莓花色苷20 mg/kg组大鼠心肌细胞肥大、变性坏死及炎症细胞浸润有所减轻(图 1C);蓝莓花色苷80 mg/kg 组大鼠心肌细胞损伤明显改善,未见炎症细胞浸润及心肌纤维断裂等病理改变(图 1D)。
 | 注:A:对照组;B:环磷酰胺组;C、D:蓝莓花色苷 20、80 mg/kg组。 图 1 蓝莓花色苷对大鼠心肌病理结构影响(HE,×200) |
与对照组比较,环磷酰胺组大鼠心肌Bcl-2和Bax蛋白表达轻度降低;蓝莓花色苷80 mg/kg组大鼠心肌Bcl-2表达水平明显降低,而Bax蛋白表达变化不明显,Bax/Bcl-2比值明显升高。
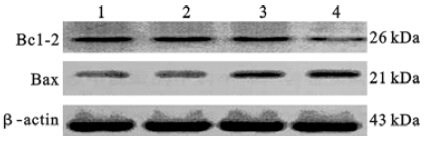 | 注:1:对照组; 2:环磷酰胺组; 3、4:蓝莓花色苷20、80 mg/kg组4 图 2 蓝莓花色苷对大鼠心肌组织凋亡相关蛋白表达影响 |
环磷酰胺是常用的氮芥类抗肿瘤药物,其在肝脏内被转化为具有细胞毒性的代谢产物丙烯醛,丙烯醛可破坏组织抗氧化能力,对心脏、骨髓、肾脏,肝脏、神经系统和黏膜上皮等均有较强毒性。研究表明,环磷酰胺可导致急性、剂量依赖性心肌损伤,进一步发展为坏疽,出血,甚至纤维化,其心脏毒性作用强度与用药剂量相关[1, 2, 3]。本研究结果表明,环磷酰胺组大鼠心肌细胞出现肥大,变性坏死、心肌纤维断裂等严重病变,大鼠血清LDH、AST、CK与CK-MB活性均显著升高;与环磷酰胺组比较,蓝莓花色苷组大鼠心肌病理损伤减轻、血清酶学指标均有所改善,表明蓝莓花色苷对环磷酰胺导致的心脏损伤具有一定保护作用。
尽管环磷酰胺心脏毒性机制尚不完全清楚,但许多研究表明,主要与自由基的生成增加及抗氧化能力降低所致的氧化应激有关[8]。氧化应激过程中可产生活性氧(reactive oxygen species,ROS),ROS 首要作用靶位是细胞膜中的脂质,可使生物膜不饱和脂肪酸氧化形成脂质过氧化物,并进一步分解为MDA等物质[9]。MDA 可影响膜结构与功能,常作为脂质过氧化损伤的重要标志。ROS 也可对蛋白质、核酸、多糖等产生损伤作用。在自由基对细胞产生氧化损伤的同时,细胞内还有一套抗氧化的防御体系,少量的ROS可被机体的抗氧化系统包括抗氧化酶与一些还原性物质所拮抗。抗氧化酶主要有SOD、谷胱甘肽过氧化物酶、过氧化氢酶等,谷胱苷肽是重要的抗氧化物质[10]。过量的ROS可破坏抗氧化酶结构,抑制其活性,从而造成进一步损伤[11]。本研究结果显示,环磷酰胺导致大鼠心肌组织中MDA含量升高、SOD活性下降,表明产生了氧化应激作用[12, 13],而蓝莓花色苷组大鼠心肌组织中MDA含量明显下降、SOD活性升高,表明蓝莓花色苷减轻了大鼠心肌组织氧化应激反应。提示蓝莓花色苷对环磷酰胺所致大鼠心脏损伤的保护作用可能与其抗氧化能力有关。
| [1] | Motawi TM,Sadik NA,Refaat A.Cytoprotective effects of DL-alpha-lipoic acid or squalene on cyclophosphamide-induced oxidative injury:an experimental study on rat myocardium,testicles and urinary bladder[J].Food Chem Toxicol,2010,48:2326-2336. |
| [2] | Oboh G,Ogunruku OO.Cyclophosphamide-induced oxidative stress in brain:protective effect of hot short pepper(Capsicum frutescens L.var.abbreviatum)[J].Exp Toxicol Pathol,2010,62:227-233. |
| [3] | 刘华忠,王光,吴金龙,等.乌贼墨多糖对环磷酰胺致小鼠部分脏器损伤的缓解效应[J].中国现代应用药学,2012(2):32-35. |
| [4] | Jnaneshwari S,Hemshekhar M,Santhosh MS,et al.Crocin,a dietary colorant mitigates cyclophosphamide-induced organ toxicity by modulating antioxidant status and inflammatory cytokines[J].Journal of Pharmacy and Pharmacology,2013,65(4):604-614. |
| [5] | Basu A,Du M,Leyva M,et al.Blueberries decrease cardiovascular risk factors in obese men and women with metabolic syndrome[J].J Nutr,2010,140:1582-1587. |
| [6] | Riso P,Klimis-Zacas D,Del Bo C,et al.Effect of a wild blueberry(Vaccinium angustifolium)drink intervention on markers of oxidative stress,inflammation and endothelial function in humans with cardiovascular risk factors[J].Eur J Nutr,2012:1-13. |
| [7] | 李颖畅,孟宪军,孙靖靖,等.蓝莓花色苷的降血脂和抗氧化作用[J].食品与发酵工业,2008,34:44-48. |
| [8] | Wang XL,Wang X,Xiong LL,et al.Salidroside improves doxorubicin-induced cardiac dysfunction by suppression of excessive oxidative stress and cardiomyocyte apoptosis:doxorubicin cardiotoxicity inhibited by salidroside[J].J Cardiovasc Pharmacol,2013,25:Epub ahead of print. |
| [9] | Shaik AH,Rasool SN,Vikram Kumar Reddy A,et al.Cardioprotective effect of HPLC standardized ethanolic extract of Terminalia pallida fruits against isoproterenol-induced myocardial infarction in albino rats[J].J Ethnopharmacol,2012,141(1):33-40. |
| [10] | Wu C,Chen R,Wang XS,et al.Antioxidant and anti-fatigue activities of phenolic extract from the seed coat of Euryale ferox Salisb.and identification of three phenolic compounds by LC-ESI-MS/MS[J].Molecules,2013:18(9):11003-11021. |
| [11] | Chen Y,Zhang S,Peng G,et al.Endothelial NO synthase and reactive oxygen species mediated effect of simvastatin on vessel structure and function:pleiotropic and dose-dependent effect on tumor vascular stabilization[J].Int J Oncol,2013,42(4):1325-1336. |
| [12] | 郝东方,孙小巍,冯志晶,等.乙酰甲胺磷对大鼠睾丸组织氧化应激影响[J].中国公共卫生,2012,28(2):395-396. |
| [13] | 苏言辉,祝红梅,夏道曼,等.桑叶黄酮对胰岛素抵抗大鼠氧化应激影响[J].中国公共卫生,2011,27(3):1225-1226. |
 2015, Vol. 31
2015, Vol. 31


