2. 湖州师范学院微生物与免疫学研究所
矽肺病是中国常见的一种职业病,因长期吸入大量含有游离二氧化硅粉尘(矽尘)而引起巨噬细胞破坏,继而引发纤维组织增生所致[1, 2]。主要病理改变是肺组织硅结节形成和弥漫性纤维化,多发生于肺泡和呼吸细支气管部位,也见于淋巴管和淋巴结[3]。矽肺病目前尚不能治愈,预后不良,致残率和死亡率较高[4],患者肺癌发病风险亦增加[5]。矽肺临床诊断主要借助X 线胸片或影像学检查、肺功能检测以及职业史、职业病危害史。由于缺乏早期诊断指标和方法,大部分矽肺患者确诊时肺组织已发生严重纤维化[6]。本文探讨染矽小鼠血液及支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中涎液化糖链抗原-6(Krebs von den lungen-6,KL-6)含量变化与肺组织纤维化关系,为KL-6含量检测应用于矽肺诊断提供实验依据。
1 材料与方法 1.1 实验动物60只SPF级C57BL/6小鼠,雌雄各半,体重12~14 g,上海西普尔必凯实验动物有限公司提供,许可证号:SCXK(沪)2008—0016,将小鼠随机分为染矽组和对照组,每组30只。小鼠按SPF级要求饲养,饲料及饮水经灭菌处理,鼠笼每3 d更换,饮水瓶每2 d更换。
1.2 主要试剂与仪器KL-6试剂盒(上海麦莎生物技术公司),二氧化硅(SiO2,德国WACKER公司),纯度高于99.8%,颗粒平均直径7 nm。Olympus BX41显微镜(日本Olympus公司)。
1.3 指标与方法 1.3.1 小鼠染矽小鼠染矽采用气管滴入法[7, 8],染矽2次,间隔7 d。小鼠腹腔注射氯胺酮(80 mg/kg)和利多卡因,待小鼠麻醉后捏紧鼻子,经咽喉部滴入50 μL SiO2混悬液(浓度60 mg/mL),重复捏鼻2次。对照组小鼠采用相同方法吸入50 μL生理盐水。
1.3.2 小鼠样品采集分别于染矽后30、45、60、75、90 d随机选取6只小鼠,腹腔注射戊巴比妥钠(40 mg/kg),待小鼠麻醉后,手术分离左、右支气管及双肺,插入18G套管针至左肺支气管并结扎,注入1.5 mL 生理盐水,回收液体,重复灌洗3次,合并各次BALF-80 ℃保存;股动脉放血,收集1.5 mL血液,离心分离血清,-80 ℃保存,用于KL-6含量检测;小鼠支气管肺泡灌洗后处死,向左肺内灌注10%福尔马林固定15 min,摘除左肺10%福尔马林固定24 h,用于肺组织切片胶原染色。
1.3.3 血清和BALF中KL-6含量检测采用ELISA方法检测KL-6含量,操作严格按照试剂盒说明书进行。取KL-6微量反应板,每孔内加100 μL标准品或待测样品,混匀,避光室温反应90 min;洗板后加入辣根过氧化物酶标记的二抗,继续反应30 min;洗板后加显色底物反应10 min;加终止液,测定405 nm波长的吸光度(A)值。每个样品进行平行双孔测量,取平均值。
1.3.4 肺组织胶原染色及纤维化程度半定量评分[9]左肺组织常规石蜡包埋、固定、脱水、切片,采用Masson方法对胶原纤维染色,光学显微镜观察肺组织纤维化情况,同时进行半定量评分。选取支气管或肺泡超过50%的视野,根据间质伴有胶原纤维的细支气管/肺泡的数目占全视野细支气管/肺泡总数的比例计算纤维化积分值。评分标准:无胶原纤维计0分,胶原纤维<25%计1分,胶原纤维25%~50%计2分,胶原纤维50%~75%计3分,胶原纤维>75%计4分。每张切片观察10个视野,平均得分值代表肺组织纤维化严重程度。
1.4 统计分析采用SPSS 15.0软件进行统计分析,计量资料以x±s表示,组间比较采用方差分析,两两比较采用t检验,相关性分析采用Spearman法,P<0.05为差异有统计学意义。
2 结 果 2.1 染硒对小鼠肺组织胶原纤维分布影响(图 1)染矽组染硒后30 d小鼠肺组织内未见胶原纤维沉积(图 1-A);45 d小鼠肺组织支气管周围和肺泡间出现少量胶原纤维分布(图 1-B);90 d小鼠肺组织支气管周围和肺泡间均出现较多胶原纤维分布伴结节(图 1-C)。对照组小鼠各时间点的肺组织内均未出现胶原纤维分布(图 1-D、E、F)。
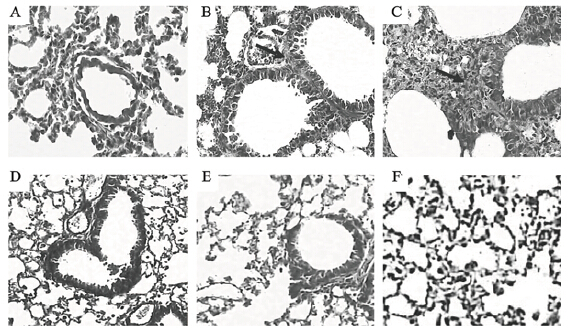 | 注:箭头:示胶原纤维;A、B、C:分别为染矽组染硒后30、45、90 d;D、E、F分别为对照组30、45、90 d。 图 1 染矽后不同时间小鼠肺组织胶原纤维分布(Masson染色,×200) |
对照组小鼠在各时间点上的肺组织纤维化评分值均为0分;染矽后30、45、60、75、90 d时,染硒组小鼠肺组织纤维化评分值分别为0、(1.22±0.44)、(2.42±0.47)、(3.48±0.42)和(3.68±0.28)分;与染矽后45 d小鼠比较,染矽后60、75、90 d的小鼠肺组织纤维化评分值均明显增加(P<0.01),染矽后75、90 d的小鼠肺组织纤维化评分值明显高于染矽后60 d的小鼠(P<0.01)。提示,小鼠染矽后45 d肺组织开始出现纤维化,且纤维化程度随染矽时间延长而加剧。
2.3 染硒对小鼠血液和BALF中的KL-6含量影响(表 1)与对照组比较,染矽后45~90 d小鼠血液中KL-6含量明显升高(P<0.01),呈时间-效应关系(P<0.01);与对照组比较,染矽后75、90 d的小鼠BALF中KL-6含量明显升高(P<0.01);与染矽后60 d比较,染矽后75、90 d的小鼠BALF中KL-6含量均明显升高(P<0.01)。
| 表 1 染矽对小鼠血液和BALF中KL-6含量影响(pg/mL) |
采用Spearman法分析染矽小鼠血液及BALF中KL-6含量与肺组织纤维化评分值之间相关性,结果显示,小鼠血液中KL-6含量与肺组织纤维化评分值呈正相关(r=0.866,P<0.01),小鼠BALF中KL-6含量与肺组织纤维化评分值亦呈正相关(r=0.737,P<0.01)。
3 讨 论在二氧化硅进入体内并引发肺组织纤维化病变过程中,Ⅱ型肺泡上皮细胞和Clara 细胞受到损害,其合成的特异性蛋白数量发生改变,随着肺组织血气屏障遭到破坏以及肺泡通透性发生改变,特异性蛋白进入血液循环。研究表明Clara 细胞以及Ⅱ型肺泡上皮细胞等合成并释放的组织特异性蛋白可能是矽肺病潜在的分子标记物[10]。KL-6是一种肺组织特异性蛋白,主要由Ⅱ型肺泡上皮细胞合成并分泌,经血气屏障转移后进入血液[11]。血液中KL-6蛋白含量增多反映肺组织血气屏障功能受损,已经成为间质性肺纤维化和肺炎的血清诊断学指标之一[12, 13]。
本研究结果显示,小鼠染矽后45 d,肺组织支气管周围和肺泡间出现纤维化改变,且纤维化严重程度随时间延长而加剧;在染矽小鼠肺组织纤维化改变的早期(45 d),其血液和BALF中KL-6含量均未见明显改变;在肺组织纤维化改变的中期(>60 d),染矽小鼠血液中KL-6含量明显增加,且与肺纤维化严重程度呈正相关;在肺组织纤维化改变的后期(>75 d),染矽小鼠BALF中KL-6含量增加明显。提示,血液中KL-6含量检测不适于矽肺纤维化早期诊断和预测,但可用于判断矽肺纤维化程度,对于矽肺病预后判断具有一定临床价值;血液中KL-6含量较BALF中KL-6含量在预测肺组织纤维化程度方面价值较大。研究表明患者个体基因多态性可能影响血液KL-6水平[14]。因此,在应用血液KL-6含量作为矽肺纤维化诊断指标时,还应考虑个体遗传背景差异。
| [1] | 周效宝,王瑞.细胞因子在矽肺发生发展中作用研究进展[J].中国公共卫生,2011,27(12):1630-1632. |
| [2] | 李玉虎,缪株雷,程国强,等.巨噬细胞损伤型大鼠矽肺纤维化模型[J].中国公共卫生,2009,25(10):1206-1207. |
| [3] | Leung CC,Yu IT,Chen W.Silicosis[J].Lancet,2012,379(9830):2008-2018. |
| [4] | Bang KM,Attfield MD,Wood JM,et al.National trends in silicosis mortality in the United States,1981-2004[J].Am J Ind Med,2008,51(9):633-639. |
| [5] | Liu Y,Steenland K,Rong Y,et al.Exposure-response analysis and risk assessment for lung cancer in relationship to silica exposure:a 44-year cohort study of 34,018 workers[J].Am J Epidemiol,2013,178(9):1424-1433. |
| [6] | Pandey JK,Agarwal D.Biomarkers:a potential prognostic tool for silicosis[J].Indian J Occup Environ Med,2012,16(3):101-107. |
| [7] | Beamer CA,Migliaccio CT,Jessop F,et al.Innate immune processes are sufficient for driving silicosis in mice[J].J Leukoc Biol,2010,88(3):547-557. |
| [8] | Cassel SL,Eisenbarth SC,Iyer SS,et al.The Nalp3 inflammasome is essential for the development of silicosis[J].Proc Natl Acad Sci USA,2008,105(26):9035-9040. |
| [9] | Tan RJ,Fattman CL,Niehouse LM,et al.Matrix metalloproteinases promote inflammation and fibrosis in asbestos-induced lung injury in mice[J].Am J Respir Cell Mol Biol,2006,35(3):289-297. |
| [10] | Wang SX,Liu P,Wei MT,et al.Roles of serum Clara cell protein 16 and surfactant protein D in the early diagnosis and progression of silicosis[J].J Occup Environ Med,2007,49(8):834-839. |
| [11] | Zhang Y,Kaminski N.Biomarkers in idiopathic pulmonary fibrosis[J].Curr Opin Pulm Med,2012,18(5):441-446. |
| [12] | Ichiyasu H,Ichikado K,Yamashita A,et al.Pneumocyte biomarkers KL-6 and surfactant protein D reflect the distinct findings of high-resolution computed tomography in nonspecific interstitial pneumonia[J].Respiration,2012,83(3):190-197. |
| [13] | Huang H,Peng X,Nakajima J.Advances in the study of biomarkers of idiopathic pulmonary fibrosis in Japan[J].Biosci Trends,2013,7(4):172-177. |
| [14] | Horimasu Y,Hattori N,Ishikawa N,et al.Different MUC1 gene polymorphisms in German and Japanese ethnicities affect serum KL-6 levels[J].Respir Med,2012,106(12):1756-1764. |
 2014, Vol. 30
2014, Vol. 30


