2. 天津市水产研究所
传统细菌培养及生化鉴定方法周期长、灵敏度低且操作繁琐,不能满足食品中致病菌快速灵敏的检测需要,也不利于食物中毒等突发事件处理。因此,2007年,中国国家质量监督检验检疫总局颁布了国家出入境检验检疫行业标准《食品中多种致病菌快速检测方法—PCR法》(SN/T 1869-2007)[1]。本研究根据沙门菌、副溶血性弧菌、金黄色葡萄球菌、单核细胞增生李斯特菌是引起中国食物中毒主要致病菌的现状[2 --------- 3],对SN/T 1869-2007中相关食源性致病菌的检测方法特异性进行了验证,同时,根据需要统一反应条件,建立了快速简便的聚合酶链式反应(polymerase chain reaction,PCR)检测新体系,结果报告如下。
1 材料与方法 1.1 菌株测试菌株共计166株,主要涉及沙门菌属、志贺菌属、埃希菌属、弧菌属、气单孢菌属、葡萄球菌属等细菌。其中,标准菌株主要来源于中国医学细菌菌种保藏管理中心(National Center For Medical Culture Collections,CMCC)、中国普通微生物菌种保藏管理中心(China General Microbiological Culture Collection Center,CGMCC),来自CMCC的菌株包括26株沙门菌、26株志贺菌、26株埃希大肠杆菌、15株金黄色葡萄球菌、5株副溶血弧菌、3株霍乱弧菌、6株单核细胞增生李斯特菌;来自CMGCC的标准菌株包括4株河弧菌、2株嗜水气气单胞菌、2株副溶血弧菌。分离株主要来源于军事医学科学院卫生学环境医学研究所卫生监测中心的菌种库和天津市水产研究所,主要包括2株副溶血弧菌、20株金黄色葡萄球菌、2株白色葡萄球菌、5株单核细胞增生李斯特菌、2株格氏李斯特菌、1株伊万诺夫李斯特菌、1株威尔斯李斯特菌、1株英诺克李斯特菌、2株河弧菌、1株溶藻弧菌、10株嗜水气气单胞菌、4株其他气单胞菌属细菌(苏伯利产气单胞菌、点状产气单胞菌、温和气单胞菌、豚鼠气单胞菌)。
1.2 试剂与仪器胰酪胨大豆酵母浸膏肉汤、营养琼脂(美国BD公司),细菌DNA提取试剂盒、Taq mixture、DNA Marker(北京天根生化科技有限公司),引物由上海英骏生物技术有限公司合成。PCR 扩增仪(美国ABI公司);凝胶成像系统(美国GE公司);高速冷冻离心机(美国Sigma 公司)。
1.3 检测方法建立 1.3.1 目的基因选择及引物设计(表 1)根据4种食源性致病菌的特异性保守基因,利用DNAMAN和Primer 5.0 软件优化设计出引物后,通过NCBI(National Center for Biotechnology Information)的primer BLAST 程序,对各引物及其扩增产物进行同源性比对,保证各食源性致病菌引物的高度特异性。
| 表 1 4种常见食源性致病菌靶基因引物序列 |
采用2种方法提取DNA:(1)煮沸法:取1 mL菌液放入离心管中,10 000 r/min离心5 min 获得菌体后,弃上清,沉淀加100 μL 无菌去离子水,重悬后100 ℃ 水浴10 min;10 000 r/min离心5 min,取上清于-20 ℃保存备用[4];(2)按照细菌DNA提取试剂盒操作方法提取。
1.3.3 PCR扩增及反应条件所有反应体系均为 50 μL,Taq mixture 25 μL,引物(10 μmol/L)各1 μL,模板2 μL,其余为蒸馏水。对于SN/T 1869-2007来源的引物,PCR反应条件按照标准执行;对于自行设计的引物,反应条件均为:于94 ℃预变性5 min,然后进入30个循环(94 ℃ 30 s,58 ℃ 30 s,72 ℃ 45 s),最后在72 ℃下延伸5 min,PCR产物经1.5%琼脂糖凝胶电泳检测。
1.3.4 特异性测试采用煮沸法提取各菌DNA后,按照上面建立的方法,分别采用SN/T 1869-2007和自行设计的引物验证4种食源性致病菌PCR检测体系的特异性。其中,沙门菌引物的测试菌株包括沙门菌、志贺菌、埃希大肠杆菌等78株;副溶血弧菌引物的测试菌株包括副溶血弧菌、霍乱弧菌、溶藻弧菌、河弧菌、气单胞菌等35株;单核细胞增生李斯特菌引物的测试菌株包括单核细胞增生李斯特菌、格氏李斯特菌、伊万诺夫李斯特菌、威尔斯李斯特菌、英诺克李斯特菌等16株;金黄色葡萄球菌引物的测试菌株包括金黄色葡萄球菌和白色葡萄球菌等37株。
1.3.5 灵敏度测试以沙门CMCC 50115和金黄色葡萄球菌CMCC 26003为参考菌株进行灵敏度测定。即,将以上标准菌株分别接种到胰酪胨大豆酵母浸膏肉汤培养基过夜,采用细菌DNA提取试剂盒提取DNA后,将不同浓度的DNA加入PCR反应体系以测试PCR检测体系的灵敏度。
1.3.6 人工污染食品样品检测分别将4种食源性致病菌标准菌过夜培养,利用平板倾注法计数后,用生理盐水梯度稀释。将4种食源性致病菌(每种105 CFU)随机组合的加入2.5 g无菌鸡肉样品中,加入25 mL生理盐水均质后,采用细菌DNA提取试剂盒提取DNA并进行各菌的PCR 检测。
2 结 果 2.1 特异性实验(图 1)结果表明,依据invA基因设计的沙门菌引物虽对26株沙门菌PCR扩增结果均为阳性,但对志贺菌中的15株和埃希大肠杆菌中的6株亦存在目的条带扩增现象;依据tlh基因设计的副溶血弧菌引物对溶藻弧菌、部分测试霍乱弧菌和河弧菌均有目的条带(图 1A);依据prfA基因设计的单核细胞增生李斯特菌引物对本文所有李斯特菌PCR 扩增结果均为阳性;依据femA基因设计的金黄色葡萄球菌引物,对金黄色葡萄球菌和白色葡萄球菌的PCR 扩增结果均为阳性。本研究自行设计的上述4种食源性致病菌引物则显示良好的特异性,不仅目标沙门菌、单核细胞增生李斯特菌、副溶血弧菌(图 1B)、金黄色葡萄球菌的PCR 扩增结果均为阳性,而且对其他非目标测试菌的PCR 扩增结果均为阴性,特异性达100%。
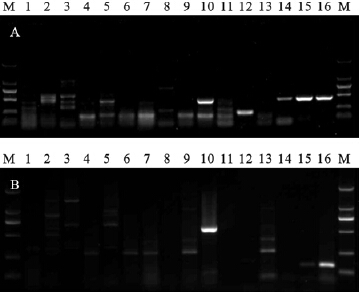 | 注:A:引物来自SN/T 1869-2007;B:引物为本研究设计;1、2、3、8:河弧菌(CGMCC 1.1608、1.1609、1.1610、1.1611);4、6:嗜水气气单胞菌(CGMCC 1.2017、1.927 );5:河弧菌(IHME);7、9:嗜水气单胞菌(IHEM分离株4#、10#);10:溶藻弧菌(IHEM TJF-15);11:豚鼠气单胞菌(IHME);12:温和气单胞菌(IHME);13、14:霍乱弧菌(CMCC 860072、860084);15、16:副溶血弧菌(CGMCC 1.1997、1.1615);M:DL2000。 图 1 副溶血弧菌PCR检测体系特异性验证 |
将74 ng沙门菌和30 ng金黄色葡萄球菌DNA稀释至10-4后均可获得阳性结果,而稀释10-5倍则不能扩增出特异性的核苷酸片段,因此,该PCR检测体系对各菌DNA最低检测灵敏度可达6 pg。
2.3 模拟食品检测结果4种食源性致病菌随机组合后加入鸡肉样品中,分别进行PCR 检测,结果均出现相应的目的条带,特异性强,准确率为100%,表明本研究建立的PCR 检测体系具有较好的稳定性和实用性。
3 讨 论近年来,虽然食源性致病菌检测新技术不断涌现[5 --------- 8],一批致病菌快速鉴定仪器也相继问世,然而,由于这些技术需要专门仪器支持且实验成本昂贵,不适于基层开展大规模的常见食源性致病菌检测。相比之下,PCR技术成本低,快速、操作简单,更适于推广。目前,中国虽然制定了相关食品检测标准方法的行业标准(SN/T 1869-2007),且PCR 技术检测食源性致病菌的报道也越来越多[9 --------- 13],但其有效性还需持续改进。本研究以副溶血性弧菌、沙门氏菌、金黄色葡萄球菌、单增李斯特菌为研究对象,对SN/T 1869-2007中的相关PCR技术进行了验证,结果发现,不仅相关引物特异性差,而且操作繁琐、反应参数不统一,致病菌不同PCR条件也不同,因此,细菌总体检测周期长。本研究重新选择靶基因并设计相应引物,同时通过统一引物退火温度和缩短目的片段,最终建立针对4种常见食源性致病菌的相同PCR检测体系,不仅操作步骤简单、检测时间短,而且特异性强、灵敏度高,整个检测时间可在3~4 h 内完成,具有较强的实际应用价值,适于临床诊断、食品卫生监控及进出口食品安全的微生物快速检测。
| [1] | 中华人民共和国国家质量监督检验检疫总局.SN/T 1869-2007《食品中多种致病菌快速检测方法—PCR法》[S].北京:中国标准出版社,2007. |
| [2] | 王世杰,杨杰,谌志强,等.1994—2003年我国766起细菌性食物中毒分析[J].中国预防医学杂志,2006,7(3):180-184. |
| [3] | 孟昭赫.食品卫生检验方法注释(微生物学部分)[M].北京:人民出版社,1990:365-374. |
| [4] | 邵碧英,陈彬,汤敏英,等.沙门氏菌DNA 提取及PCR 反应条件的优化[J].食品科学,2007,28:331-334. |
| [5] | Wang XW,Zhang L,Jin LQ,et al.Development and application of an oligonucleotide microarray for the detection of food-borne bacterial pathogens[J].Appl Microbiol Biotechnol,2007,76:225-233. |
| [6] | Shen ZQ,Wang JF,Qiu ZG,et al.QCM immunosensor detection of Escherichia coli O157:H7 based on beacon immunomagnetic nanoparticles and catalytic growth of colloidal gold[J].Biosens Bioelecron,2011,26:3376-3381. |
| [7] | Jacob ME,Shi X,An B,et al.Evaluation of a multiplex real-time polymerase chain reaction for the quantification of Escherichia coli O157 in cattle feces[J].Foodborne Pathog Dis,2012,9:79-85. |
| [8] | Cao C,Gontard LC,Thuy Tramle L,et al.Dual enlargement of gold nanoparticles:from mechanism to scanometric detection of pathogenic bacteria[J].Small,2011,7:1701-1708. |
| [9] | 龚玉姣,贺征,陈建东,等.PCR 检测冷冻食品中"活的非可培养状态"的副溶血弧菌[J].中国预防医学,2010,11:988-990. |
| [10] | 吕均,郑华英.PCR与mini-V IDAS相结合快速检测食品中单增李斯特菌[J].中国卫生检验,2010,20:1705-1706. |
| [11] | 刘桂华,乔凤,黄鑫,等.食品中单增李斯特菌PCR检测方法建立与评价[J].中国公共卫生,2007,23(1):60-61. |
| [12] | 邢立新,孙武长,刘桂华,等.食品中肠出血性大肠埃希菌O157:H7的PCR检测[J].中国公共卫生,2006,22(12):1504-1505. |
| [13] | 贺晨,孙鸿燕,邵丽筠,等.4种病原菌多重PCR 检测方法建立[J].中国公共卫生,2011,27(4):525-527. |
 2014, Vol. 30
2014, Vol. 30


