2. 贵阳医学院2011届硕士研究生;
3. 贵阳医学院2013届研究生;
4. 贵阳医学院2014届研究生
研究表明,砷能通过血脑屏障进入脑组织,破坏脑组织正常生理功能,从而引起认知障碍、智力低下等神经行为异常[1, 2, 3],但其神经毒性作用的分子机制目前尚不十分清楚。近年来分子神经生物学研究中,即早基因(主要包括c-fos和c-jun)在神经系统生理及病理过程中调节作用日渐受到关注。fos和jun蛋白是c-fos和c-jun原癌基因的表达产物,在正常组织中有微量表达,对维持细胞的正常生理功能有着重要作用。在异常内外环境影响下,其表达量可能发生改变,以致组织细胞发生病变,由于c-fos和c-jun蛋白表达能较及时准确地反映实验动物神经细胞的病变,研究者建议可作为神经元功能活动标记物,迄今已被用于不同类型脑损伤中神经细胞功能的评价。本研究通过建立亚急性砷中毒动物模型,观察大鼠脑组织海马区c-fos、c-jun表达水平及细胞凋亡变化,探讨砷对脑神经毒性作用的分子机制。
1 材料与方法 1.1 实验动物清洁级SD大鼠56只,体重(170±20)g,雌雄各半,由贵阳医学院动物实验中心提供并饲养,许可证号:SCXK(黔)2012-001。实验前大鼠适应性饲养1周,饲养环境温度为20 ℃左右,光照周期为自然光10/14 h昼/夜循环,自由饮水进食。
1.2 主要试剂与仪器兔抗c-fos、c-jun抗体(北京博奥森生物技术有限公司),SP-9000试剂盒(北京中杉金桥生物技术有限公司);二氨基联苯染色试剂盒(武汉博士德生物工程有限公司);牛血清白蛋白(北京索莱宝科技有限公司)。旋转式超薄切片机(德国徕卡仪器公司);CX41奥林巴斯显微镜、BX51奥利巴斯双孔电子显微镜(广州市明美科技有限公司)
1.3 动物分组与染毒1.3 动物分组与染毒 56只大鼠按体重随机分成4组,每组14只,雌雄各半,即高、中、低剂量染砷组(亚砷酸钠20、10、5 mg/kg)和对照组,灌胃染毒,对照组给予蒸馏水,连续15 d。乙醚麻醉大鼠,股动脉放血处死动物。迅速取出脑组织,放入装有冰浴生理盐水中漂洗,称重。取一侧大脑置于4%的甲醛溶液中固定、再经脱水、石蜡包埋、切片(5 μm)。每只大鼠切7张片,1张做苏木素伊红染色(hematoxylin-eosinstaining,HE),另6张分别用于c-fos、cjun免疫组化染色和细胞凋亡指数测定。
1.4 指标与方法 1.4.1 病理指标观察观察海马区是否有神经经元肿胀、排列紊乱、变性、坏死等病理现象。神经元肿胀:神经元体积增大,细胞浆染色变浅,细胞核体积增大,染色变浅;神经元变性:神经元体积增大,细胞浆染色变浅及尼氏体消失,其内可有大小不等圆形或类圆形空泡;神经元坏死:神经元结构模糊或破坏,突起消失,细胞浆染色加深,细胞核结构模糊、固缩、碎裂、消失,胞浆均质红染。
1.4.2 c-fos和c-jun表达检测采用免疫组化法,切片60 ℃烘烤1 h,常规脱蜡至水合,用磷酸盐缓冲液(PBS)洗涤5 min×3次,3%H2O2溶液37 ℃孵育20 min。抗原修复,正常山羊血清封闭液37 ℃孵育20 min,加入一抗体(1:300),4 ℃冰箱过夜(18 h),二抗37 ℃孵育20 min,辣根酶37 ℃孵育20 min,PBS洗涤5 min×3次,二氨基联苯法染色,苏木素复染5 min,脱水,封片。c-fos、c-jun阳性对照分别采用人直肠癌、结肠癌切片(北京博奥森生物技术有限公司),阴性对照以0.01 mol/L PBS代替一抗,以胞核显棕色或棕黄色为抗原阳性,胞核蓝色为阴性,每组取6张切片观察,每张切片随机选择5个高倍视野(×400)计数阳性细胞个数和总细胞个数,取平均数,计算阳性细胞表达率。
1.4.3 细胞凋亡指数测定采用原位末端标记法,切片通过脱蜡至水合,将切片浸入含200 mL 0.1 mmol/L柠檬酸缓冲液(pH 6)中,置于沸水15 min,放入自来水中冷却至室温。加蛋白酶K,37 ℃孵育30 min。加封闭液,25 ℃孵育30 min,加50 μL TdT酶反应液,置于湿盒37 ℃避光反应60 min。加入50 μL 辣根酶标记链霉卵白素工作液,置于湿盒37 ℃避光反应30 min,二氨基联苯法显色,苏木素复染5 min,脱水,封片。阳性对照加入100 μL DNaseI反应液,37 ℃孵育30 min,PBS 洗5 min×2次,阴性对照在制备TdT酶反应液时,不添加TdT酶。结果判断:细胞核棕色为阳性表达,蓝色为阴性细胞。每组取6张切片观察,每张切片随机选择5个高倍视野(×400)计数阳性细胞个数和总细胞个数,计算细胞凋亡指数,即每个视野阳性细胞个数占总细胞个数的比例。
1.5 统计分析数据采用x±s表示,采用SPSS 11.5软件进行统计分析,用完全随机方差分析比较各组间差异,进一步采用最小显著差异法进行组间两两比较,Pearson进行相关分析;如方差不齐采用Tamhanes T2检验、Spearman秩相关分析。
2 结 果 2.1 染砷对大鼠脑海马组织结构影响(图 1)各剂量染砷组大鼠脑海马区均出现神经元排列紊乱、肿胀、变性、坏死等病理现象,而对照组大鼠海马区未出现神经元变性或坏死,有少量的神经元肿胀现象。对照组与低、中、高剂量染砷组大鼠脑海马神经元肿胀率分别为20%、70%、70%、90%,神经元变性率分别为0、60%、30%、70%,神经元坏死率分别为0、20%、30%、40%,与对照组比较,各染砷组大鼠脑海马神经元肿胀、变性、坏死率明显升高。
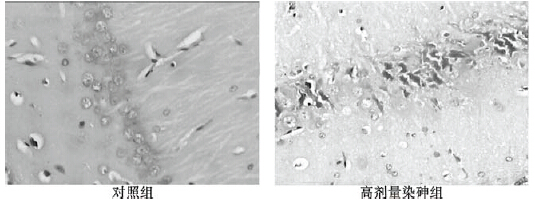 | 图 1 染砷对大鼠脑海马神经元结构影响(HE,×400) |
与对照组比较,各剂量染砷组大鼠脑海马c-fos、c-jun蛋白表达阳性率均升高,差异有统计学意义(F=89.504、758.983,P<0.01),呈剂量-反应关系(P<0.01);与对照组比较,各剂量染砷组大鼠脑细胞凋亡指数明显上升,差异均有统计学意义(P<0.01),呈剂量-反应关系(P<0.01)。
| 表 1 砷对大鼠脑海马区c-fos、c-jun表达及细胞凋亡影响(x±s,n=6) |
Pearson相关分析结果显示,大鼠海马c-fos表达阳性率和细胞凋亡指数呈正相关(r=0.734,P<0.01);大鼠海马c-jun表达阳性率和细胞凋亡指数呈正相关(r=0.848,P<0.01);大鼠海马c-fos和c-jun表达阳性率呈正相关(r=0.808,P<0.01)。
3 讨 论c-fos和c-jun基因的表达产物fos和jun蛋白结合的复合物作用于异源二聚体复合物-活化蛋白转录因子-1(AP-1)调节点激活靶基因,从而较长时间地改变神经元的结构和功能,记忆的形成,与即早基因启动细胞级联反应,最后引起突触重塑有关。张莹等[4]研究发现急性铅染毒可能间接阻碍星形胶质细胞c-fos 和c-jun 基因的反应性表达,使其产物fos和jun 蛋白水平降低,c-fos和c-jun mRNA水平的变化规律与各组小鼠学习记忆能力的变化一致,表明c-fos和c-jun 基因表达状况的变化可能是慢性铅染毒导致小鼠学习记忆能力下降的重要中间环节。安兰敏等[5]研究表明铅中毒后大鼠脑组织海马、皮层fos、jun表达阳性细胞数显著增加,表达强度有升高趋势,诱导细胞发生凋亡。金属汞在大脑蓄积的神经毒性与c-fos过度表达有关[6, 7]。本研究结果显示,饮用含砷水的大鼠脑海马区c-fos和c-jun蛋白的表达明显高于对照组,呈剂量-反应关系,提示砷可诱导大鼠脑海马区c-fos和c-jun蛋白表达增加,但c-fos和c-jun在海马区的过度表达对学习记忆影响的机制目前尚不清楚。有研究显示c-fos和c-jun蛋白的过度表达与细胞的凋亡有关[6, 7],本研究结果显示,饮用含砷水的大鼠脑海马区细胞凋亡指数明显高于对照组,呈剂量-反应关系,并且c-fos、c-jun蛋白表达的阳性率与凋亡指数之间具有较强相关关系。提示砷导致脑海马神经元的凋亡与c-fos、c-jun蛋白的过度表达可能有关。
c-fos,c-jun是AP-1异二聚体中重要成员,作为转录活化因子AP-1,参与调节DNA 转录机制,作为基因调控蛋白,调节靶基因或迟发基因的转录,进而诱导细胞凋亡。本研究结果表明,c-fos、c-jun的过度表达可能造成大鼠大脑海马区神经细胞凋亡增加,而大量的细胞凋亡必将对大脑学习记忆等功能产生一定影响。这可能是砷致大脑神经毒性的原因之一。然而砷中毒的神经机理较复杂,本研究从仅神经分子机制的一个环节对砷毒性机制进行了探讨,要完全阐释其机理,尚需进行更深入的研究。
| [1] | 杨东焱.砷对大脑毒性的研究进展[J].卫生研究,2003,32(3):272-275. |
| [2] | 周华芳,余堃,张华,等.亚急性砷中毒对脑海马和皮质AChE、NOS活性影响[J].中国公共卫生,2012,28(3):349-350. |
| [3] | 席淑华,孙贵范,孙文娟,等.砷对仔代大鼠神经行为和学习记忆功能影响[J].中国公共卫生,2006,22(5):559-560. |
| [4] | 张莹,王彪,赵久晗,等.铅对大鼠星型胶质细胞c-fos和c-Jun蛋白表达影响[J].中国公共卫生,2010,26(11):1392-1393. |
| [5] | 安兰敏,牛玉杰,徐兵,等.铅对大鼠脑细胞凋亡的作用及对fos、jun、p53基因和一氧化氮合酶表达的影响[J].癌变·畸变·突变,2006,18(5):25-28. |
| [6] | 程金平,王文华,瞿丽雅,等.汞污染粮食诱导大鼠海马c-fos蛋白表达[J].环境科学,2005,26(1):178-180. |
| [7] | 郭丽,毕晓颖,李志超,等.甲基汞对脑神经胶质细胞凋亡及 c-fos 表达的影响[J].卫生研究,2002,31(1):7-9. |
 2014, Vol. 30
2014, Vol. 30
