结直肠癌是常见的恶性肿瘤之一,其术后5年生存率小于40%[1]。表皮生长因子受体 (epithelial growth factor receptor,EGFR) 是一种具有酪氨酸激酶活性的跨膜受体。研究显示,人类多种肿瘤细胞存在EGFR的异常激活,使其正常功能失控[2]。结肠癌细胞过表达EGFR,抗EGFR抗体成为治疗结肠癌的重要生物治疗方法[3]。西妥昔单抗是抗EGFR人/鼠嵌合单克隆抗体,它选择性地与EGFR结合,已被证实它对包括结肠癌在内的多种肿瘤有效[4]。帕尼单抗可选择性地与肿瘤细胞表面表皮生长因子受体特异性结合而发挥抗瘤效果[5]。本研究体外和体内实验观察帕尼单抗与西妥昔单抗对HT29细胞及其体外肿瘤移植模型治疗效果,以便在临床用药做出更好选择。 1 材料和方法 1.1 材料
人结肠癌细胞株HT29(中国医学科学院基础医学研究所细胞中心),RPMI1640培养基(美国Gibco公司),小牛血清(华西生物研究所),胰酶、二甲基亚砜(dimethyl sulfoxide,DMSO)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT)(美国Sigma公司),迁移实验用Transwell小室(美国Corning公司),4~5周龄无特定病原体(specefic pathogen free,SPF)级 BALB/c裸鼠(北京维通利华实验动物技术有限公司,生产批号:20130402),体重12~14 g。 1.2 方法 1.2.1 细胞培养及处理方法
人结肠癌细胞株HT29细胞系,采用含10%小牛血清RPMI 1640培养液进行培养,培养条件为37 ℃,饱和湿度,5%CO2。分别收集对数期生长的细胞,用0.25%的胰蛋白酶消化,吹打离心后用磷酸盐缓冲液(phosphate buffered saline,PBS)洗1次,再离心后用PBS重悬,浓缩,并吹打成单细胞悬液,台盼兰染色计数,调整细胞浓度为1×107 个/mL。帕尼单抗终浓度为0、1、10、100 mg/L,西妥昔单抗终浓度为0,10,100和1 000 nmol/L。 1.2.2 MTT法检测帕尼单抗与西妥昔单抗体对细胞增值能力的影响
上述细胞用含10%胎小牛血清得培养液配成单个细胞悬液,以每孔1 000~10 000个细胞接种到96孔板,每孔体积200 μL。培养3~5 d后,每孔加MTT溶液(5 mg/ml用PBS 配)20 μL。继续孵育4 h,终止培养,小心吸弃孔内培养上清液。每孔加150 μL DMSO,振荡10 min。选择490 nm波长,在酶联免疫监测仪上测定各孔A值[6]。 1.2.3 Transwell法检测帕尼单抗与西妥昔单抗体对细胞侵袭能力的影响
实验前24 h,将20 μL 稀释后的Matrigel 0.5 mg/mL加入Transwell小室上膜面,轻轻晃动使胶铺匀,37 ℃孵箱放置30 min。上述细胞制备成5×105/mL的细胞悬液,取200 μL置于Transwell上室;下室加入300 μL 培养液,37 ℃孵育24 h。24 h后,未发生侵袭的细胞用棉拭子从上层腔室除去。下层小室中的细胞以0.1%结晶紫固定染色,计算出现侵袭的细胞数[7]。 1.2.4 帕尼单抗与西妥昔单抗的体内治疗对照实验
动物随机分为2个治疗组及1个对照组,每组10只。按0.2 mL/只(6×106个肿瘤细胞)用微量注射器注入到裸鼠背部近右后肢皮下,建立移植瘤动物模型。在肿瘤移植4周后开始治疗。西妥昔单抗组:西妥昔单抗1 mg/只,腹腔注射,每周一次[9];帕尼单。第14周将全部裸鼠处死,取出肿瘤,测量各组肿瘤块体积大小。游标卡尺测量肿瘤长短径,计算肿瘤体积=π/6(长径×短径2)[8]。 1.3 统计分析
数据以(x±s)表示,采用t检验,SPSS 12.0软件进行统计分析。P<0.05为差异有统计学意义。 2 结 果 2.1 2种药物对HT29细胞增值效果比较
低剂量的帕尼单抗(0、1、10 mg/L)与西妥昔单抗(0、10、100 nmol/L)对HT29细胞均无抑制作用,高浓度的帕尼单抗(100 mg/L)(t=10.01,P<0.05)与西妥昔单抗(1 000 nmol/L)(t=8.35,P<0.05)能明显抑制细胞生长,并且帕尼单抗对细胞高增值的抑制作用明显强于西妥昔单抗(t=4.22,P<0.05)。
| 表 1 西妥昔单抗和帕尼单抗作用于HT29分别对细胞增值能力的影响(A值) |
侵袭实验显示帕尼单抗和西妥昔单抗处理后,细胞侵袭由对照组的(96.53±5.74)%分别下降到帕尼单抗组的(45.38±3.81)%和西妥昔单抗组的(67.21±4.82)%。且帕尼单抗对细胞侵袭的抑制作用明显强于西妥昔单抗(t=6.67,P<0.05)。
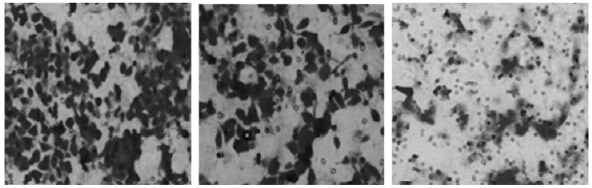 | 图 1 帕尼单抗与西妥昔单抗处理后Transwell细胞图像 |
帕尼单抗组肿瘤体积为(435.8±230.4)mm3;西妥昔单抗组肿瘤体积为(542.4±241.5)mm3;对照组肿瘤体积为(753.2±321.5)mm3。帕尼单抗(t=18.47,P<0.05)与西妥昔单抗(t=14.89,P<0.05)与在体内均可显著抑制肿瘤生长,帕尼单抗对肿瘤生长的抑制作用显著强于西妥昔单抗。 3 讨 论
EGFR的过表达或过度激活可以使肿瘤更易存活和生长[10]。EGFR在结肠癌细胞中普遍过表达,因此EGFR的分子靶向药对结肠癌有较好的治疗效果[2]。西妥昔单抗是抗EGFR人/鼠嵌合单克隆抗体,可选择性地高效与EGFR结合[11],从而抑制细胞的增值[12]。帕尼单抗是一种高亲和的全人单克隆IgG2抗体[13],帕尼单抗不含任何鼠源性蛋白[14]。单药或是联合化疗对转移性结直肠癌患者有效[15]。本研究结果表明,帕尼单抗相对与西妥昔单抗在抑制结肠癌细胞的增值及侵袭能力更强。推测原因可能为帕尼单抗作为全人源性单抗,可以避免人抗鼠抗体的形成降低单克隆抗体生物学效能[16]。帕尼单抗选择性地与EGFR特异性结合,随后抗体包被的受体复合物很快因内吞作用而使细胞表面EGFR水平下调。阻断该受体与其他配体结合及相应信号转导过程,使细胞周期停滞在G0/G1期,促进细胞凋亡。帕尼单抗相对与西妥昔单抗的临床疗效比较,有待于大量的临床实验研究证实。
| [1] | 黄甜.大肠癌患者生存时间影响因素分析[J].中国公共卫生,2008,24(1):73-74. |
| [2] | Raymond E,Faivre S,Armand JP.Epidermal growth factor receptor tyrosine kinase as a target for anticancer therapy[J].Drugs,2000,60 Suppl 1:15-23,41-42. |
| [3] | 张立华.EGF和EGFR在结肠癌研究中的新进展[J].实用诊断与治疗杂志,2004,18(3):203-205. |
| [4] | 崔岚,逄晓云,王晓珉.新型抗肿瘤药物西妥昔单抗[J].中国药师,2005(4):332-334. |
| [5] | Cohenuram M,Saif MW.Panitumumah the first fully human monoclonal antibody:from the bench to the clinic[J].Anticancer Drugs,2007,18(1):7-15. |
| [6] | 孙炜,蔡绍皙,晏小清,等.CXCR7对HeLa细胞增殖、粘附和侵袭能力的影响[J].中国科学技术大学学报,2012,42(4):311-317. |
| [7] | 张建平,吕卫国,谢幸.CXCR4/SDF-1a对宫颈癌HeLa细胞定向迁移及增殖的影响[J].肿瘤防治研究,2008,35(7):495-498. |
| [8] | 刘业六,钱海鑫,张逖,等.趋化因子受体-6小干扰RNA对人肝癌HCCLM6细胞裸鼠皮下移植瘤的抑制作用[J].中华实验外科杂志,2013,30(12):2577-2579. |
| [9] | Hotz B,Keiholzz U,Ffusi A,et al.In vitro and in vivo antitumor activity of cetuximab in human gastric cancer cell lines in relation to epidermal growth factor receptor(EGFR)expression and mutational phenotype[J].Gastric Cancer,2012,15(3):252-264. |
| [10] | Baumann M,Krause M.Targeting the epidermal growth factor receptor in radiotherapy:radiobiological mechanisms,preclinical and clinical results[J].Radiother Oncol,2004,72(3):257-266. |
| [11] | Goldstein NI,Prewett M,Zuklys K,et al.Biological efficacy of a chimeric antibody to the epidermal growth factor receptor in a human tumor xenograft model[J].Clin Cancer Res,1995,1(11):1311-1318. |
| [12] | Baselga J,Canadas M,Codony J,et al.Activated epidermal growth factor receptor:studies in head and neck tumors and tumor cell lines after exposure to ligand and receptor tyrosinekinase inhibitors[J].Proc Am Soc Clin Oncol,1999(abstr 2392). |
| [13] | Williams KJ,Loekhart AC.Targeting colometal cancer with antiepidermal growth factor receptor antibodies:focus on panitumumab[J].Onto Targets Ther,2009,2:161-170. |
| [14] | Hoda D,Simon GR,Garrett CR.Targeting colorectal cancer with anti-epidermal growth factor receptor antibodies:focus on panitumumab[J].Ther Clin Risk Manag,2008,4(6):1221-1227. |
| [15] | Amado RG,Wolf M,Peeters M,et al.Wild-type KRAS is required for panitumumab efficacy in patients with metastatic colorectal cancer[J].J Clin Oneol,2008,26(10):1626-1634. |
| [16] | Chua YJ,Cunningham D.Panitumumab[J].Drugs Today(Bare),2006,42(11):711-719 |
 2014, Vol. 30
2014, Vol. 30
